Contents
ApoE4: an emerging therapeutic target for Alzheimer’s disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6425600/
Mirna Safieh、1 Amos D. Korczyn、2 and Daniel M. Michaelsoncorresponding author1
要旨
背景
アルツハイマー病 (AD) の異質性を示す証拠の増加の体は、万能の治療に向けた失望の臨床研究と相まって、すべてのケースに適した単一の魔法の治療法の開発が可能ではないかもしれないことを示唆している。
これは、標的とした治療法が明確な遺伝的または病理学的特性を共有する特定の AD サブ集団のために開発されているパラダイムのシフトを求めている。アポリポ蛋白E4(アポE4)は、ADの最も一般的な遺伝的危険因子であり、アルツハイマー病患者の半数以上に発現しており、したがって、重要な可能性のあるAD治療ターゲットである。
レビュー
本レビューでは、まず、ADにおけるアポE4の病理学的効果に焦点を当て、対応する細胞モデルや動物モデル、そしてそれらを媒介する示唆された細胞および分子メカニズムに焦点を当てている。第二部では、動物モデルで開発され、ヒトへの翻訳が可能となった最近のアポE4を標的とした(アポE遺伝子からアポEタンパク質とその相互作用体への)治療アプローチに焦点を当てている。
さらに、アポE4の病理学的効果が、保護機能の喪失に起因するのか、毒性機能の獲得に起因するのかという問題についても本明細書で議論されている。それは、両方のメカニズムが共存し、他のものが保護機能の喪失に関連している間、アポE4分子の特定の構成要素および/またはその下流のシグナリングが毒性効果を媒介し、両方のメカニズムが共存している可能性がある。
結論
ApoE4は、まだ十分に研究されていない有望なAD治療ターゲットである。最近の研究では、アポE4を標的とした効果的なAD治療アプローチへの道が開かれつつある。
キーワード
アルツハイマー病、アポリポ蛋白E4、アポE4治療薬、アポE4脂質化、抗アポE4抗体、ヒトアポE標的置換マウス
背景
老人性認知症は、21世紀の最大の医学的脅威の一つである。そのため、当然のことながら、この新たな災害を防ぐために、かなりの知的資源と資金が投入されてきた。しかし、残念なことに、これらの努力はまだ実行可能な解決策を見出すことに成功していない。
脳機能の多くの障害は認知機能の低下につながるが、その中でもアルツハイマー病(AD)が最も多いと考えられている。ADの定義自体は単純ではない。人間の病気の中でユニークな、受け入れられた定義は、臨床症状(すなわち、認知症)と構造変化、すなわち脳内のアミロイドβ(Aβ)と高リン酸化タウの沈着(神経原線維のもつれ)の組み合わせを必要とする。他の様々な脳障害は、ADで観察されたものに匹敵する認知機能の低下をもたらす可能性があり、同様に、認知機能の低下を示さない人にも同じ病理学的変化が起こる可能性があるため、ADの診断には、特定の認知機能の低下と神経病理学的変化の両方を必要とする。したがって、それは預金に治療を集中しようとする試みは、これまでのところ失望をもたらしたことは驚くに値しない[1、2]。
用語AD自体が定義の変更を受けている。最初の記述以来、約50年間、ADは特にAβプラークと神経原線維性のもつれを持つ若年者の認知症の発症を説明するために使用されていた;現在、これは早期発症AD(EOAD)と呼ばれている。しかし、長年にわたって発見されてきたように、EOADは主に特定の遺伝子の遺伝子変異に起因するものである。それにもかかわらず、現在、ADと診断されている人口動態は、これらの突然変異のない高齢者である。
特定のEOAD突然変異の同定は、この病気の動物モデルの作成を可能にし、トランスジェニックマウスモデルはAD研究と実験的治療法の開発に革命をもたらした。それにもかかわらず、これらのモデルはEOAD [3]に特化したものであり、より一般的な晩発型の疾患(LOAD)には特化したものではないことを強調しなければならない。したがって、この疾患の両方の形態で役割を果たす異なる因子を考えると、これらのアプローチはLOADへの適用に重要な制限がある。さらに、マウスモデルの行動表現型は、ヒト疾患のそれとは実質的に異なる。ADマウスの認知障害は認知症のものと比較するとかなり軽度である。人間のADが最終的には無力になり、常にケアを必要とするのに対し、マウスは死ぬまで自立した状態を維持している。
LOADの危険因子を調査した疫学的研究では、重要な血管プロセスを含む多数の関連因子が明らかにされている[4、 5]。さらに、ゲノムワイドな関連研究によって多くの遺伝的関連が明らかにされている[6]が、その中でも最も重要なものは17番染色体上のアポリポタンパクE遺伝子(APOE遺伝子、apoEタンパク質)である[7]。他の多型は炎症や免疫応答、脂質代謝、エンドサイトーシス/細胞内輸送に関連する遺伝子と関連している[8]が、それらの遺伝子はどれも一般的ではなく、またapoEほど強い効果を持っていない。これまでのところ、ADに関与する分子過程を改変する試みは、主にAβと、より最近ではタウを標的としたものであった[1、 9];それにもかかわらず、これらの試みはほとんど成功していない。ここでは、あまり一般的ではないとはいえ、別の可能性のあるターゲットであるapoEについて述べる。
apoEの役割
いくつかの研究により、ADにおけるapoEの重要な関与が実証されている。これはStrittmatterとRoses [10]によって最初に示唆されたもので、APOE2、APOE3、およびAPOE4という3つの多型APOEのうち、APOE4の保因者はADを発症する可能性が高いことが示された。
さらに、APOE4キャリアの認知機能の変化は数年前に起こり、用量依存的な効果があることが示された。逆に、APOE2キャリアは、APOE3およびAPOE4キャリアと比較して「保護」効果があり、したがって、apoE4タンパク質は「毒性」であるように見えるのに対し、apoE2はADに対して「保護」されている。
この仮定は、理論的には、すべてのアイソフォームは、apoE2が最も強力な効果を持ち、apoE4が最も穏やかな効果を持つ、または、その逆に、すべてのアイソフォームは、程度の異なる「毒性」の特徴を持っている可能性があるので、ここでは批判的に議論される。したがって、アポEにはいくつかの効果があり、そのうちのいくつかは保護的な効果を持ち、他のものは毒性を持ち、アポE4はこれらの効果の中で最も有益な発現をしていない可能性が高いと考えられる。
このことは、アポE4の支配的な作用を知り、それが毒性なのか保護作用なのかを知ることで、アポE関連疾患の治療戦略に影響を与えることになるため、重要な意味を持つと考えられる。重要なことに、アポE4はAβとのクロストークを含む多くのプロセスに関与しており、脂質代謝や炎症に影響を及ぼすことが示されている[11-13];しかしながら、ADにおけるアポE4の効果を媒介するこれらのプロセスの相対的な重要性はまだ決定されていない。
もう一つの懸念事項は、異なるハプロタイプの血清、脳脊髄液(脳脊髄液)、そしておそらく組織の濃度が等しくないことである;APOE4のキャリアは他のアイソフォームのキャリアよりも血清および脳のアポE濃度が低く[14]、アポE効果のいくつかはその質ではなくアポE濃度に依存している可能性がある。最初に最も単純な仮定、すなわち、アポE4が脳に毒性であることを考えると、その作用をブロックすることは、ADの開発を遅らせるか、または停止する可能性があることを示唆している可能性がある。
アポE4の作用を特異的にブロックすることは、遺伝学的、生化学的、免疫学的な方法で達成することができる。そのようなアプローチは、アポE4を運ぶ40〜60%のアルツハイマー病患者を助けることになるが、すべてのアポE形態が実際には(程度の差はあれ)毒性があるのであれば、より良いアプローチは、これが不謹慎でできるのであれば、少なくとも成人の脳では、すべてのアポE作用をブロックすることになるだろう。
さらに、アポE タンパク質は肝臓で一次合成されているが、それはまた、脳で生産され、そこに多くの容量で多くの機能は、いくつかの AD に関連する可能性があるを考慮することが重要である。脳におけるアポEの主要な役割の一つは、体の残りの部分と同様に、脂質輸送とコレステロールの恒常性[15-17]に関連している。
ApoE4は低脂質であり、コレステロールの流出を誘導するのにapoE3よりも効果が低いことが示され、apoE4の病理学的効果が脂質代謝に関連していることが示唆された。この主張および本レビューで議論されているアポE4とAβとの相互作用、タウタンパク質のリン酸化、中膜機能の破壊などの他の機序論的研究は、全動物および試験管内試験(in vitro)での単離された組織の両方で、広範囲に実験的に研究されてきた。
しかしながら、これまでのところ、これらの研究は、単一の最も可能性の高い重要な経路とみなすことができる一つの機能を同定していない。それにもかかわらず、これらの実験方法の限界を批判的に検討する必要がある。特に、利用可能なモデルのどれも、複雑な疾患としてのADの代表的なモデルとは考えられないことを強調しなければならない。
さらに、ADモデルにおけるAβとタウの発現レベルは非生理学的であることが多く、下流のシグナル伝達効果の重要性を評価することは困難である。さらに、げっ歯類の内因性分子はヒトのAD分子とは異なる反応を示すことがある [18]。また、apoE4とADに関連しているすべての遺伝子(例えば、19番染色体上のAPOE遺伝子に非常に近くに位置し、その異なるアイソフォームがAPOE対立遺伝子に密接に関連しているTOMM40 [19])が動物モデルレベルで研究されているわけではないことにも注意することが重要である。
APOE遺伝子型が他の疾患に及ぼす影響
メタアナリシスに裏打ちされた数多くの研究により、APOE4は脳アミロイド血管症(CAA)[21]、レビー小体型認知症(DLB)[22]、タオパシー[23]、脳血管疾患[24]、多発性硬化症[25、26]、血管性認知症[24、27]を含む他の疾患[20]の危険因子であることが明らかにされており、また頭部外傷後の転帰不良[28、29]にも関連していることが明らかにされてきた。しかしながら、これらの疾患におけるAPOE2の関与はあまり明らかにされていないが、おそらくAPOE2キャリアの人口が少ないことが一因であると考えられる。APOE遺伝子型は加齢黄斑変性(AMD)においても役割を果たしており、逆説的にAPOE4は保護的である[30]。病理学的には、AMDは過剰な血管新生と関連しており、過剰な病理学的血管新生を減少させる抗血管内皮増殖因子(VEGF)抗体によって治療されている[31]。対照的に、apoE4が危険因子であるADやその他の疾患は、変性が亢進し、可塑性修復が損なわれていることが特徴である[32、33]。動物や細胞のモデル研究では、APOE4が細胞の可塑性の障害と関連していることが明らかになっている[32、 34、 35]。したがって、ADにおけるAPOE4の負の効果は、この神経細胞のシナプス可塑性の障害によるものである可能性が高いが、血管新生と血管可塑性の亢進が主要な病態であるAMDでは、網膜の病理学的新生血管の減少により、APOE4の効果は保護的である可能性がある[36]。
APOE4とDLBリスクとの関連については、APOE4はDLBスペクトル全体にわたって強力なリスク因子であり、純粋なシヌクレイン症の皮質で認知症を呈する可能性の増加と関連していることが示されている[22]。データの蓄積は、DLBの病態に対するAPOE4の効果が非アミロイド関連のメカニズムによるものであることを示唆しており、さらなる調査が必要である[22]。さらに、タウ症マウスモデルにおいて、APOE4がタウを介した神経変性を著明に悪化させることが最近明らかになっている。
疫学研究では、アルツハイマー病患者は脳血管疾患の負荷が高いことが一貫して示されている[39]。apoEは血漿コレステロールのキャリアであるため、異なるAPOEアイソフォームのキャリアにおける認知症への心血管疾患病理の寄与を決定することは興味深いことである。明らかに、APOE4キャリアは虚血性心血管系疾患を発症する可能性が高い(OR 1.68、95%CI 1.36-2.09)[40、41]。さらに、剖検に基づく研究では、APOE4は脳虚血の有意な危険因子であり、APOE3と比較して3倍に増加することが確認されている[42]が、その効果は比較的小さく、他の研究では確認されていない[43、 44]。さらに、蓄積されたデータからAPOE4と脳微小出血との関連が確認されており、これはleptomeningeal vessels周辺のアミロイド沈着に対するapoE4の効果によるものであると考えられる[45]。それにもかかわらず、これらの結果のほとんどは臨床観察に基づくものであり、紹介バイアスや診断の不正確さを伴う。
APOE4はADの最も一般的な遺伝的危険因子であるため、APOE遺伝子型が異なる治療標的を対象とした臨床試験の結果に影響を及ぼすことが報告されているのは驚くに値しない[46]。これらの知見は、治療標的がapoE4と相互作用する間接的な効果に起因していると考えられる。本レビューでは、APOE4遺伝子とapoE4タンパク質、およびapoE4の主要な下流標的に焦点を当てて、治療法の可能性を論じている。
示唆されているアポE駆動メカニズムのレビュー
ADの発表だけでなく、動物や細胞の研究は、アポE4の病理学的効果を媒介する可能性のある細胞や分子のメカニズムに関するいくつかの、相互に排他的ではない仮説の生成につながった。以下のセクションでは、アポEがADに関与する可能性のある主なメカニズムを要約する。
Aβの代謝
アルツハイマー病患者におけるAβの沈着は、非キャリアに比べてapoE4キャリアではより豊富である[47]。さらに、同様の結果は、認知的に正常な高齢者でも観察された(この関連性は痴呆患者で見られるよりも弱いが)[48-50]。上述したように、APOE4キャリアでは脳脊髄液および血漿中のアポE濃度が低いことから、アポE濃度が低いと脳内へのAβの蓄積が促進される可能性があることが示唆されている。さらに、ヒトのapoE4またはapoE3を発現する標的置換マウスを用いた動物モデル研究とそれに対応する試験管内試験(in vitro)研究により、apoE4はアミロイドカスケードのいくつかの重要なステップに影響を与えることが明らかになった。apoEがAβに結合し、Aβの12-28フラグメントでこの結合をブロックすると、Aβの生体内試験(in vivo)および試験管内試験(in vitro)の病理学的効果を打ち消すことが示されている[54]。これらの観察結果をまとめると、アポE4はAβ蓄積を調節する際に特定の脳領域に作用し、したがってADの発症において重要な役割を果たす可能性があることが示唆されている。
したがって、apoE4はガマセクレターゼの活性に影響を与えることでAβの産生を促進することが示唆されている[55]。クリアランスに関しては、apoE4はAβのリソソーム分解に障害を与え、血液脳関門(BBB)を越えてAβを輸送するのにはapoE3よりも効果的ではない。さらに、アポE4は、ネプリリシンとインスリン分解酵素によるAβのタンパク質分解を促進する能力が損なわれている[56-59]。最後に、アポE4は、アポE3よりもAβ凝集を促進し、Aβオリゴマーを安定化させる可能性が高く、アポE/Aβ複合体の形成を介してオリゴマーのAβフィブリルへの変換を阻害することが示されている[48、 60]。
AβとアポEの相互作用に関するより詳細な情報については、以前のレビュー[12、 48、 59、 61-65]を参照されたい。
タウリン酸化
高リン酸化タウは神経原線維のもつれの主要な構成要素である。アルツハイマー病患者と健常対照からの脳脊髄液サンプルの分析により、リン酸化されたタウと総タウの比がADのバイオマーカーとして機能する可能性があることが明らかになった [32、 66-68]。補完動物モデルは、タウの高リン酸化だけで神経変性を引き起こす可能性があることを示唆しており、研究者は高リン酸化タウは神経細胞に毒性があると結論づけ、高リン酸化タウがAD神経病理学において主要な役割を果たしていることを示唆している[66]。これは、アポEの大部分がアストロサイトによって合成されるアポE4標的置換マウス[69、70]や、アポE4の過剰発現が神経細胞のプロモーターの下にあるトランスジェニックマウス[71、72]を含むいくつかのマウスモデルで観察されている。さらに、タウの高リン酸化はストレスや傷害にさらされると亢進する [73]。これに対応する結果が細胞培養で実証されている [74]。
タウの高リン酸化に対するapoE4の効果を説明するために、2つの相補的なメカニズムが提案されている。第一に、apoE3はapoE4よりも非リン酸化タウとの結合に効果的であり、それによってタウの蓄積を防ぐという事実に基づく直接的なメカニズムである。第二に、神経細胞におけるapoE4は、その特異的な構造により分泌経路から逃れることができ[75]、細胞質内のタウと直接相互作用してその高リン酸化を誘導することが提案されている[76];この提案されている間接的なメカニズムは、apoE4に特異的なapoE受容体主導のシグナル伝達カスケードによって媒介され、それによってタウキナーゼやホスファターゼの機能が改変される可能性がある[77]。さらに、分泌経路から逃れるためのapoE4の増強された能力は、細胞内で亜鉛と相互作用し、erk活性化を介してタウタンパク質をリン酸化することを可能にしている[78]。
トランザクティブ応答DNA結合タンパク質43(TDP-43)
軸索スキップに機能するRNA結合タンパク質であるTDP-43は、最近、ADの脳に沈着していることが示された。TDP-43はアルツハイマー病患者の65~80%の脳に存在し、進行性の海馬萎縮と関連していることが示された。apoE4とタウ、Aβ、およびTDP-43との間の潜在的な関連をマッピングすることにより、apoE4とTDP-43との間の横断的な関連を調査した研究では、このタンパク質の沈着は、APOE3およびAPOE2キャリアと比較して、APOE4キャリアにおいても増加していることが示されている[79-81]。
脂質代謝
脳内で最も一般的なリポタンパク質であるアポEは、脳内の脂質の分布とリサイクルに重要な役割を果たす高密度リポタンパク質様粒子として、コレステロールやリン脂質と関連している[17]。このことから、脂質がアポE4の病理学的効果を媒介する上で重要な役割を果たしている可能性についての広範な調査が行われるようになった。神経細胞と脳機能に重要な必須ω-3脂肪酸であるドコサヘキサエン酸(DHA)の脳と脳脊髄液レベルの測定[82]により、DHAレベルはアルツハイマー病患者[83]とapoE4キャリア[84]で低下し、apoE4は異なる脳領域へのDHAの取り込みと取り込みを増加させることが明らかになった[85]。同様の結果は、アポE4発現マウス[86]で観察され、アポE4の脳の病理学的効果は、魚油高DHA食をマウスに与えることによって打ち消された[84、 87]。更なる研究により、アポE4はBBBの破壊[88]、リン脂質およびコレステロールの調節障害[63、 89、 90]と関連していることが明らかになった。
様々な細胞メカニズムにおけるコレステロールの重要な役割と、Aβレベルに対する顕著な影響[91]および関連メカニズムは、コレステロールがADの病態形成における重要なプレーヤーであることを示唆している[92、 93]。apoE4遺伝子型と高コレステロール値の両方を有する被験者は、これらの危険因子のうちの1つのみを発現する被験者よりも顕著な認知機能低下を有することが報告されている[94];しかしながら、そのような効果は他のヒトの研究では見られなかった[95]。マウスモデル研究では、ヒトのアポEアイソフォームを発現し、マウスのアポEを発現しない標的置換マウスにおいて、高コレステロール食がアポE4の病理学的効果を促進することが明らかになった[87]。これらの研究は、アポE4と脂質との間の関連を示唆しているが、明確なメカニズムや治療標的を提供していないことに注意することが重要である。
ヒトの脳脊髄液およびアポE標的置換マウスの脳内の異なるアポEアイソフォームの脂質化の程度を分析したところ、ヒトとマウスの両方において、アポE4はアポE3と比較して低脂質化しており、脳内アポE2が最も脂質化したアイソフォームであることが明らかになった[96、 97]。脳脊髄液 apoE4高密度リポタンパク質様粒子[17]は、apoE3キャリアよりもapoE4の方が小さく、脂質化が少ない[98、99]。脳内のapoEの脂質化はATP結合カセットタンパク質ABCA1とABCG1によって駆動され、前者はapoEの初期脂質化を駆動し、ABCG1によってさらに脂質化される[100]。ABCA1のダウンレギュレーションおよび欠失は、血漿および脳のアポEレベルを低下させ、より小さなアポE含有リポタンパク質粒子の形成と関連している[17、 101]。このことから、アポE4の病理学的効果はその低脂質化に関連している可能性があり、脂質化タンパク質ABCA1が有望な治療標的である可能性を評価することにつながった[103、 104]。この主張を支持する証拠を以下に示す(アポE4タンパク質へのアプローチを参照)。
ミトコンドリア機能
広範な研究により、ミトコンドリア機能障害に起因する代謝変化が AD で発生し [105] 、APOE4 キャリアで強調されるという証拠が提供されてきた。したがって、遺伝子発現研究により、ADにおけるAPOE4発現は、APOE3と比較して、酸化ストレスおよびミトコンドリア関連輸送タンパク質の発現に対するアイソフォーム特異的な効果に加えて、ミトコンドリア呼吸器複合体I、IV、およびVの遺伝子転写物のダウンレギュレーションと関連していることが明らかになった[106、107]。これらの知見は、APOE4キャリアがADの臨床的特徴の発症の数十年前にAD様の脳内グルコース代謝低下を発症するという事実と一致している[106、 107]。試験管内試験(in vitro)での研究により、apoE4が駆動するミトコンドリア機能不全は、F1ミトコンドリアATP合成酵素[108]とのアイソフォーム特異的な結合、活性酸素種のレベルを制御する能力の低下、および細胞骨格タンパク質との相互作用に関連していることが明らかになった[70、 109-111]。
神経炎症
活性化したミクログリア[112]と補体タンパク質[113]と脳のAD病変との関連、また、抗炎症薬で定期的に治療された関節リウマチ患者が比較的ADを免れているという発見は、神経炎症がADの病態形成に役割を果たしているという命題につながった[114]。ADと神経炎症との間のこの関連は、ADとCLUやTREM2などの異なる免疫関連遺伝子との間の顕著な関連を示した最近のゲノムワイドな関連研究によってさらに支持されている[115、 116]。
重要なことに、神経炎症はAPOE4キャリアでより顕著であり[117-119]、脳内ミクログリアとのapoEの共局在化[120、 121]を含む対応する動物モデル研究では、AD脳における自然免疫応答におけるapoEの役割を示唆している。このことは、マウスにおいて、炎症性刺激の後、APOE4キャリアは神経炎症反応を増強し、延長させるという知見によって裏付けられている[47、 122-124]。
この炎症は、ミクログリア活性化に対するapoE4の効果[60、 125]や炎症性サイトカイン[123、 126]のレベルを高めることによって駆動されていると考えられる。また、アポE4の炎症作用は、脳内の主要なmiRNAであるmiRNA146aに関連している可能性が示唆されている。この示唆は、miRNA146aのレベルが対応するマウスモデルよりもアルツハイマー病患者の脳内で高いという知見に由来する。
miRNA146aレベルの上昇は、炎症の負のフィードバック制御が不十分になり、慢性炎症を引き起こすことが示唆されている[127、 128]が、apoEのアイソタイプ特異的な効果はまだ十分に理解されていない。しかし、疾患の経過の中でいつ神経炎症が有益であるか毒性であるかという不確実性を考慮すると、ADとapoE4関連の炎症の治療のために標的とする炎症性分子のタイミングと選択はまだ決定されていない。
実際、この問題は、プロスペクティブな非ステロイド性抗炎症薬(NSAID)治療の有効性の欠如の根本的な原因であるかもしれない[129]。数多くの研究のメタアナリシスでは、認知およびADの全重症度に対するNSAIDsの有益な効果は明らかにされていない[129]。
それにもかかわらず、最近の疫学的データは、APOE4キャリアがNSAID治療に対してより良い反応を示すことを示唆している[61、62、89]。この効果の根底にあるメカニズムは完全には解明されておらず、炎症および酸化ストレスに対するAPOE4キャリアの感受性の高さと関連している可能性がある[130]。
それにもかかわらず、AD炎症関連研究はAPOE遺伝子型に応じて層別化されるべきであることは明らかである。
血管の完全性/機能
ApoEは、低密度リポタンパク質(LDL)受容体のリガンドとして機能し、脂質代謝に役割を果たしている;それはよく心血管疾患のコンテキストで記述されている[17、131、132]。剖検とイメージングを使用してAD脳での観察は、小血管の動脈硬化とアミロイド血管症に加えて、微小血管の完全性と減少した脳血流の崩壊を含む脳血管機能障害を示している。これらの脳血管障害は、APOE4キャリアでは非キャリアと比較して大きい[133-135]。
脳血管の完全性に対するapoE4の効果についてはいくつかのメカニズムが提案されているが、そのうちの1つは、CAAとして知られるAD脳血管系におけるAβの蓄積に関連している。CAAの有病率はAPOE4キャリアで上昇しており[21]、血管の完全性を著しく破壊し、血行動態の障害や血栓症だけでなく、BBB機能障害や微小出血を引き起こす可能性がある。さらに、ヒトでは認知機能障害と強く関連している[136、 137]。
ADの病態生理に関連する血管の変化に関与し、apoE4によって影響を受けるもう一つの分子はフィブリノーゲンである。フィブリノーゲンとフィブリンの両方がAD神経血管系に蓄積し[138]、Aβとの相互作用を介して、それらはフィブリン血栓形成の異常をもたらし、分解に関与する酵素に対してより抵抗性のある血栓構造をもたらす[139]。血管壁および中膜に沿ったフィブリンおよびフィブリノーゲンの蓄積は、アポEアイソフォームに依存している(アポE4 > アポE3)[140]。この結果の根底にあるメカニズムについては、さらなる研究が必要である。
血管の完全性に対するapoEのこれらの直接的な効果の他に、apoEアイソフォームはBBBを介したAβの排出効率にも影響を与えることに注意することが重要である[141]。したがって、apoE4はBBBを介したAβの排出を、高速LDL受容体関連タンパク質1(LRP1)依存性のトランスサイトーシスから、低速の超低密度LDL受容体(VLDLR)依存性のトランスサイトーシスへとシフトさせることで、BBBを介したAβのクリアランスを阻害している[141]。
インスリンおよびVEGFシグナル伝達
最近の進歩は、インスリンと VEGF カスケードの両方が AD で障害され、特に apoE4 の影響を受けていることを示唆している。ヒトおよび動物モデル研究では、ADは脳脊髄液中のインスリンレベルの低下とインスリン抵抗性と関連していることが明らかにされている[142]。これらの効果のAPOE遺伝子型特異性の検討により、ADにおける脳のインスリン代謝は様々なapoEアイソフォームによって異なる影響を受けていることが明らかになり[146]、また、apoE4は対応する細胞モデルおよび動物モデルにおいて神経細胞のインスリンシグナル伝達およびインスリン受容体トラフィッキングを障害することが明らかになった[147-150]。ADや軽度認知障害患者を対象とした臨床試験では、インスリンの経鼻投与やその他の方法を用いて、記憶や注意などの認知機能の全般的な改善が明らかになっている [142、 151、 152]。この効果のAPOE遺伝子型特異性の検討により、この治療法はAPOE4キャリアにおいて最も効果的であることが明らかになった[153]が、そのような特異性の欠如も報告されている[154]。
VEGFは、もともと重要な血管新生因子として記述されていたが、最近では神経新生および神経保護において重要な役割を果たし、神経細胞の可塑性および修復に影響を与えることが示されている[155]。ADは血清VEGFレベルの低下と関連しており[156]、その結果、認知機能の漸進的な低下と関連している[157]。VEGFとapoE4の間の特異的な相互作用は、ADと軽度認知障害の両方で報告されている[158]。動物モデル研究では、VEGFとその受容体(VEGFR-2)の脳レベルが、対応するapoE3マウスと比較して、apoE4を標的とした置換マウスの海馬で減少し、ウイルスベクターを利用した海馬VEGFのレベルのアップレギュレーションが、海馬ニューロンにおけるapoE4主導のAβと高リン酸化タウの蓄積、および関連するシナプスおよび認知障害を逆転させたことが明らかにされた[69]。
シナプス可塑性
最後に、おそらく記憶障害と認知機能の低下に非常に有意にリンクされているADのもう一つの特徴は、シナプス障害である。ApoEアイソフォームはシナプス可塑性と修復を異なる形で制御している。臨床研究では、APOE4キャリアは海馬の樹状突起棘密度が低いことが示唆されている[159、 160]。この所見は、apoE4マウスはapoE3マウスと比較して樹状突起棘密度と長さが低いという事実とよく相関しており[161-163]、アイソフォームの異なる神経保護機能を示唆している。
生後1ヶ月のマウスを用いた研究でも同様の結果が得られており、アポE4による神経回路の変化の早期発症を示唆していることは興味深い。シナプス可塑性の欠損をもたらすapoEの影響を受ける重要なプロセスの一つは、ニューライト(軸索または樹状突起)の伸長である。多くの証拠から、アポE3アイソフォームはアポE4よりも効果的にニューライトの成長を促進し、アポE4がニューライトの成長を阻害するケースもあることが実証されている。
いくつかのメカニズムが提案されている。第一に、神経突起の成長に主要な役割を果たすアポE受容体LRP1 [165] は、アポE3よりもアポE4の方が効果的に活性化されないことが示された [166]。第二に、アポEによるLRP1の活性化は、アポEがヘパリン硫酸プロテオグリカンと結合することによって増強され、アポE4と比較してアポE3ではより効果的であることが示されている[167]。さらに、神経突起の伸長および樹状突起の形態形成において重要な役割を果たし、apoE受容体2(apoER2)を介して刺激され得るアクチン重合のダイナミクスは、apoE4よりもapoE3によってより効果的に駆動される[168、 169]。
ApoE4とapoE3は細胞内輸送特性が異なる。したがって、エンドサイトーシス後、apoE3は容易にレトロエンドサイトーシスを受けるのに対し、apoE4はエンドソームに捕捉されたままであり、apoE4が細胞内輸送を詰まらせることを示唆している[170-172]。ApoE4は、apoER [55、 173]を含む多数の受容体のレベルのダウンレギュレーションと関連しており、インスリン[147、 148]、VEGF [69]、N-メチル-D-アスパラギン酸(NMDA)受容体[33、 55]などの成長因子や神経伝達物質受容体のレベルのダウンレギュレーションにも関与しており、これらは可塑性の障害にも関与している可能性がある。
ニューロン関連の直接的なメカニズムに加えて、神経突起の伸長に対するapoE4のアイソフォーム特異的効果は、ミクログリアの活性化および貪食の速度を制御することによっても媒介され得る[60、 123、 174、 175]だけでなく、脳の自然免疫系の一部である補体タンパク質C1qの活性化によっても媒介され得る[176]。
要約
示されているように、apoEはいくつかの機能に関与しており、その多くはADに潜在的に関連している。アポE3とアポE4の効果を比較した研究では、アポE4の期待されるより悪い機能が強調されている。しかし、これらの研究は主に動物を用いて行われたもので、期間が短く、定量的ではなく定性的なものであった。したがって、どれが、もしあれば、ヒトの形態の疾患に関連していると結論づけることは困難である。
ADの病理学上のapoE4の効果を駆動する上で議論されたメカニズムの相対的な貢献、および潜在的な治療標的を提供する上でのそれらの使用は、まだ決定されていない。さらに、アポE4とADとの関連は、男性のアポE4キャリアよりも女性の方が顕著であり、特定の性関連ホルモンまたはその欠如がアポE4の病理学的効果を媒介する役割を果たしている可能性を示唆していることに留意することが重要である[177、 178]。
アポE4を標的とした治療アプローチのレビュー
ヒトの研究は、様々なハプロタイプのキャリア間の違いを比較することしかできず、したがって、アポE4の効果が毒性であるのか、単に保護力が低下しているだけなのかを判断することはできない。トランスジェニック動物のいずれかを完全にアポEを欠いているか、または異なるヒトのハプロタイプを運ぶこの重要な質問に答えるのに役立つ。
そのような研究では、脳内のAβの蓄積などの重要なAD病理学的効果が、アポE欠損マウスやアポE3マウスよりもアポE4で有意により顕著であることが明らかになり、これらの効果は毒性の獲得メカニズムを介して媒介されることを示唆している[23、 173、 179、 180]。しかしながら、アストロサイトの活性化やシナプスの喪失などの他のapoE4主導の表現型は、apoE欠損マウスで観察されたものと類似しており[181]、これらはapoE4の機能喪失メカニズムによって駆動されていることを示唆している。
したがって、ADと対応するマウスモデルの両方における脳のアポE4のレベルがアポE3のレベルよりも低いので[182、 183]、アポE4の効果もまた、機能メカニズムの損失を介して駆動される可能性がある。したがって、ADにおけるapoE4の効果は複数のメカニズムによって駆動される可能性があり、そのうちのいくつかは毒性の獲得によって駆動され、いくつかは保護機能の喪失によって駆動される可能性がある[117]。このようなメカニズムの相対的な寄与は不明であるため、アポE4関連のアプローチがアポE4の毒性を打ち消すことに焦点を当てるべきか、あるいは損なわれた保護メカニズムを逆転させることに焦点を当てるべきかを推奨することは、現在のところ不可能である。
このジレンマに鑑み、我々は、アポE4を指向した治療アプローチは、主にアポE4分子に焦点を当て、アポE4の効果を中和すること、例えば、抗体を用いてアポE4を除去することによって、アポE4の効果を中和することの有効性と、アポE4の脂質化に影響を与えることによって、アポE4分子/粒子の構造をアポE3の構造に類似させることの有効性の両方を評価すべきであると考えている。これらの相補的なアプローチによって得られた答えは、その後、AD指向のアポE4治療法の設計のための道を開くことができる。
以下、我々は治療アプローチが開発されているアポE4の側面に焦点を当てている。apoE4の効果の基礎となる分子機構のより包括的なレビューは、利用可能なレビュー[17、 55、 62、 64、 184]に記載されている。我々はまず、APOE遺伝子に焦点を当て、APOEに対するクラスター化規則的に間隔を空けた短いパリンドロミックリピート(CRISPR)遺伝子編集によって達成された進歩に焦点を当てる。
また、APOE4タンパク質を標的としたアプローチについて、その効果を打ち消し、構造を変更する試みに焦点を当てて議論する。また、アポE4とAβやアポE受容体、シグナル伝達カスケードなどの標的タンパク質との相互作用に着目した下流のアプローチについても検討している。最後に、アポE4と血管系や炎症系との相互作用に関連した治療標的の可能性に焦点を当てている。
CRISPRによるAPOE4の遺伝子編集
APOE4遺伝子をAPOE3またはAPOE2に変換し、両者の濃度差をなくせば理想的な治療法となり、アポE4の効果の根底にあるメカニズムの不完全な理解にもかかわらず、アポE4の問題の核心を解決することができるだろう。遺伝子の精密な編集を可能にする遺伝子編集CRISPR技術[185]が開発される前には、このようなことは不可能であったであろう。
この技術はAPOE遺伝子に特に適しており、APOE4をコードするDNAが、ADのより良性のアイソフォームであるAPOE3とはわずか1ヌクレオチドの違いである(すなわち、位置112はAPOE4ではアルギニンであり、APOE3ではシステインである)。理想的には、CRISPR技術は、APOE4対立遺伝子をAPOE3に変換するために適用され得る。
しかし、APOE3/APOE4ヘテロ接合体マウスをAPOE3ホモ接合体に変換することで、APOE4の毒性効果を仮定した場合には、APOE4ノックアウトのパラダイムに適用することも可能である。CRISPR細胞培養研究により、APOE4をAPOE3誘導体に特異的に変換することが明らかになり[186]、APOE3の発現に影響を与えずにAPOE4を消音する技術が適用された[187]。
後者のアプローチは、アポE4に関連した毒性の増加を治療的に打ち消すことが期待されている。しかしながら、アポE4マウスへのCRISPRの生体内試験(in vivo)適用の成功例はまだ報告されていない。さらに、CRISPR技術はまだ黎明期にあり、標的遺伝子のすべてのコピーが編集されるわけではないオフターゲット遺伝子編集やモザイク化に関するデータがまだ出てきていないことに注意することが重要である。
アポE4タンパク質へのアプローチ
アポE4の低脂質化の逆転
ABCA1がアポEの脂質化において主要な役割を果たし、アポE4が低脂質化しているという知見は、アポE4の病理学的効果がその脂質化の程度に関連していること、およびABCA1活性を高めることによってアポE4の病理学的効果を打ち消すことが可能である可能性があることを示唆することにつながった。ABCA1の発現はLXR/RXRによって制御されており、ベキサロテンや9-シスレチノイン酸などの薬物による処置によって生体内試験(in vivo)で活性化され得る[96、 103、 188]。これらの薬剤でアポE4とアポE3マウスを処置すると、両群のABCA1のレベルが上昇する;これは脳のアポE4の脂質化の特異的な増加と関連していたが、アポE3の脂質化には効果がなかった。apoE4とapoE3の脳リポタンパク質粒子の正確な脂質組成と、その組成がapoE4に関連する脂質のクラスとレベルの違いによるものであるかどうかは、まだ明らかにされていない。また、ABCA1の発現を増強することは、海馬ニューロンにおけるAβや高リン酸化タウの蓄積、ニューロンやシナプスの障害、認知障害など、主要なapoE4表現型の反転に関連していることが、apoE3マウスとapoE4マウスを用いた追加研究で明らかになった[96、 188]。同様の結果は、ABCA1をABCA1アゴニストで直接活性化するという別のアプローチでも得られている[96、 103]。これらの動物および細胞モデル研究は、関連するトランスポーターABCA7 [191]と同様に、ADがABCA1 [189、 190]の多型と関連していることを明らかにした遺伝学的研究と一緒に、アポE4がABCA1によってより効果的に脂質化され、結果として生じる低脂質化されたアポE4が、アポE4の病理学的効果を媒介する上で重要な役割を果たしていることを示唆している。ABCA1によるapoE4の脂質化が減少するメカニズムはまだ解明されていない。しかしながら、apoE4マウスとapoE3マウスにおけるABCA1のレベルは同程度であるため[102、 103]、apoE4の低脂質化は、apoE4とABCA1との相互作用を妨げる分子間のコンフォメーションの違いによるものである可能性が高い。これらの知見は、アポE4が低脂質化されていること、およびこれがアポE4の病理学的効果を促進する上で重要な役割を果たしている可能性があることを示す強い証拠を提供している。したがって、ABCA1はADのアポE4関連の治療ターゲットとして有望であり、新規で薬効のあるABCA1の脳内浸透活性化因子の開発に向けたトランスレーショナルな研究が求められている。
抗アポE4免疫療法
アポE4免疫療法の基本的な考え方は、Aβやタウ免疫療法と同様であり、これらの分子に対する抗体を末梢に導入または生成し、その抗体が脳内に浸透した後、標的を中和することができる(このアプローチはアポE4の毒性効果を前提としている)。理論的には、アポEに対する免疫療法の応用は、末梢のアポEのレベルが脳内のレベルよりも約10倍高く[17]、その結果、抗アポE抗体は脳に到達する前に末梢で滴定される可能性があるという問題に直面している。
この予想に反して、Holtzmanグループは、アミロイド前駆体蛋白質トランスジェニックマウスを用いて、抗マウスapoEを末梢に投与することで、プラーク発症前のアミロイド蓄積を抑制し、プラーク形成後のアミロイド蓄積を減少させることを示している[192、 193]。抗アポEモノクローナル抗体のこれらの中心的な効果の根底にあるメカニズム、および末梢アポEによって滴定されない理由はまだ完全には解明されていないが、これらの知見は非常に重要であり、治療的アプローチとしての抗アポE4免疫療法の有効性に関する概念実証を提供するものである。
このアプローチは現在、アポE4と特異的に反応する抗体を用いて、アポE4およびアポE3を標的としたマウスに拡張されている[194]。これにより、これらの抗体を用いたマウスの腹腔内注射を繰り返すと、脳内に抗体が蓄積され、アポE4マウスに特異的にアポE/IgG複合体が形成されることが明らかになった。これは、アポE4マウスにおける認知障害の逆転と同様に、アポE4の主要なAD関連およびシナプス病理学的効果の逆転と関連していた[194]。apoE4とapoE3ホモ接合マウスを用いて行われたこれらの実験は、apoE4の主要な病理学的効果が毒性機構の獲得を介して媒介されているという示唆と一致している。
アポE4構造補正因子
ApoE4は、このアポEアイソフォームに特異的な分子内ドメイン相互作用を仮定しており、その病理学的効果を媒介していると考えられている[106]。N 末端と C 末端が蛍光標識されたアポE 分子をハイスループットスクリーニングアプローチと組み合わせて利用することで、アポE4 ドメイン相互作用を阻害し、試験管内試験(in vitro) でのアポE4 の主要な病理学的効果を打ち消す低分子の薬剤化可能な分子が同定された [195]。
アポE分解
ApoE4 は中間的なモルテングロビュール構造を形成しており、これは apoE3 よりも安定性が低く、上述したように N 末端と C 末端の相互作用と関連している。このドメイン相互作用により、アポE4は異なるプロテアーゼに対して特異的に感受性を示し、アポE4のカルボキシ末端神経毒性フラグメントの生成につながる[76、 77、 196、 197]。
ストレスは神経細胞におけるアポEの産生を増加させるので、ストレス下での神経細胞内アポE4断片の産生の増加は、アポE4の病理学的効果を促進する上で重要な役割を果たしていることが提案されている[76、 77、 196、 197]。神経細胞のアポE4分解に関与するプロテアーゼの同定とそれらに対する阻害剤の開発は、アポE4の影響を打ち消すためのもう一つのアプローチである。
アポE4と相互作用する分子と下流のシグナル伝達
前節では治療標的としての APOE 遺伝子とタンパク質に焦点を当ててきたが、ここでは apoE が相互作用する分子に焦点を当て、その相互作用の研究が新規治療標的の同定にどの程度つながるかを見極めることにする。
アポE4とその遺伝子とは異なり、アポE4相互作用体の焦点と相対的な重みは、アポE4が駆動する病態に対するアポE4とAβおよびタウとの相互作用の相対的な寄与のような先験的な仮定に影響される。次に、既知のアポEインタラクターの治療の可能性と限界を強調する。
アポE誘導型抗アミロイド治療
健常対照者およびアルツハイマー病患者の脳におけるAβの沈着は、APOE4キャリアでは高く[198-202]、APOE2キャリアではAPOE3キャリアと比較して低く、健康なAPOE4キャリアでは対応するAPOE4非キャリアよりも早く発現している[203]。動物モデル研究では、apOEがアミロイドカスケードのいくつかの重要なステップに影響を与えることが明らかになっている。
これらの知見は、アポE4の病理学的効果の重要な側面が、Aβおよびアミロイドカスケードとの相互作用を介して媒介されていることを示唆しており[184、 204]、またアミロイド負荷の低減を目的としたアポE関連の治療戦略の開発につながった。これは、アポEに結合し、Aβの毒性とフィブリル形成を緩和する非アミロイド性Aβ由来のペプチドを利用した試験管内試験(in vitro)で最初に達成された[205]。
最近の生体内試験(in vivo)実験では、ヒトのapoE4とapoE3の両方を認識し、脂質化されたapoEよりも非脂質化されたapoEに優先的に結合する抗体を用いて、トランスジェニックマウスにおけるAβ沈着の減少を明らかにした[206]。アミロイド病理の減少もまた、apoEアンチセンスオリゴヌクレオチドを用いて得られた[52]。
apoE4とapoE3が異なる形で直接Aβに結合するという受け入れられている知見[53]は、最近Vergheseら[207]によって挑戦されており、したがって、apoE4とAβの間のクロストークは間接的で、第三の分子を介して媒介されている可能性がある。これらの研究は、脳内のアポEのレベルを低下させることによってアミロイド負荷を減少させることができることを明確に示しているが、この効果のアポEアイソフォーム特異性、および脳のAβおよびアポE4の他の病理学的効果に対するアポE4の全体的なアイソフォーム特異的効果を緩和することができる範囲は、まだ決定されていない。
アポE受容体関連のアプローチ
apoE の主な生理作用は、LDL 受容体(LDLR)、LRP1、VLDLR、および apoER2 をキープレイヤーとして含む低密度リポ蛋白質受容体ファミリーによって媒介される。これらの受容体へのアポEの結合は、非脂質化アポEはLRP1およびVLDLRに優先的に結合するのに対し、脂質化アポEはLDLRにより効果的に結合するように、アポEの脂質化の程度によって影響を受ける[48、 74、 208]。
さらに、LRP1およびapoER2は、apoE4およびapoE3によって異なる影響を受ける[55、209]。アポE4の受容体媒介効果は、NMDA、インスリン、およびVEGF受容体[33、69、147]、ならびにアミロイド前駆体タンパク質およびアポER2[173、210]を含む多数の受容体の内部化およびその後の分解の増加と関連していることに注目すべきである。
apoE4によって影響を受ける受容体の多様性は、apoE4が一般的な受容体リサイクル機構を損なうことを示唆している。アポE受容体の薬理学は、古典的な神経伝達物質受容体の薬理学ほど豊富で汎用性の高いものではなく、したがって、アポE4の効果を打ち消すためのこの受容体指向の薬理学の応用は考えられていない。
しかしながら、アポE4の主な効果の1つは、アポER2[12、33、69]のようなアポE受容体のレベルを低下させることであるので、適切なベクターを利用してアポER2の発現を増加させることによって、この効果を補正することが1つの可能な治療的アプローチであり得る。
アポE模倣薬
さらなる治療アプローチは、アポE模倣ペプチドの使用である。これらの小さなペプチドは、アポEの受容体結合ドメイン[211-213]または両親媒性螺旋ドメイン[213]のような異なるアポEドメインに対応しており、脳障害後の神経変性を著しく減少させ[212、 214-217]、トランスジェニックマウスおよび対応するモデルにおいて、Aβおよびタウ駆動型の病態から保護している[211-213]。
アポE模倣ペプチドの保護効果の根底にあるメカニズムは、その抗炎症作用に起因すると考えられる。しかし、これらのペプチドは、アポE4とアポE3の両方のマウスで脳梗塞後に保護効果を示したことに留意すべきである[212]。このように、これらのアポE模倣ペプチドがアポEによって認識される部位で作用し、結合すると仮定すると、このアプローチはアポE4の機能喪失の側面に対処していると見ることができる。
ApoE2に焦点を当てた治療アプローチ
アルツハイマー病患者におけるapoE2の有病率(2.8~4.5%)は一般集団に比べて約2倍低く、非apoE2 アルツハイマー病患者で観察されたものよりも顕著ではない脳病理と関連している[218]。APOE2ヘテロ接合性はまた、長寿[219]および加齢に伴う認知機能低下の減少[220]とも関連している。
したがって、シナプスおよび神経細胞の喪失に関連する神経変性疾患では、これらのプロセスの修復を刺激する能力により、apoE2は保護的である。しかし、網膜の過剰な血管新生が重要な病理学的特徴である加齢性AMDでは、apoE2は可塑性プロセスを刺激することで病理学的特徴に寄与しているようであり、この場合、神経血管新生の亢進を意味する。
いくつかの研究は、標的置換マウスにおけるアポE4の脳病理学的効果が、アポE2を発現するウイルスベクターの脳内注射によって打ち消されることを示唆している[97、 221]、新規な抗アポE4治療アプローチを示唆している[222]。重要なことに、これらの研究の一つでは、アポE4はアポE3と比較して低脂質であり、アポE2はアポE3と比較して高脂質であることも示されている[97]。
apoE4とapoE2は同じプロセス、すなわちapoEの脂質化に影響を与えながらも、それを反対の方向に推進する可能性がある。しかし、apoE2とapoE4が、相反する生理学的結果を伴う異なる非重複経路を介して作用する可能性を排除することはできない。
アポE4と炎症
いくつかの炎症関連の標的が提案されている。これらにはミクログリアが含まれており、ミクログリア活性化の異なる段階に関連する遺伝子発現パターンが最近明らかになったことで、ミクログリア活性化を調節することができる新しい標的が提示されている[223、 224]。これらの進展とapoE4と神経炎症の増加との関連性(上記のミトコンドリア機能の項を参照)は、炎症関連の治療がAPOE4キャリアにおいて特に有効である可能性を示唆している。
しかし、神経炎症は諸刃の剣であり、初期段階では防御的であり、その後の慢性段階では病的であると考えられている。したがって、アポE4およびAD関連の免疫療法戦略の適用は、患者が治療される炎症反応の段階に依存すると予想される。さらに、これは異なる脳領域間で異なる可能性がある。この問題を解決するためには、神経炎症のステージと脳の部位を特定する新しいバイオマーカーが必要である。
ApoE4と血管系
高血圧、糖尿病、動脈硬化などの血管リスク因子は、ADのリスクを増加させる[134、 226]。アポE4は血管性痴呆やアテローム性動脈硬化症のリスクの増加[227、 228]だけでなく、血管系およびBBBの完全性の低下[229]と関連しており、ADへのアポE4の寄与は、少なくとも部分的には、血管系の成分によって駆動される可能性があることを示唆している。
アポE4のAD関連血管効果が媒介される分子の同定、そしてそれによってAD-アポE4血管治療ターゲットとして機能し得る分子の同定は、現在のところ未解決のままです[134]。しかしながら、血管疾患の重要な側面は薬理学的および生活習慣の修正によって治療することができるので[230]、そのようなアプローチは、血管およびapoE4/血管病理のADへの寄与を減少させることが期待されている。
転写因子としてのアポE4
示唆されているほとんどのアポE4 の病理学的メカニズムは、細胞外、膜輸送、細胞質プロセスを介して駆動されるのに対し、最近では、アポE4 は核内転座も行い、多数の DNA サイトに特異的かつ高い親和性を持って結合することが示唆されている [231]。これらの部位の多くはプロモーター領域に位置しており、アポE4はオートファジーや成長因子関連遺伝子を含む多数の多様な遺伝子の転写因子として作用することが示唆されている[232、 233]。最近の研究では、アポE4が核内に局在し、この過程がアポE4の特異的なタンパク質分解に関係していることが示唆されている[234]。これらの知見と、アポE4が老化やAD [235]にリンクされたプロセスの範囲に関与する遺伝子のプロモーターに結合するという観察は、アポE4が転写因子として作用する可能性があるという挑発的な提案につながった。アポEがどのように小胞体を脱出して核に輸送されるのか、また他の病理学的プロセスとの関連でこのメカニズムの影響など、多くの重要な疑問があるが、まだ解明されていない。この点での重要な課題は、アポE4の核への移動を阻害することによって、アポE4の病理学的効果がどの程度打ち消されるかを決定することであろう;明らかに、これらの新しい観察結果を確認する必要がある。
まとめ
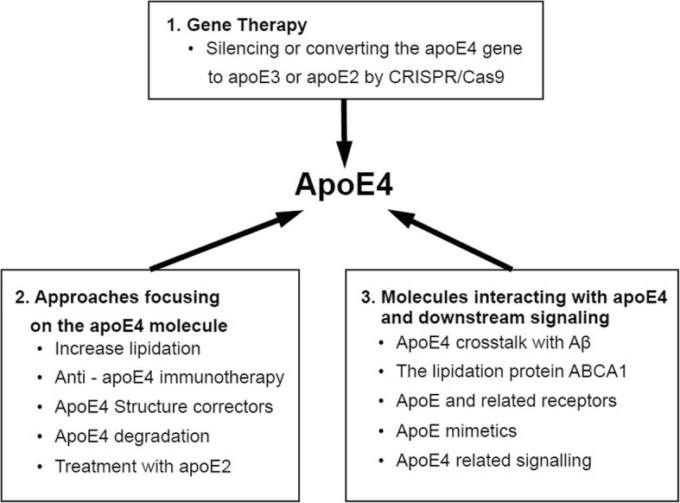
我々は、動物および細胞モデル系の両方で、APOE遺伝子からアポEタンパク質およびその相互作用分子に至るまで、多くのアポE4を指向したアプローチを記述した。これらの実験的アプローチ(図1)は、マウスにおけるアポE4の病理学的効果を打ち消すために開発された。現時点では、ヒトにおけるアポE4を標的とした治療法の臨床試験はほとんど行われていないが、動物モデル研究の進歩により、これらの知見を実験室から臨床へと応用するための原動力となることが期待されている。
図1 apoE4を標的とした可能性のある治療法
ApoE4誘導療法は、軽度の認知障害や海馬萎縮などの画像変化などの初期症状を示すAPOE4キャリアに最初に投与される。本プロトコルが成功した後、より進行した病期に投与した場合の本治療法の効果が評価されることになる。薬物の安全性プロファイルに応じて、APOE4キャリアへの予防的投与も検討される可能性がある。
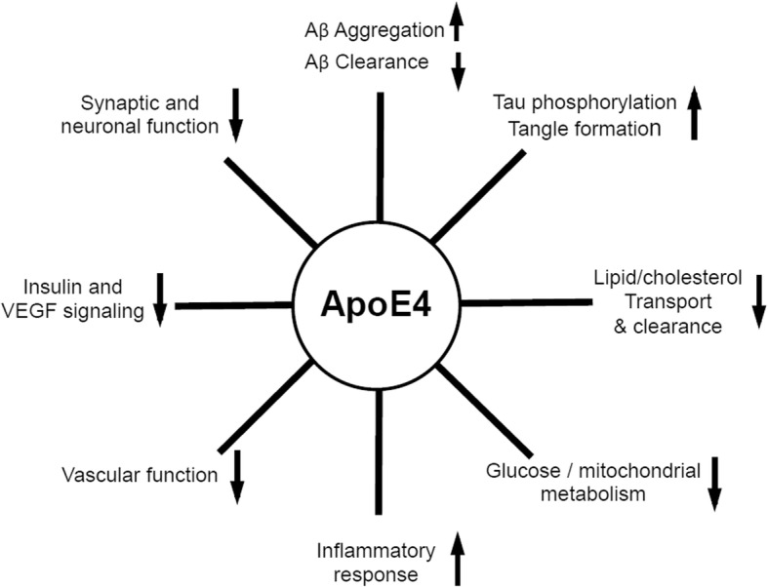
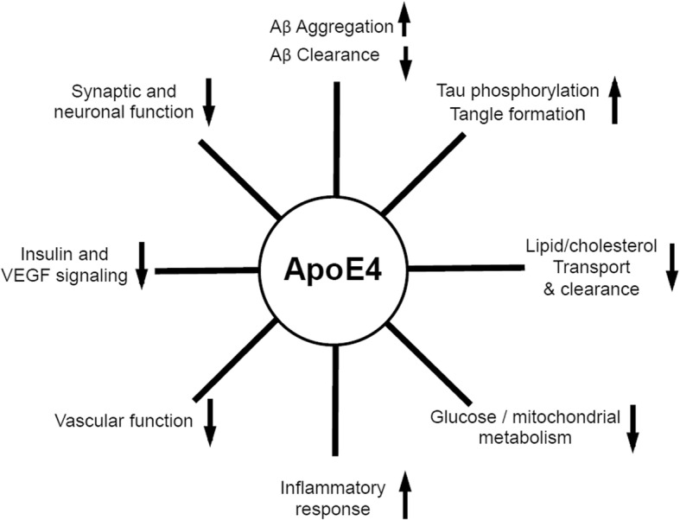
提案されているすべてのapoE駆動の病理学的メカニズムの概略を図2に示する。
図2 ADの病態に関与するアポE4駆動機構の模式図
結論
apoE4に関連した特定の治療法が今後開発されることは、いくつかの疑問を投げかけている。第一に、この治療法は予防的なものではなく、治療的なものになるのだろうか?言い換えれば、APOE4対立遺伝子を持つアルツハイマー病患者がこの新しい治療法で治療することで改善する可能性はあるのだろうか?
そのような治療法は、APOE4キャリアの衰えを遅らせる可能性はあるが、神経変性過程を完全に食い止めることはできないだろう。
したがって、抗APOE4療法の最大の可能性は、病気を治すというよりも、認知症の発症と進行を遅らせることにある。もし、APOE4対立遺伝子を持つ非認知症患者に抗APOE4療法を開始した場合、APOE4対立遺伝子ごとに発症を少なくとも約7年遅らせることが可能である。
抗APOE4療法のもう一つの利点は、心血管疾患、特に冠動脈疾患や頭部外傷後の修復障害など、関連する病的疾患の減少であると考えられるが、これはAPOE4キャリアに多く見られるものである[236]。
略語
AD アルツハイマー病
AMD加齢黄斑変性症
アポE アポリポタンパクE
apoER アポリポタンパクE受容体
Aβアミロイドβ
BBB血液脳関門
CAA脳アミロイド血管症
CRISPRクラスター型規則的に間隔をあけた短い回文リピート
脳脊髄液
DHAドコソアヘキサエン酸
レビー小体を伴うDLB型認知症
EOAD 早期発症型アルツハイマー病
LDL低密度リポ蛋白質
LDLR LDL受容体
LOAD後期アルツハイマー病
LRP1 LDL受容体関連タンパク質1
NMDA N-メチル-D-アスパラギン酸
非ステロイド性抗炎症薬
VEGF血管内皮増殖因子
VLDLR 超低密度リポ蛋白質受容体