APOE Alleles and Diet in Brain Aging and Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7297981/
要旨
APOE遺伝子対立遺伝子は、腸から脳に至るまでの多様な多面的効果を持つ、多くのレベルでヒトの老化と食事への応答を修飾する。APOEアイソフォームと食事の相互作用を理解するために、我々はAPOEタンパク質の細胞内輸送がエネルギー代謝、免疫系、生殖にどのように影響を与えるかを解析している。
年齢的に加速するAPOE4対立遺伝子は、脂質とグルコース代謝を媒介する細胞表面受容体のエンドソームトラフィッキングを変化させる。
APOE4対立遺伝子はヒトの先祖代々の対立遺伝子であり、ヒトではAPOE3,そしてAPOE2が加わっている。高感染、不確実な食物、および平均寿命の短い状況下では、APOE4は死亡率を減少させるために適応的である可能性がある。
ヒトが現代の感染力の低い環境に移行し、寿命が延びるにつれて、APOE4は老化関連疾患のリスクを増加させ、特に動脈と脳に影響を与えた。
APOE4とグルコース調節障害および体重との関連は、多くの加齢関連疾患を促進する。さらに、APOE遺伝子座は19番染色体上の隣接遺伝子と相互作用しており、神経変性や代謝を修飾するハプロタイプが存在することから、複雑な遺伝子環境相互作用が予想される。
本研究では、食生活とアルツハイマー病リスクがAPOE遺伝子型によってどのように変化するかについて、動物実験とヒト実験の両方で検討し、ギャップを明らかにした。APOE対立遺伝子がヒトの老化における栄養因子をどのように変化させるかについては、多くの不明な点が残されている。APOE遺伝子複合体におけるリスクバリアントハプロタイプの同定は、環境条件に対するホメオスタティックな適応応答を明らかにすることになる。
キーワード
APOE、アルツハイマー病、食事、老化、遺伝学
序論
循環中のリポタンパク質は、脂質の結合および輸送において3つの主要な役割を持っており、それらは相互に依存しており、細胞間および異なる細胞コンパートメント内で脂質を交換する能力に大きく依存している。
- 第一に、リポタンパク質は、細胞のエネルギー源として脂質を供給する。
- 第二に、リポタンパク質は、副腎と生殖腺に、産前と産後のステロイド合成のためのコレステロールを供給する。
- 第三に、リポタンパク質は、病原性の有無にかかわらず、自然免疫系、感染生物に対する感受性と反応を調節する。
これらの相互依存的な役割は、生殖機能と免疫機能のために十分なエネルギー基質を維持し、短時間の絶食にも耐えられるようにする。リポタンパク質は、細胞成分の脂質由来のエネルギー前駆体の効率的なパッケージングを提供する。血漿中のトリグリセリドに由来する脂肪酸は、筋肉によるエネルギー産生に利用され、過剰になると、脂質は貯蔵のために脂肪細胞に誘導される。
血液中の脂質輸送は、特定のアポリポ蛋白質(アポ)リポ蛋白質受容体、脂肪分解酵素、およびトランスファー蛋白質によって制御されており、これらの蛋白質は、組織および血漿中のコレステロールおよびトリグリセリドの恒常性のバランスを維持するために協調して作用する。アポリポ蛋白質の中でも、アポEは3種類の対立遺伝子を持ち、ヒトの老化に複数の影響を与えている。アポEのβアミロイド(アミロイドβ)ペプチドへの結合、ミトコンドリア代謝、細胞核内の潜在的な転写因子としての役割が明らかになってきている。
APOE遺伝子対立遺伝子であるε2(APOE2)ε3(APOE3)およびε4(APOE4)は、2つのアミノ酸残基で異なる(表1)。メジャー対立遺伝子APOE3の保有率は48%〜94%の範囲であり、一方、マイナー対立遺伝子APOE4の保有率は3〜41%のより広い範囲を世界的に有している(表1,Singh et al 2006; アミロイドβondio et al 2019)。
APOE対立遺伝子は、老化関連疾患、特に心血管疾患(心血管疾患)脳卒中、パーキンソン病、レビー小体型認知症、多発性硬化症、および後期発症アルツハイマー病に大きな影響を与える。APOE対立遺伝子の根本的な病理学的役割は、老化中の代謝への影響という観点から理解される可能性があり、これは我々の食生活を最適化するための意味合いを持っている。
これらの質問は、感染症への適応応答が生殖を促進するが、老化関連疾患のリスクを増加させる可能性がある方法についての洞察を持つエネルギー代謝に関連するAPOE細胞生物学の基本的なメカニズムを検討することによってアプローチされている。
また、異なる民族集団におけるAPOE遺伝子群と疾患リスクについても議論する。最後に、細胞のエネルギー嗜好性に対するapoEの効果が、過去の臨床試験で失敗したことへの洞察をどのように与えるか、また、apoEをより包括的に理解することで、新しい研究デザインや創薬標的の開発をどのように可能にするかを検討する。
表1 ヒトAPOE多型と種による違い
| A:ヒトAPOE多型と種による違い | |||
| ApoE残基(成熟ペプチド) | 61 | 112 | 158 |
| ApoE2 | アルギニン(R) | システイン(C) | C |
| ApoE3 | R | C | R |
| ApoE4 | R | R | R |
| チンパンジー | スレオニン(T) | R | R |
| マウス | T | R | R |
| B:APOE 2および4対立遺伝子:有病率と主な特徴 | |||
| APOE 4 | APOE 2 | ||
| 人口頻度* | 3-41% | 1-38% | |
| R61-Glu255ドメインの相互作用 | 現在 | 不在 | |
| タンパク質凝集 | 増加 | 下 | |
| 生化学的性質 | 脂質への強化された結合 | E3およびE4と比較してLDL受容体への結合が減少 | |
| 脂質代謝 | 高コレステロール血症高トリグリセリド血症 | わずかな割合で高トリグリセリド血症 | |
| BMIと病気の関連 | 特に加齢に伴うBMIの低下 | ホモ接合体によるより大きなBMI | |
| インスリン抵抗性 | 増加 | 下 | |
| 慢性炎症 | 炎症に対する反応の増強 | 炎症に対する反応が低い | |
| 脳アミロイドプラークの蓄積 | 増加 | 下 | |
| アルツハイマー病のリスク | 増加 | 保護 | |
| 血液脳関門の完全性 | 妥協 | 研究されていない | |
| 血管系 | アテローム性動脈硬化症の増加 | 混合。心臓病から保護しますが、頭蓋内出血のリスクを高めます | |
*アボンディオ et al 2019):1000 Genome ProjectのデータをSingh et al 2006)と統合したもの。
ApoEの構造と機能
アポEリポ蛋白質は、空腹時および食後の組織間のコレステロールおよび脂質のフラックスに重要な役割を持っている。交換可能なアポリポ蛋白質として、アポEは、より大きな脂質を含むVLDL粒子と、より小さなタンパク質を含むHDL粒子との間をシャトルする(Blum, 1982)。VLDL上では、アポEはLDL受容体(LDLR)ファミリーなどのアポE受容体を介して、VLDLクリアランスと細胞内への脂質負荷を促進する。脂肪分解後、apoEは、半減期が長く、より複雑な機能を持つHDL粒子に交換される。VLDLはHDLよりも早く異化され、表面のアポE受容体への親和性が高い。これらの生化学的特性は、VLDLおよびHDLの代謝に大きな影響を与え、異なる組織においてこれらの粒子によって運ばれる脂質の分布に影響を与え、後述する。
アポEの部位112および158におけるシステイン対アルギニンの異なる存在は、脂質および受容体の結合に影響を与える。最も一般的なアイソフォームであるApoE3は、それぞれ112および158の位置にシステインおよびアルギニンを含む(表1)。ApoE2はこれらの位置に2つのシステインを持ち、apoE4はこれらの位置に2つのアルギニンを持つ。高親和性結合のためには、アポEはリン脂質またはリポタンパク質に結合しなければならない。アポE4は、アポE3やアポE2よりも脂質結合親和性が高く、アポEの機能に大きな影響を与える。脂質を含まないapoEはLDL受容体に高い親和性で結合しない。アポEのグリコシル化およびシアル化は、HDLへのアポEの結合に影響を与える(Marmillot et al 1999)。脳脊髄液中では、apoEは血漿と比較してシアル化が激しい(Hu er al)。 シアル化はC末端にあり、アイソフォームによって異なるようである(Flowers et al 2020)が、脳内のアポE脂質結合および機能に対するシアル化のアイソフォーム特異的な効果に対処するためには、より多くの研究が必要である。
apoE4 の脂質結合特性を説明する 2 つの重要な特性は、ドメイン相互作用と、apoE2 や apoE3 と比較して安定性が低下していることである (Dong and Weisgraber, 1996; Morrow et al 2000)。ドメイン相互作用」という用語は、アポE4のR61と酸性のGlu255との間の相互作用を指し、これは位置112で正に荷電したアルギニンによって媒介される。これは、apoE3とapoE2が小さいHDLを好むのに対し、apoE4が大きいVLDLに優先的に結合することを一部説明している(Weisgraber, 1990)。この結合特性により、脂質粒子あたりのアポE分子の密度は、アポE3およびアポE2よりも高くなる(Gong et al 2002)。脂質粒子あたりのアポE分子の密度が高いことは、LDL受容体に対するアポE4の親和性を高める。アポE分子あたり、アポE3およびアポE4は同様に高い親和性でLDL受容体に結合するが、アポE2の結合は100倍低い(Weisgraber et al 1982)。マウスapoEは、apoE4と同様に、R112およびGlu255の等価物を含むが、重要なR61の等価物を欠いている(それはT61を含む)。ドメイン相互作用に対するT61の重要性は、マウスにおいて、標的突然変異誘発およびT61のR61への置換によって示された(DongおよびWeisgraber, 1996; Raffai et al 2001)。遺伝子組換えされたT61からR61アポEは、HDLに対する野生型の結合選好性を失い、VLDLに対する親和性を高めた(Raffai et al 2001)。さらに、R61マウスは、空間記憶障害とともに、C57BL/6よりも40%高いレベルの脳アミロイドペプチドを有していた(Adeosun et al 2019)。チンパンジーのアポEは、アポE4に似たR112およびR158を有するにもかかわらず、アポE3に似た脂質結合を予測するT61でマウスのアポEに似ている(Finch, 2010)。しかしながら、チンパンジーのアポEは、他のアミノ酸においてヒトとは異なり、例えば、ヒト系統において正の選択性を示した8つの残基のうち4つが脂質結合C末端領域内にある(Vamathevan et al 2008)。
ApoEアイソフォームはまた、そのN末端ドメインの構造安定性においてもかなりの違いがある:apoE4は熱および化学的変性に対する耐性が最も低く、apoE2は最も高く、そしてapoE3は中間的な耐性を持っている。
apoE4の折り畳み中間体は、β構造が増加し、流体力学的半径が増加したコアα螺旋構造を呈し、「モルテン・グロビュール」状態を促進している。この半折れ構造状態は、血漿中のより大きな脂質含有粒子および脳内のアミロイドβ沈着物へのapoE4の結合を増強する(Chetty et al 2017)。重要なことに、溶融したグロビュール状態は、単量体および脂質の乏しいapoEの凝集に有利である。エンドソームの低pHでは、アポE4は、アポE3よりも、脂質への結合親和性が増加した溶融グロビュールを形成するのに有利である(Morrow et al 2002)。ApoE凝集は、アルツハイマー病(Rawat et al 2019)などの神経変性疾患において、相互作用タンパク質の凝集、例えばアミロイドβフィブリルの播種を素因とする役割を持っている。
細胞のバイオエネルギーへのApoEリサイクルの重要性
アポEは、細胞内での分解を最小限に抑えながら、細胞内外でリサイクルする能力を持つという点で、アポリポタンパク質の中でも特異的である(Farkas et al 2003)。リポ蛋白質粒子を含むアポEが細胞内に取り込まれた後、例えば肝臓細胞では、内在化した脂質がアポEからエンドソーム後期のコンパートメントに解離され、その後、初期エンドソームを介してアポEがリサイクルされ、HDL粒子内またはHDL粒子内に再分泌される。肝細胞では、アポEのリサイクルは、より小さいHDL粒子によって刺激され、HDLへのコレステロールの流出と関連している(Heeren et al 2003)。
apoE4の特徴の一つは、そのリサイクル能力の低さであり、これはおそらく脂質結合に対するより大きな親和性に起因するものである。実際、HDLに誘導されたapoE4の細胞リサイクルは、他のapoEアイソフォームよりもはるかに弱い。この性質は、コレステロールの流出を減少させ(Heeren et al 2004年)細胞膜をコレステロールで豊かにする。初期エンドソームの低いpHは、アポEの凝集を促進し、細胞からの分泌の減少に寄与する。ApoEは、LRP1,ABCA1,ApoER2,インスリン受容体(IR)などのいくつかの表面タンパク質と複合体を形成している。エンドソームでこれらのタンパク質と共凝集するアポEの性質は、これらの細胞表面タンパク質の血漿膜レベルを低下させる(図1)。
図1 アポEリサイクルおよび凝集がグルコースおよび脂質代謝に及ぼす影響
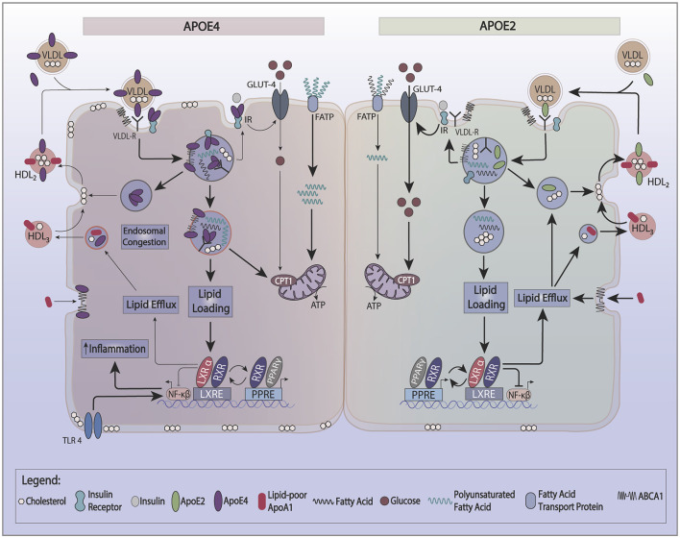
apoEリサイクルは、インスリン受容体(IR)ATP結合カセット1(ABCA1)またはリポ蛋白質受容体関連タンパク質1(LRP-1)などのいくつかの細胞表面タンパク質の発現を制御する。ABCA1によるより小さいHDL3の形成は、アポEリサイクルを刺激する。循環では、HDLとVLDLの間でアポEが交換される。
脂質負荷時には、apoE、ABCA1,およびABCG1の発現がPPAR/LXR/RXR系を介して誘導され、脂質の貯蔵または酸化およびHDLの形成が促進される。ApoE4は、IRやABCA1などの相互作用タンパク質を捕捉するエンドソーム内で凝集しやすい。
ApoE4は細胞のエネルギー選好をグルコースから多価不飽和脂肪酸に切り替え、ABCA1の活性を低下させ、細胞膜コレステロールを増加させる。細胞膜コレステロールの増加は、TLR4シグナル伝達を増強し、インフラマソームを活性化する。
ApoE4はまた、PPARγの活性化を減少させ、インスリン感受性を低下させ、ATPの源としてグルコースを利用することに貢献している。
apoEのリサイクルは、LDL受容体(LDLR; Fan et al 2011)の発現およびATP結合カセット1(ABCA1; Rawat et al 2019)の活性に依存するようである。ABCA1は、apoA-1およびapoEを脂質化し、小さな新生HDL粒子を形成するように機能する。ABCA1活性は、アポEリサイクルには必要ではないが(Braun et al 2006)、アポE分泌およびリサイクルを直接刺激する小HDL粒子(HDL3)の形成を媒介することにより、間接的にアポEリサイクルを増強することができる。
アポE4のリサイクルの減少は、その細胞エネルギー源の嗜好性に影響を与える。アポEはIRと複合体を形成し、減少したアポEリサイクルは、細胞表面から離れたエンドソーム内のIRをトラップする(Zhao et al 2017)。IR表面発現のこの減少は、ATPを生成するためのグルコースの利用の減少を引き起こし、脂肪酸の酸化を促進する。APOE2を発現する神経細胞株は、解糖の重要な酵素であるヘキソキナーゼをより多く有し、これはグルコースからのエネルギーのより効率的な生産をもたらす。一方、APOE4を発現する神経細胞株は、ヘキソキナーゼ活性が低い(Wu er al)。 また、ヒトAPOE2を発現する不死化アストロサイトは2.5倍のグルコース取り込み能力を有するが、APOE4を発現するアストロサイトはAPOE3の半分のグルコース取り込み能力を有する(Williams et al 2020)。APOE-TRマウスモデルにおける遺伝子型の効果は複雑であり、食事背景に依存する。チョウ食(5%脂肪)の下では、15ヶ月齢のAPOE4標的置換(TR)マウスの脳は、PETによる18-FDGグルコースの脳内取り込みの増加を示す(Venzi et al 2017)。fMRIにより、チャウ食の高齢APOE4-TRマウスは、ミトコンドリア酸化活動の亢進を示唆する代謝の変化とともに、内耳皮質での亢進性の増加を示す(Nuriel et al 2017a)。対照的に、高脂肪食(60%脂肪)上のAPOE4-TRマウスは、異なる表現型を示す:前頭葉におけるより低いグルコース取り込み、および海馬組織のインスリン抵抗性(Zhaoo et al 2017;Jhonson et al 2019)。高脂肪でありながら低オメガ3食に続いて、APOE4-TRマウスは、肝臓および脂肪組織の両方において、APOE2-TRマウスよりも脂肪酸結合タンパク質(FABP)および肝臓カルニチンパルミトイルトランスフェラーゼ1(CPT1)の発現が大きい血漿および脂肪組織オメガ3レベルが低いことを示す。これらの変化は、多価不飽和脂肪酸(PUFAs; Conway et al 2014)のより大きな酸化を促進する。APOE4の追加の特徴は、脂質滴の変化を含む。脂質液滴は、様々な代謝性疾患で役割を果たし、脳細胞を含む多くの細胞型に現れる動的な小器官である。脂質液滴は、アルツハイマー病などの神経変性疾患で増加する(Hamilton er al)。 APOE4アストロサイトは、E3アストロサイトと比較してより小さな脂質滴の数の増加を示し、より大きな内因性脂肪酸酸化を好み、CPT1阻害に対する感受性が高い(Farmer et al 2019)。
アポE4のリサイクルの減少もまた、細胞コレステロール代謝に影響を与える。ApoE4は、細胞表面から離れたエンドソームでABCA1をトラップする(Rawat et al 2019)。ABCA1活性の低下は、HDLへのコレステロールの流出を低下させ、細胞膜へのコレステロールの再分配をもたらす。マクロファージでは、膜コレステロールの増加は、活性化されたTLR4シグナリングと関連しており、これにより、NF-κBおよび炎症性遺伝子応答が誘導される(Westerterp et al 2013)。神経細胞の形質膜へのコレステロールのより大きな分布は、BACE1の発現およびより多くのアミロイドβアミロイドペプチドを産生するためのAPP処理を促進する(Cui et al 2011)。ミクログリアおよびアストロサイトでは、より少ないコレステロールの流出は、アミロイドβ分解を減少させる(Lee et al 2012;Rawat et al 2019)。減少したABCA1活性の別の効果は、低アポE脂質化である。脂質化不良なapoE4は脂質化されたapoE4よりも凝集しやすいので(Hubin et al 2019)脂質化不良なapoE4はエンドソームでABCA1をトラップし、ABCA1活性を低下させる。このプロセスは、apoEのリサイクルを刺激するために小HDLによってABCA1活性を増強することによって逆になる可能性がある(Rawat et al 2019)。上述したように、脂質化されたapoEは凝集しにくい。したがって、ABCA1活性を増強することは、エンドソームの外へのアポE4のリサイクルを刺激し、アポEと相互作用する膜タンパク質の細胞表面発現の機能を回復させるための治療的アプローチを提供する。これは、細胞のエネルギー嗜好に対するアポE4の効果を調節するための有望な治療標的となり得る。図2は、アポEの基本的な生物学と疾患リスクを統合したモデルを示している。
図2
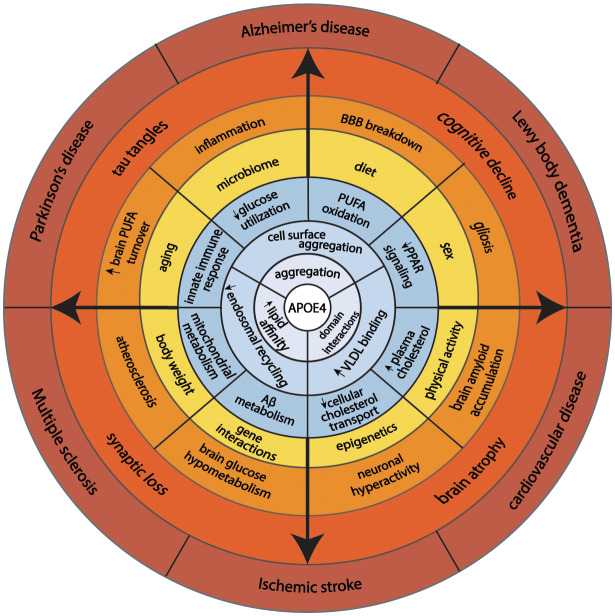
このモデルは、アポE4の基本的な構造的特性(ドメイン間の相互作用、脂質結合へのより大きな親和性、および自己凝集)が、エンドソームのうっ血、他のタンパク質との細胞表面の凝集、および循環中のより大きな脂質含有粒子との会合を促進する細胞生物学をどのように変化させるかを示している。これらの生化学的特徴は、細胞のエネルギー嗜好、コレステロール輸送、免疫応答、アミロイドβ代謝の変化と関連している。加齢、性別、食事、身体活動、遺伝学との複雑な相互作用により、APOE4キャリアは加齢に関連した疾患を発症しやすい。
PPAR-LXR-APOEシステムを介した遺伝子制御APOE発現
APOE発現の遺伝的制御は、細胞の種類によって異なり、細胞の脂質負荷と密接に関連している(Laffitte et al 2001)。ApoE、ABCA1およびABCG1タンパク質は、肝細胞、脂肪細胞およびアストロサイトを含む脂質負荷細胞において高度に誘導され、脂質交換および利用を促進する。核内受容体LXRαおよびLXRβは、脂質負荷の影響を媒介して、apoE、ABCG1,およびABCA1の発現を制御している。
apoE4発現とPPARγ活性との関係は、APOE遺伝子発現と炎症性および細胞エネルギー利用嗜好との関連の根底にあるかもしれない。LXRで観察されるように、PPARγの活性化は、ABCA1とAPOEの両方の遺伝子発現を誘導することができる(Chawla et al 2001)。逆に、PPARγはLXRαの発現を誘導することができ、それによってapoEの発現を増加させる代謝的にリンクしたサイクルを作り出すことができる。
PPARγ活性の誘導は、インスリンによるグルコース取り込みを鋭敏にし、脂肪形成を刺激し、炎症反応を減衰させる(Leonardini et al 2009)。
しかしながら、PPAR-γシグナル伝達経路は、現在のところ不明瞭なメカニズムによって、APOE4において鈍化する可能性がある(Wu et al 2018)。この複雑な関係は、PPARγシグナル伝達を増強する介入がAPOE4キャリアにおいては効果が低いことを示唆している。この概念は、以下で議論されるように、PPARγシグナル伝達経路を介して作用する薬理学的および生活様式の介入に意味を持つ。
トリグリセリドおよびコレステロール代謝に対するAPOE4の効果
APOE4キャリアは、高トリグリセリド血症と高コレステロール血症の両方を示す(Dallongeville et al 1992;Carvalho-Wells et al 2012)。対照的に、APOE2キャリアは、LDLコレステロール(LDL-C)レベルが低い一方で、一部のAPOE2キャリアは高トリグリセリド血症を示す。例えば、食後脂質血症は、APOE4キャリアで上昇している(図3;Carvalho-Wells et al 2012)。
図3 APOE対立遺伝子と食後血漿トリグリセリド値(TG)
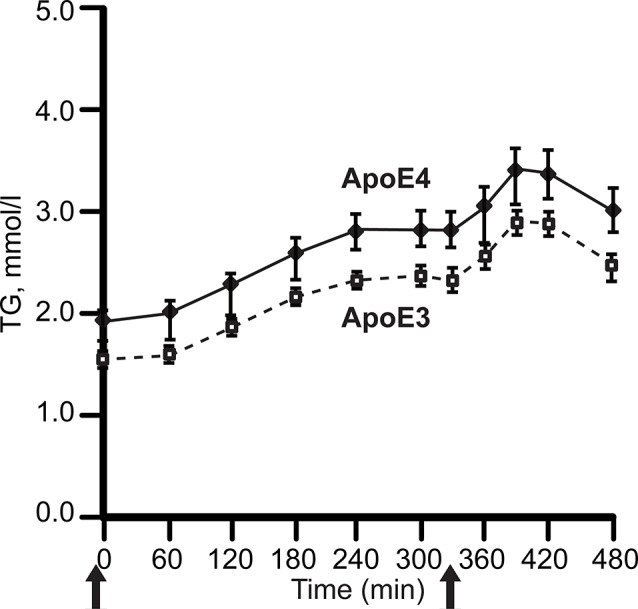
20~70歳の健康な成人(BMI19~32kg/m2,APOE3ホモ接合体、N = 142,APOE3/4ヘテロ接合体、N = 65)を対象に、2回の食事後に血漿を採取した。一晩絶食した後、被験者は、朝食(49 gの脂肪、t = 0)と昼食(29 gの脂肪、330分)実線の矢印を受けた。血漿TGのAPOE4過剰は、年齢による差はなかった。明確にするために、グラフはトリグリセリドがAPOE4に近いAPOE2キャリアを省略している。Carvalho-Wells et al 2012)より再構成・簡略化。
APOE4の高トリグリセリド血症のメカニズムは、リポ蛋白リパーゼ媒介の脂肪分解を減少させるVLDLとの結合が強くなることが関係している可能性がある(Li et al 2013)。APOE4による高コレステロール血症の主要なメカニズムは、肝細胞表面でのapoEタンパク質の隔離を介したものである。アポE2のLDLR親和性が低下すると、血漿アポEレベルが上昇する(Blanchard et al 2018)。上昇した血漿中のapoE2は、VDL上に移行し、それにより、LDLRおよびヘパラン硫酸プロテオグリカン(HSPG)を介した取り込みが、より小さなLDL粒子の隔離なしに促進される。対照的に、アポE4は、アポE2よりも肝細胞表面に限定されている(Altenburg et al 2008)。VLDL粒子上のapoE4の高いLDLR親和性は、apoE4を肝細胞表面に結合させたままにしており、これがapoE4の分解の増加および血漿中のapoE4レベルの低下を説明している。肝細胞表面上のAPOE4担体中のVLDL粒子の隔離は、それらをリパーゼにさらし、その後の残余物およびLDLへの変換を可能にする(Altenburg et al 2008)。
APOE4と脂肪細胞
ApoEは脂肪細胞で高度に発現しており、脂肪細胞の脂質フラックスを調節し、脂肪形成に対するPPAR-γアゴニストの効果を媒介している(Huang et al 2006)。内因性の脂肪細胞アポEは、細胞サイズ、トリグリセリド含有量、脂肪特異的遺伝子発現、および炎症を調節するために重要である。apoEノックアウト(-/-)マウスから分離された脂肪細胞は、野生型よりも小さく、脂肪原性遺伝子発現の低下を示し、トリグリセリドおよび脂肪酸含量が低い(Huang et al 2006)。ヒトおよびAPOE-TRマウスにおいて、APOE4対立遺伝子は、以下で議論されるように、特に肥満のAPOE4キャリアにおいて、より低いBMIと関連しているが、上昇した血漿グルコースおよびインスリンで明らかになるメタボリックシンドロームのより大きな側面と関連している(Fallaize et al 2017)。これらの変化は、PPAR-γシグナル伝達に対するAPOE4の阻害効果に起因すると考えられる(Wu et al 2018)。食事とAPOE対立遺伝子の相互作用は、APOE-TRマウスについて示された(Arbones-Mainar et al 2010)。欧米型高脂肪食を12週間与えた後、APOE4-TRマウスは、APOE3-TRマウスよりも大きな耐糖能障害を発症した。抗糖尿病薬ロシグリタゾン(1.5mg/g体重)を4週間投与したところ、APOE3マウスのみ耐糖能が改善したが、APOE3およびAPOE4-TRマウスの血漿脂質プロファイルは改善した。APOE4-TRマウスの脂肪組織では、脂肪形成及び脂質形成の誘導が著しく阻害されたが、肝臓では阻害されなかった。その結果、脂質は肝臓に再分配され、著しいステアトーシスを引き起こした。さらに、APOE対立遺伝子は高脂肪食が代謝対策に及ぼす性差を示した。雄のAPOE4-TRマウスは、12週間の高脂肪食後の内臓脂肪組織蓄積およびグルコース不耐症を含む代謝障害に対して雄のAPOE3-TRマウスよりも感受性が高かったが、雌のAPOE3およびAPOE4-TRマウスは同様の代謝応答を示した(Jones er al)。
これらの観察のメカニズムは、APOE4対APOE3-TRマウスから分離された前脂肪細胞および胚性線維芽細胞におけるPPARγ活性化および脂肪細胞分化を刺激するチアゾリジンジオンの失敗に起因する可能性がある。アポEの脂肪組織発現はPPARγアゴニストによって調節されるので、アポE4遺伝子発現の増加は、脂肪形成に対するPPARγシグナル伝達効果を阻害する(Yue et al 2004)。インスリン感受性とAPOE遺伝子発現のこのような相関は、APOE4キャリアを、脂肪細胞における肝X受容体およびPPARγを介したインスリン感受性増強機構に対する抵抗性にする(Arbones-Mainar et al 2010)。これらの知見は、脂肪細胞が大きいにもかかわらず、脂肪の多いウェスタンタイプの食事を与えられたAPOE4-TRマウスがAPOE3-TRマウスに比べて体重および脂肪組織の増加が少ない理由を説明するのに役立つ(Arbones-Mainar et al 2008)。APOE4では新しい脂肪細胞を形成することができないことと、PUFA酸化に対するより大きな素因は、脂質の貯蔵と分布に影響を与える。例えば、APOE4-TRマウスは、オメガ3欠乏食のAPOE3-TRマウスと比較して、脂肪細胞ドコサヘキサエン酸(DHA)含量が40%低い(Conway et al 2014)ことから、オメガ3欠乏食に対するヒトAPOE4キャリアの脆弱性を説明することができるかもしれない。APOE4は、西洋式食事療法中の体重増加および耐糖能障害の減少によって明らかにされた減少した脂肪球インスリンシグナル伝達と関連している(Arbones-Mainar et al 2008,2016)。これらのAPOE4プロパティは、老化と食事の推奨に向けた意味合いを持っている:低オメガ3ダイエットへの脳のエネルギーと脆弱性の源として、グルコースから脂肪へのシフト。
APOE4による低体重増加とより大きなインスリン抵抗性はまた、すべてではないが、いくつかの、ヒトの研究で報告された。例えば、Atherosclerosis Risk in Communities研究(N = 15,000人、Volcik et al 2006)やスペインのアラゴン労働者健康調査(N = 4,881人、Tejedor et al 2014)では、APOEアイソフォームは、APOE4 < APOE3 < APOE2の順位で体格指数(BMI)と関連していた。後者では、APOE2/E2キャリア(n = 21)は他のアイソフォームよりもBMIが大きかったことも示された(図4)。肥満のAPOE4男性は、IRの測定値が大きかった(Elosua et al 2003)。これらの所見は、非肥満のAPOE4キャリアや他のAPOE遺伝子型を持つ個体では見られなかった。さらに、これらの所見は性特異的であった:男性のみがこれらのAPOE対立遺伝子と肥満との関連を示した。これらの研究は、APOE2はメタボリックシンドロームのリスクを減少させるが、BMIは高くないことを示しているが、APOE4はメタボリックシンドロームのリスクを増加させる一方で、これらの効果は性特異的である可能性があることを示している。
図4 APOEアイソフォーム別BMI(平均±SE)
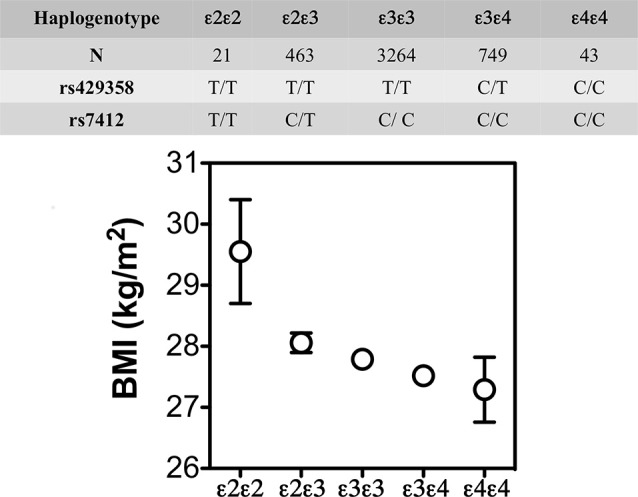
スペインのアラゴン労働者健康調査(n = 4,881)では、APOEアイソフォームはAPOE4 < APOE3 < APOE2の順でBMIと関連していた。APOE2/E2キャリア(n = 21)は、他のアイソフォームよりもBMIが高かった。Tejedor et al 2014)からの引用。
認知機能は、性別、年齢、および共遺伝遺伝子変異によって異なる肥満とAPOE遺伝子型の複雑な相互作用によって影響を受ける(表2)。中年期の肥満は、APOE4キャリアにおける後期発症アルツハイマー病のリスクの増加と関連していた(Ghebranious et al 2011)。また、Framingham Heart Studyの縦断的コホートでは、40~79歳の間のウエストとヒップの比率の増加は、執行機能の障害と白質高次脳機能の増加と関連していた(平均年齢61±9歳;Zade et al 2013)。これらの所見は、人生の後半になると異なる。1993年から 2012年までの3年間隔で面接を行った4,055人の縦断的集団ベースのサンプルでは、高齢のAPOE4キャリアの肥満は、より遅い認知機能の低下と関連していた(Rajan et al 2014)。スウェーデンのProspective Population Study of Women(PPSW)では、晩年の体重減少に伴う認知機能低下のリスクの増加が示された。1908年から 1930年の間に生まれ、ベースラインで38歳から60歳の女性1462人を対象としたこの系統的サンプルでは、BMI、APOE4対立遺伝子の状態との関連で認知症の発症率が数十年後に調べられた。後に体重減少を経験したAPOE4を持つ女性は、認知症のリスクが高かった(Backman et al 2015)。これらの知見をまとめると、肥満は高齢のAPOE4キャリアでは認知機能の低下に対して保護される可能性があるが、中年期には保護されないことが示唆される。我々は、認知アウトカムにおける血管リスクに対するAPOE4と体重との間の年齢特異的な複雑な相互作用を示唆している。APOE4を有する若年の肥満者は、代謝性および血管性疾患のリスクが増加し、後年の認知機能に悪影響を及ぼすことが示唆された。対照的に、高齢のAPOE4キャリアの肥満は、逆効果で脳のエネルギー燃料として脂肪酸を提供する可能性がある。
表2 加齢、肥満、APOE4と認知転帰との相互作用
| 著者 | 設計 | 年齢 | ApoE4効果 |
|---|---|---|---|
| Ghebranious etal。(2011) | 断面(302コントロール、APOE4 18%および150 ADケース、APOE4 60%) | 50歳でのBMI。評価の年齢は、症例で87歳、対照で78歳でした。 | 50歳での肥満は、APOE4保因者のADリスクの増加と関連していた |
| Zade etal。(2013) | 横断的(一般人口、n = 1,969、21%APOE4キャリア) | 40〜79歳、平均年齢61歳 | ウエストヒップ比が大きいAPOE4は、実行機能と白質の高信号の測定値が低いことに関連していました |
| Rajan etal。(2014) | 縦方向(n = 4,055)、APOE4 34%。19年間3年間隔でインタビュー | 65歳以上 | 肥満とAPOE4はより遅い認知機能低下を示しました |
| バックマンら。(2015) | 縦方向N = 559; 37年間のBMIの軌跡 | 37歳以上 | APOE4は、BMIの急激な低下とAD発生率の増加に関連していました |
APOE遺伝子型と性別
いくつかの研究では、脳における性-APOE相互作用を示している。例えば、アルツハイマー病脳では、APOE4対立遺伝子は、小血管疾患のマーカーである脳微小出血に対して男性の過剰を示し、これはプラークやタングルの女性の過剰とは反対である(Finch and Shams, 2016)。APOE4関連アルツハイマー病リスクの性差は、若い年齢で現れる。例えば、約58,000人の参加者のデータを持つGlobal Alzheimer’s Association Interactive Networkの研究の分析では、APOE ε3/ε4遺伝子型を持つ男性と女性は、55歳から85歳までの間にアルツハイマー病を発症するオッズがほぼ同じであった。しかし、65歳から75歳までのサブグループでは、男性よりも女性の方がアルツハイマー病発症リスクが高かった(Neu et al 2017)。
APOE遺伝子型と免疫系
マクロファージのアポE産生はその炎症性を調節する(Baitsch et al 2011)。アポEの発現は、マクロファージの表現型をプロ炎症性から抗炎症性の表現型に変換する。アポE受容体を発現するマクロファージをアポEに曝露すると、いくつかのマーカー(すなわち、Arg-1,Fizz1/Relm、SOCS3,IL-1RA)の発現および/または解放につながった。第二に、apoEに曝露されたマクロファージの機能的特徴は、遊走の減少、活性酸素の生成および細胞毒性の減衰、ならびにアップレギュレーションされた貪食活性を含んでいた(Baitsch et al 2011)。脳では、脂質化されたapoEのミクログリアのLRP1受容体への結合は、神経炎症を抑制する(Brifault et al 2017)。しかし、APOE遺伝子型に基づく炎症反応の違いを支持する証拠がある。
ユニークな研究では、APOE対立遺伝子と炎症性応答との関連性について、正常患者と臨床患者およびTRマウスを比較した(Gale et al 2014)。ヒトでは、APOE4は、生体内試験およびex vivoアッセイを用いて、LPS(エンドトキシン)に対する血清インターロイキン(IL)-1β、IL-6,IL-8,IL-10,IL-17,および腫瘍壊死因子-α(TNF-α)応答を増加させた。重度の敗血症を有するAPOE4キャリアでは、血小板減少症が多かった。これに対応して、APOE4-TRマウスではIL-6とTNF-α(唯一のサイトカイン)の反応が高かった。ヒトapoE3またはapoE4を等量生産するように安定的にトランスフェクトしたマウス単球-マクロファージ細胞株では、apoE4-マクロファージにおけるLPS刺激は、mRNAおよびタンパク質レベルにおいて、TNF-α(炎症促進)およびIL-10(抗炎症)の高濃度および低濃度を示した。さらに、apoE4 マ クロファージは、重要な酸化還元感受性転写因子 NF-κB の活性化を亢進させていた(Jofre-Monseny er al)。 APOE4と関連したより高い炎症反応のメカニズムの1つは、上述したように、ABCA1活性の低下による細胞膜コレステロール分布の増大によるTLR4活性の増大に関連している可能性がある(Westerterp et al 2013)。
慢性炎症はAPOE4でアルツハイマー病リスクを増加させる。Framingham Heart Studyの子孫コホートのメンバー2,656人からのデータは、アルツハイマー病を含む偶発的な認知症の診断との関連で血清C反応性蛋白(CRP)の縦断的な測定値、および脳容積を検討した。CRP値が8mg/L以上と定義された慢性低悪性度炎症と結合したAPOE4は、炎症を伴わないAPOE4,および慢性炎症を伴うAPOE2およびAPOE3と比較して、アルツハイマー病のリスク増加と関連していた(Tao et al 2018)。
ヒトの先祖代々のアイソフォームとして、APOE4は病原体負荷の高い感染環境において有益である可能性がある(Trumble and Finch, 2019)。
ブラジルのスラムでAPOE4を所持している子供は、下痢に対する抵抗力が高く、より良い認知能力の発達を持っている(Oriá et al 2010)一方で、ボリビアでAPOE4を所持している成人のチマネ農家・フォアジャーは、高寄生時の認知能力が高い(Trumble et al 2017)。
さらに、ガーナの農村部の感染力の高い環境では、APOE4キャリアは高齢成人および子供として生存優位性を示し、生殖優位性を示唆した(van Exel et al 2017)。また、APOE4はHCV感染の保護効果もあった(Price et al 2006)。
これらの知見は、クリプトスポリジウム・パルバム(Cryptosporidium parvum)による感染モデルにおけるAPOE-TRマウスについて示されている:APOE4-TRマウスは、腸内炎症反応および粘膜損傷についてE3よりも迅速な回復を示した(Azevedo et al 2014)。
マウスおよびヒトにおけるAPOE4とAPOE2との相対的な比較で改善された胃腸の健康は、部分的には、ラクトバチルス属の相対的な豊富さの増加を反映しているかもしれない(Parikh et al 2020)。ラクトバチルスは、クリプトスポリジウムまたは真菌感染症および腸の健康に関して改善された腸の健康と関連している(Di Cerbo et al 2016)。
APOE遺伝子型と血管系
APOE4は、上述のように欠陥VDLレムナントクリアランスからのLDL-Cレベルの上昇を介して、潜在的にアテローム性動脈硬化症のより高いレベルと関連している。これに対応して、APOE4キャリアは、虚血性心疾患のより高い発生率を示している(Xu et al 2016)。スタチンの使用の増加は、APOE4のこの有害な影響を減衰させた可能性がある(Nieminen et al 2008)。
高齢のAPOE4キャリアにおけるBBB破壊を支持する証拠がある。APOE-TRモデルでは、シクロフィリンA(CypA)-マトリックスメタロプロテアーゼ9(MMP-9)経路の活性化は、BBBタイトジャンクションおよび基底膜タンパク質の酵素分解をもたらし、BBB破壊に続いて、複数の血液由来の神経毒性タンパク質(トロンビン、フィブリンなど)の神経細胞への取り込み、赤血球由来のヘモシデリンの血管周囲への沈着、および微小血管および脳血流の減少をもたらす。APOE4-TRマウスの血管障害は、神経細胞の機能障害に先行して現れ、神経変性変化を引き起こす可能性がある。また、アストロサイトが分泌するアポE3とアポE2は、アポE4ではなく、低密度リポ蛋白質受容体関連タンパク質1(LRP1;Bell et al 2012)を介して周皮細胞のCypA-MMP-9経路を抑制することが示された。ヒトでは、死後脳組織分析は、アルツハイマー病患者におけるBBB破壊を支持し、これはAPOE3またはAPOE2と比較してAPOE4キャリアにおいてより顕著である(Zipser et al 2007)。BBB破壊のマーカーである脳脊髄液血漿アルブミン商は、高齢者(65歳以上)の認知的に正常なAPOE4キャリアでは、他の遺伝子型を持つ人と比較して大きい(Halliday et al 2013)。現在進行中の研究では、若年の認知的に正常なAPOE4キャリアにおいてBBBにおけるより微妙な血管変化が現れるかどうかが検討されている。
APOE遺伝子型と脳
老化に対する多元的効果の中でも、APOE4の最も強い効果は間違いなく脳への影響である。APOE4は晩発型アルツハイマー病の最強の遺伝的危険因子であり、それに対応してアミロイドプラークと神経原線維のもつれの蓄積が早い(Verghese et al 2013;Jansen et al 2015)。しかしながら、APOE4のリスク効果については集団が異なり、白人よりもラテン系およびアフリカ系アメリカ人の方が低い(Farrer et al 1997)。APOE対立遺伝子における集団差については、以下で議論する。
脳の発達はAPOE対立遺伝子によって直接影響を受ける。1,187人の健康な子供を対象とした小児イメージング神経認知と遺伝学研究では、APOE4キャリアは、より弱い執行機能との相関で側頭皮質が薄く、海馬がより小さくなっていた(Chang et al 2016)。この研究は、Shaw et al 2007)の初期の知見を確認したものである。大脳皮質の菲薄化はアルツハイマー病リスク因子であるため(Konishi er al 2018)APOE4のこれらの神経発達効果は認知老化の加速する軌跡を予測している。細胞レベルでは、樹状突起棘の構造も異なる。APOE4キャリアは、前頭皮質のNFTのレベルに反比例してより薄い樹状突起棘頭を有していた(Braakスコア;Boros et al 2019)。APOE4-TRマウスは、E3よりも少ない樹状突起棘体積を有する樹状突起棘頭を有する(Ji et al 2003;Sun et al 2017)。これに対応して、海馬歯状顆粒ニューロンへの成体神経幹細胞(NSC)の分化は、樹状突起の総長および複雑さがより少なかった;しかしながら、NSCの増殖は、APOE対立遺伝子によって差がなかった(Tensaouti et al 2018)。
APOE4は、高齢者の脳におけるグルコース代謝低下と関連している(Wolf et al 2013)およびアストロサイトーシスおよび微小膠原病の両方のマーカーと関連している(Fernandez et al 2019)。メイヨークリニックの研究では、高齢のAPOE4キャリアは、キャリアではない場合に比べて、アルツハイマー病に影響された脳領域でより大きなグルコースの低代謝を示している。これらの変化はPETイメージングによって検出された線維性アミロイドとは関連していないが(Knopman et al 2014年)より小さな凝集体やオリゴマーがまだ因子である可能性がある。本研究の30歳から60歳までの参加者のサブグループ(n = 62)では、APOE4キャリアと非キャリアの間に有意な局所差は認められなかった(Knopman et al 2014)。若年(中)の認知的に正常な成人におけるグルコース代謝低下に対するAPOE4の影響は、ヘテロ接合体よりもAPOE4ホモ接合体の方が顕著である(Mosconi et al 2004;Reiman et al 2004)。提案されたメカニズムには、
- アポEタンパク質発現レベルの変化
- アポEタンパク質の質的差異(例えば、凝集したアポE対脂質化したアポE)
- 核内転写に対するアポEの直接的な効果
- アミロイドβとの複雑な相互作用
が含まれる(Fernandez et al 2019)。別のメカニズムは、エンドソームのトラフィッキングに対するアポEの効果を伴う。脳内エンドソームは、特に下前頭葉の錐体ニューロンにおいて、APOE4の認知機能低下の発症の数十年前に肥大化する(Cataldo et al 2000;Nixon 2005)。APOE-TRマウスは、これらの死後所見を裏付けるものであり、APOE4対APOE3-TRマウスの脳の内葉皮質領域におけるエンドソームの肥大化およびエンドソームトラフィッキングタンパク質の増加を示す(Nuriel et al 2017b; Peng et al 2019)。
アポEは、ニューロンおよびアストロサイトのエンドソームにトラフィッキングする際に、いくつかの受容体と相互作用するので、エンドソームトラフィッキングは、アルツハイマー病の発症に関連するいくつかの経路に影響を与える。例えば、アポEは、神経細胞のIRと複合体を形成し、それを形質膜からエンドソームコンパートメントに移動させ、脳IRの表現型に寄与している(Zhao er al)。 ApoE4はシナプス受容体と複合体を形成し、細胞内コンパートメントでの隔離によってNMDAおよびAMPA受容体と同様に、ApoER2のニューロン表面発現を減少させ、グルタミン酸シナプスのReelinによる減少した増強を引き起こす(Chen et al 2010)。
アストロサイトでは、アポEはLRP1と複合体を形成する。LRP1の細胞膜へのリサイクルの減少は、アストロサイトがアミロイドβペプチドを分解する能力を減少させ(PrasadおよびRao 2018)APOE4に関連するアミロイドプラークの形成の増加のための1つのメカニズムを提供する。
我々は、APOE4がアストロサイトにおいてABCA1と複合体を形成し、後期エンドソームにおいてABCA1を捕捉することができることを示している(Rawat et al 2019)。ABCA1活性の低下は、コレステロール輸送の低下および細胞内および血漿膜コレステロール含量の増加と関連している。神経細胞膜コレステロール組成物の増加は、APP処理に影響を与え、TLR-4依存性インフラマソーム活性化を増加させる。ミクログリアにおける細胞コレステロールの増加は、アミロイドβペプチドを分解する能力を制限する(Lee et al 2012)。
まとめてみると、ABCA1,IR、LRP1,ApoER2,シナプス受容体、およびアポE4タンパク質と複合化した他のタンパク質のリサイクルの減少は、アポE4キャリアで観察される脳の老化表現型の加速の1つの説明を提供している。
APOE遺伝子型と染色体19q13遺伝子クラスター
APOE4の老化と疾患との関連については、19番染色体上のAPOEにリンクしている他の遺伝子を考慮しなければならない。APOEのすぐ隣にあるのは、ミトコンドリア輸送タンパク質をコードするTOMM40である。長さの異なるイントロニックポリTトラクトを有するTOMM40の変異体(TOMM523)は、ADと関連している(Rozess et al 2010)。隣接するTOMM40とCh19q13.3上のAPOEの遺伝子変異は、白人およびアフリカ系アメリカ人集団において、独立して認知症リスクと相加的に関連している(Yu et al 2017)。さらに、APOEおよびTOMM40の対立遺伝子は、認知処理および皮質萎縮、ミエリンの喪失、および脳微小球症を含む、臨床グレードアルツハイマー病の前に生じる脳の老化の多くの側面を修飾する(Johnson et al 2011;Lyall et al 2014)。
APOE4 rs429358多型は、若年者よりも晩年の方が高いBMIと関連しており、これは上述したように体脂肪を調節することにより、晩年特有のアルツハイマー病リスクの増加に寄与している可能性がある。この関連は、一般集団における加齢に伴うアルツハイマー病のリスクの増加と、より高いリスクまたは低体重の対象者が老年期にアルツハイマー病を発症することと一致している(Joo et al 2018)。7つの縦断的研究から 20~100歳の白人27,863人の20~100歳の白人を対象とした、年齢を集計したコホート特異的および年齢層別コホートプール解析において、ε2/ε3/ε4多型をコードするRs2075650およびRs157580 TOMM40バリアントおよびRs429358およびRs7412 APOEバリアントのBMIに対する相加的効果がある(Kulminski et al 2019)。
最近、(Kulminski et al 2019, 2020)およびWolters et al 2019)は、19q13.3の11個の遺伝子における新たなアルツハイマー病リスクバリアントをさらに記録した(表3)。 そのアルツハイマー病関連遺伝子と合わせて、19q13. 3遺伝子座には、脂質代謝および輸送(ApoC1)炎症性メディエーター(NF-κB、PVRL2)生殖ホルモン(黄体化ホルモン)および転写因子(NF-κB、ジンクフィンガー)を含む、多様な機能を持つ50以上の他の遺伝子が含まれている(表3)。これらの遺伝子の多くはアルツハイマー病との関連が報告されていないが、共調節の可能性があるため、これらの遺伝子を含めた。
表 3 Chromosome19q13.13.1–13.2.
| ADアソシエーション | ||
|---|---|---|
| APOE4 / q13.31 | APOE4はapoBリポタンパク質とより関連している | Roses etal。(2010)およびKulminski etal。(2019) |
| APOC1 / q13.32 | CETPを阻害します。すべてのリポタンパク質粒子VLDL; | Kulminski etal。(2019)およびZhou etal。(2019) |
| APOEC1P / q13.32 | 偽遺伝子 | Kulminski etal。(2019) |
| APOC2 / q13.32 | トリグリセリド加水分解のためにLPリパーゼを活性化する | Kulminski etal。(2019) |
| APOC4 / q13.32 | VLDL | Kulminski etal。(2019) |
| BCAM / q13.32 | 基底細胞接着分子 | Kulminski etal。(2019) |
| BCL3 / Q13.32 | B細胞白血病タンパク質3、転写因子 | Kulminski etal。(2019) |
| CGB / q13.32 | 絨毛性ゴナドトロピン | |
| CLPTM1 / q13.32 | 口唇口蓋裂膜貫通因子1 | Kulminski etal。(2019) |
| CYP2A / q13.2 | シトクロムP450 | |
| C5aR1 / q13.3–13.4 | 補体因子5a受容体1 | |
| FOXA3 / q13.2–13.4 | フォークヘッドボックス転写因子 | |
| IGFL1–4 / q13.32 | IGFのような家族 | |
| IRF2BP1 / q13.32 | インターフェロン調節因子2結合タンパク質1、共転写因子 | |
| LHB / q13.32 | 黄体形成ホルモンベータペプチド | |
| NECTIN2 / q13.32 | ヘルペス受容体(HHV-1); またPVRLl2 | Kulminski etal。(2019)およびZhou etal。(2019) |
| NTF4 / q13.3 | ニューロトロフィン | |
| OPA3 / q13.32 | ミトコンドリア外膜 | |
| PVRL2 / q13.32 | ポリオウイルス、受容体関連タンパク質; ネクチン2 | Kulminski etal。(2019)およびZhou etal。(2019) |
| RELB / q13.32 | NFkBサブユニット、転写因子 | |
| TOMM40 / q13.32 | ミトコンドリア外膜のトランスロカーゼ40kDa | Roses etal。(2010)およびKulminski etal。(2019) |
| TGFβ1/ q13.2 | トランスフォーミング成長因子β1 | |
| ZNF / q13.2 | ジンクフィンガー転写因子、> 20 |
いくつかのCh19q13遺伝子は転写レベルで共調節されている。ApoE-TOMM40-ApoC1は、リガンド活性化転写因子であるPPARγに対して平行な応答を示し、PPARγに対するプロモーターDNA結合ドメインを有する(Subramanian et al 2017)。
リポタンパク質としての役割に加えて、apoEタンパク質が直接的な転写調節因子であるという証拠がある(Theendakara et al 2016,2017,2018)。彼らの最初の研究(Theendakara et al 2016)では、クロマチンプルダウン(ChIP)はapoEを約3,000の遺伝子と関連させ、そのうちの約半分はapoE4に限定されていたが、apoE3には限定されていなかった。アルツハイマー病NP(Ch20)COMMD6(Ch13)Mアルツハイマー病D(Ch11)SirT1(Ch10)の4つの遺伝子のプロモーターがapoE4によって転写抑制された。ApoEはSirT1プロモーター配列cagcctccgcccgccacgtgacccaggtgに結合しており、Kdは3 nMであった。
APOE4とアルツハイマー病リスクとの関連における民族差
APOE対立遺伝子の頻度は、ヨーロッパの北欧諸国から地中海諸国、例えばフィンランドおよびスウェーデン(22%)とイタリアおよびスペイン(8%;Lucotte et al 1997年;Mastana et al 1998)のAPOE4の3倍の勾配によって示されるように、地域によって大きく異なる可能性がある。スペインのバスク人はAPOE4がさらに低い(6%)。APOE4はこれらの集団においてもアルツハイマー病および心血管疾患のリスクを増加させるが、これらの国の集団ではAPOE4有病率と寿命との対応はあまりない。フィンランド81.4歳、スウェーデン82.7歳、イタリア83.7歳、スペイン83.1歳である。しかし、国の中では、APOE4のアルツハイマー病リスク因子としての強さは、亜集団によって大きく異なっていた。
民族性はAPOE4とのアルツハイマー病関連で異なり、アフリカ系アメリカ人とラテン系アメリカ人では白人よりも30~50%弱い関連である(Tang et al 1996年;Farrer et al 1997年;Rajabli et al 2018)。アルツハイマー病を有するラテン系アメリカ人では、テキサスではAPOE4の頻度が白人よりも30%低かった。38%(N = 35)対60%(N = 160;O’Bryant et al 2013)であり、カリフォルニア州(Haan et al 2003)および北部マンハッタン(Tang et al 1996)の知見と一致していた。アルツハイマー病エキスポソームにおける無数の環境因子および生活様式因子は、APOE対立遺伝子と相互作用する可能性がある(Babulal et al 2019;FinchおよびKulminski 2019)。
さらに、19.3番染色体上のAPOEに隣接する遺伝子は、APOE4と相互作用する。その最も近い隣人であるTOMM40は、上記で簡単に述べたように、民族によって異なるイントロニックポリ-Tリピート長のバリアントを有する。いくつかの集団研究では、ポリ-T長ハプロタイプによって定義されるAPOE ε4-TOMM40 ‘523ハプロタイプのアルツハイマー病リスクが異なることが示された。”短い(‘523S, 19 nt)」と「長い(“523L” > 30 nt)」であった。アルツハイマー病を有する白人ApoE3/3キャリアは、優勢に「523L」である(Roses et al 2014;Yu et al 2017)。高齢の白人とアフリカ系アメリカ人では、’523の頻度に大きな差があった。白人(N = 1,848)は、E4-‘523L(94%)がほとんどで、1%未満の’523Sを有していた;対照的に、アフリカ系アメリカ人(N = 540)は、48%の’523Sと1.1%の’523Lしか有していなかった。白人では、ApoE4と’523Lの各コピーは、対立遺伝子の用量効果で、アルツハイマー病リスクを2倍にした。アフリカ系アメリカ人では、APOE4キャリアにおける’523Lの欠失はAPOE4の影響を弱めた:E4-‘523Lを持たない者は、E4-‘523Lを持つ少数の者(1%)よりも弱いリスク効果を示した;E4+’523Lはアルツハイマー病リスクを増加させた。他の集団ではあまり知られていない。日本人のE3-‘523Sは白人に比べて頻度が低いのに対し、E4-‘523Sはアフリカ系アメリカ人に多く見られる(Nishimura et al 2017)。
アルツハイマー病リスク効果におけるAPOEの不均一性の原因は不明瞭である。主な可能性としては、集団間で異なるAPOE領域に局所的な遺伝的変異が考えられる。また、祖先と相関する無数の環境的、生活様式的、文化的要因も考慮しなければならない。Rajabli et al 2018)は、いくつかのアフリカ系アメリカ人およびプエルトリコ人集団におけるAPOE遺伝子型およびゲノムワイドアレイデータを分析した。晩発型アルツハイマー病のアフリカ系アメリカ人1,766人とプエルトリコ人220人、認知的に健康なアフリカ系アメリカ人3,730人とプエルトリコ人169人(65歳以上)]。解析の結果、APOE4対立遺伝子のリスク効果が低いことから、非遺伝的な民族的・文化的・環境的要因よりも、APOE遺伝子座近傍の先祖特異的遺伝的要因の重要性が示唆された。連鎖不平衡(LD)は、アルツハイマー病におけるε4-およびε2-をコードするSNPの役割が、この遺伝子座の他のSNPに依存していることを示した。LD構造における白人集団と非白人集団の間の差異、およびアルツハイマー病罹患者と非罹患者の間のLDの変化は、これらの集団におけるこれらの対立遺伝子に対するアルツハイマー病のリスクの違いを説明する可能性がある(Kulminski et al 2020)。
食事および生活習慣介入に対するAPOE4キャリアの反応
我々は、APOE4の老化効果を緩和するように設計された将来の食事療法および薬理学的介入の選択を知らせることができる重要な因子を同定した。一つ目は、APOE-TOMM40-APOC1遺伝子座のPPARγによる共調節である。2つ目は、APOE4キャリアの間で、人生の後半での体重減少が認知機能低下のリスクをどのように増加させるかを含む、脳のエネルギー選好性に対するAPOE4の影響に関連している。
APOE4キャリアのPPAR-LXR/RXR-APOE系を標的とした薬剤に対する耐性
APOE4キャリアにおけるPPARγ経路の誘導が鈍化するという課題は、認知およびアルツハイマー病関連の転帰に対してPPARγまたはRXRアゴニストを用いたいくつかの臨床試験で明確に示されている。ある無作為化臨床試験では、軽度から中等度のアルツハイマー病を有する511人の被験者が、プラセボ、または2,4,または8mgのロシグリタゾン(PPARγアゴニスト)を24週間投与された群に無作為に割り付けられた(Risner et al 2006)。24週目には、アルツハイマー病評価尺度-認知サブスケール(ADAS-Cog)電池およびClinician’s Interview-Based Impression of Change Plus Caregiver Inputグローバルスコアにおけるベースラインからの平均変化を評価した。どの用量のロシグリタゾンでも、これらの試験で認知を有意に変化させることはなかった。しかしながら、APOE4非キャリアでは、最高用量のロシグリタゾン8mgでADAS-Cogの結果に有意な改善が認められた(n = 323)。APOE4陽性の被験者では、改善は認められず、精神視力の低下も認められた。
TOMMORROW二次アルツハイマー病予防試験(NCT01931566)は、ピオグリタゾン(PPARγアゴニスト)が、アルツハイマー病の遺伝的リスクを有する無症候性の人の軽度認知障害(MCI)を予防するかどうかを試験した(Burns et al 2019)。無益性分析の結果、成功の確率が15%しかないと判断されたため、早期に中止された。この試験では、APOEとTOMM40遺伝子型と年齢を加重したアルゴリズムに基づいて、認知機能障害(CI)を発症するリスクのある認知機能正常者3,494人が登録された。主要エンドポイントはMCIへの進行であった。進行までの期間はピオグリタゾン群、プラセボ群ともに36ヵ月まで同じであった。認知複合バッテリースコアは両群ともに時間の経過とともに増加したが、ADCS-日常生活動作スコアは一定であった。高リスク群では60%以上の人がAPOE4を有していた。介入に対する反応に対するAPOE遺伝子型の影響を理解するための解析が進行中である。
RXR転写経路を標的とした別の臨床試験がBeat-アルツハイマー病であった。Beat-ADは、早期アルツハイマー病患者20人の参加者を対象に、ベキサロテンの単回投与量(300mg/日)の効果を検討した二重盲検、無作為化、プラセボ対照、並行群間比較試験であった(Cummings et al 2016)。主要アウトカム(脳アミロイド指数)は、治療開始1カ月後には変化しなかった。しかし、事前に計画された二次解析では、APOE4非キャリアでの脳アミロイド指数の低下が明らかになった。これらの変化は血漿アミロイドβレベルの上昇と相関し、非APOE4キャリアにおけるベキサロテンの役割を示唆した(Cummings et al 2016)。まとめると、PPARγまたはRXRアゴニストを用いた3つの試験は、MCIまたはアルツハイマー病への進行を遅らせるのに有効ではなかった。これら3つの試験のうち2つはAPOE遺伝子型効果を示唆している。APOE4はこれらの介入に対する認知およびアルツハイマー病のバイオマーカー転帰に対する反応を鈍化させた。
APOE4脳内燃料の嗜好性と食事への反応
高齢のAPOE4キャリアにおける脳内グルコース代謝の低下とPUFAのミトコンドリア酸化の増加は、脳内燃料としての食餌性脂肪の役割を示唆している。小規模なパイロット試験では、認知機能障害(CI)を有する高齢APOE4キャリアは、認知機能のための食事脂肪摂取量の増加に反応するようであった。この試験では、CIまたは正常認知(NC)を有する46名の高齢者を対象に、急性の低脂肪食(総脂肪25%)と高脂肪食(総脂肪50%)を盲検無作為に摂取させた。急性の低脂肪食の摂取は、E4キャリアにおいて認知と血漿中アルツハイマー病バイオマーカーの測定を改善したが、E4非キャリアにおいてはこれらのバイオマーカーを悪化させた(Hanson et al 2015)。これらの所見は、CI群によって駆動され、NC群によって駆動されたものではなかった。この急性脂肪介入後のLDL-Cには差がなかった。このパイロット試験からの所見は、しかしながら、より大規模な研究で再現する必要があるが、高脂肪摂取に対するAPOE遺伝子型と認知状態の両方による差動反応を強調している。APOE4キャリアはLDL-Cレベルが高く、飽和脂肪摂取はLDL-Cレベルを適度に上昇させることを考えると、これらの所見は直感的ではないかもしれない。興味深いことに、APOE4は高脂肪食から低脂肪食への切り替えが血漿コレステロール値に及ぼす影響も調節している。高脂肪食から低脂肪で低グリセミック指数の高炭水化物食に切り替えたAPOE4キャリアは、LDL-Cのより大きな減少を示した(Griffin et al 2018)。
CIを有する高齢のAPOE4キャリアもまた、ケトジェニック食からの改善に対する抵抗性を示す。2つの介入は、APOE4キャリアがケトジェニック食から恩恵を受けないことを実証した(Reger et al 2004;Henderson et al 2009)。これらの介入の1つでは(Henderson et al 2009年)軽度のアルツハイマー病を持つ152人の参加者は、血清ケトン体またはプラセボを急速に上昇させるためにAC-1202に無作為に割り付けられた。介入は、プラセボと比較してADAS-Cogスコアに中程度の差をもたらした。しかし、効果は介入に適合したAPOE4陰性被験者にのみ認められた。高齢のAPOE4キャリアの脳が燃料として利用する食事の種類を理解することは、今後の研究の優先課題となるだろう。
高齢APOE4キャリアの減量に対する認知的脆弱性
APOE4が減量に対する認知的脆弱性を増加させることを臨床試験のエビデンスが示唆している。Look AHEアルツハイマー病試験は、太りすぎまたは肥満で2型糖尿病を有する5,145人をリクルートした単盲検無作為化比較試験である。参加者は集中的生活習慣改善(ILI)または糖尿病支援・教育(DSE)介入を受けた。認知的転帰は登録後10~13年後に評価された。介入は認知アウトカムに影響を与えなかった(Espeland et al 2017;Rapp et al 2017)。サブグループ解析では、閉経の開始、APOE4,認知スコアに対する介入との間に有意な相互作用が観察された。閉経後の高齢女性は、DSE群と比較してILI群で認知スコアが悪化していた。対照的に、若年の閉経前または閉経後早期の女性は、DSE群と比較してILI群で認知スコアが良好であった。体重減少の正の効果は、APOE4非キャリアの間でのみ明らかであった(Yassine et al 2020)。これらの知見は、APOE4キャリアにおける体重減少が、重要な燃料源である脂肪細胞から貯蔵され、放出される脂肪を脳から奪う可能性があることを支持している。
APOE4キャリアにおけるオメガ3濃縮食の役割
オメガ3に対するAPOE4の効果は、いくつかのエレガントな動物およびヒトのキネティックトレーサー研究で実証されている。オメガ3欠乏食に続いて、APOE4-TRマウスの脂肪組織は、APOE3-TRマウスよりも40%少ないオメガ3を有していた。ヒトの研究はまた、APOE4キャリアは、食事性オメガ3欠乏症に対してより脆弱であり、脳のDHA供給を維持するために非キャリアよりも長期的な食事性DHAの消費を必要とする可能性があることを確認している。PETスキャンを使用して、我々は、脳DHAの取り込みが非キャリア(平均年齢35歳)と比較して若い認知的に正常なAPOE4で20%以上であったことを同定した脳DHAの配信(Yassine et al 2017b;図5)への高い血漿で補償されている脳DHAの損失を示唆している。脳は脂肪を格納するための効率的なメカニズムを持っていないので、脂肪ω-3ストアの任意の妥協は、脳の配信に影響を与えることができる。
図5 APOE4キャリアの状態によるドコサヘキサエン酸(DHA)の脳内取り込み
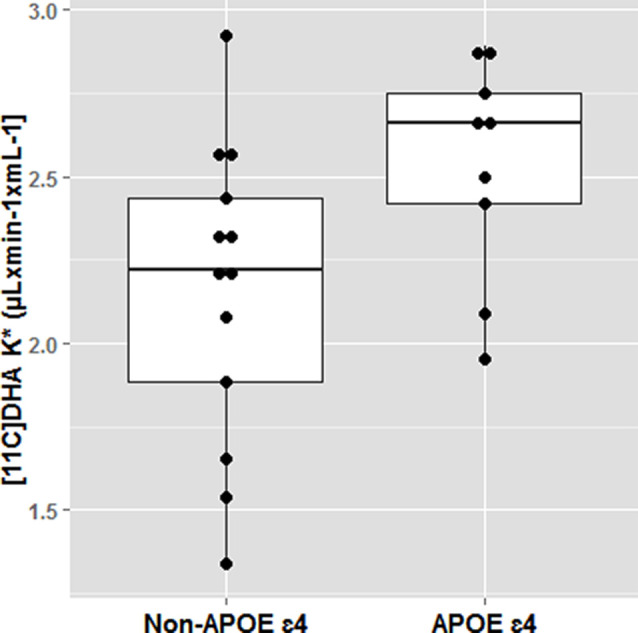
認知的に健康な若年APOE4キャリアは、11C-DHA PETスキャンを用いた脳内DHA取り込みが大きかった。*p < 0.05. Yassine et al 2017b)より引用。
いくつかのエビデンスから、APOE遺伝子型がω-3サプリメントへの反応に影響を与えることが明らかになっているが、これらの結果の一部には一貫性がない。いくつかの観察研究では、ω-3と認知転帰との関連性に対するAPOE状態の影響を明らかにしていない(Beydoun et al 2007;Krüger et al 2009;Rönnemaa et al 2012)。我々は、APOE遺伝子型とは無関係に、高齢の非認知症参加者における血清DHAレベルの低さと脳アミロイドーシスとの間の逆相関を報告した(Yassine et al 2016a)。いくつかの観察研究では、認知に対する魚介類またはω-3消費量の増加の有益性は、APOE4非障害者に限定されていた(Huang et al 2005;Barberger-Gateau et al 2007;Whalley et al 2008;Daiello 2015)特に魚介類摂取量が制限されている者(<1食/週;Huang et al 2005;Barberger-Gateau et al 2007)。ADCSがスポンサーとなったDHA試験では、認知アウトカムに対するヌル効果が報告されたが、事前に計画された分析では、APOE4非キャリアのDHA治療群における認知的ベネフィット(ADAS-cogスケールを使用)が明らかになった(Quinn et al 2010)。
他の研究では、有益性はAPOE4キャリアに限定されていた(Laitinen et al 2006;van de Rest et al 2008;Stonehouse et al 2013;Morris et al 2016)。これらの研究のうち2件では、APOE4キャリアにおける有益な反応は、若い参加者で観察された(Stonehouse et al 2013年)平均年齢=33歳、無作為化臨床試験、および(Laitinen et al 2006年)平均年齢=50歳、20年追跡の観察コホートで観察された。Rush Memory and Aging Projectの死亡した参加者を対象とした横断的研究(Morris et al 2016)では、参加者は研究開始時には認知症がなく、毎年の臨床神経学的評価と死亡時の脳解剖を受けており、平均追跡期間は8年であった。APOE4キャリアであり、週に1食以上の魚介類を摂取しているか、長鎖ω-3脂肪酸の摂取量が多かった人は、摂取量が少なかった人と比較して、死後のアルツハイマー病神経病理が少なかった。
我々は、ADCS後援のDHA臨床試験において、ベースライン脳脊髄液 DHAレベルがAPOE4キャリアではAPOE2キャリアと比較して低かったことを報告した(Yassine et al 2016b)。治療後、脳脊髄液 アミロイドβ42レベルの最下位の三分位(図6;Yassine et al 2016b)によって決定されるように、より進行した脳疾患を有する人では、より低いDHAレベルが観察された。APOE4の変化はまた、補充後のアラキドン酸(AA)に対する血漿DHAおよびエイコサペンタエン酸(EPA)比の低下した増加を含んでいた(Tomaszewski et al 2020)。これらの知見は、13ヶ月齢のAPOE-TRマウスにおける前臨床研究と一致し、脳DHAレベルがAPOE4-TRマウスではAPOE2-TRマウスと比較して低かった(Vandal et al 2014)。したがって、我々は、APOE4キャリアにおけるω-3補充に対する応答が、補充が神経変性の発症に先行するかどうかに依存するような、APOE4ステータスと疾患ステージとの間の複雑な相互作用を提案した(Yassine et al 2017a)そして、高用量の補充と長期の介入を必要とする。
図6 ADCSがスポンサーとなったDHA臨床試験における介入群別の脳脊髄液 DHAレベルの差
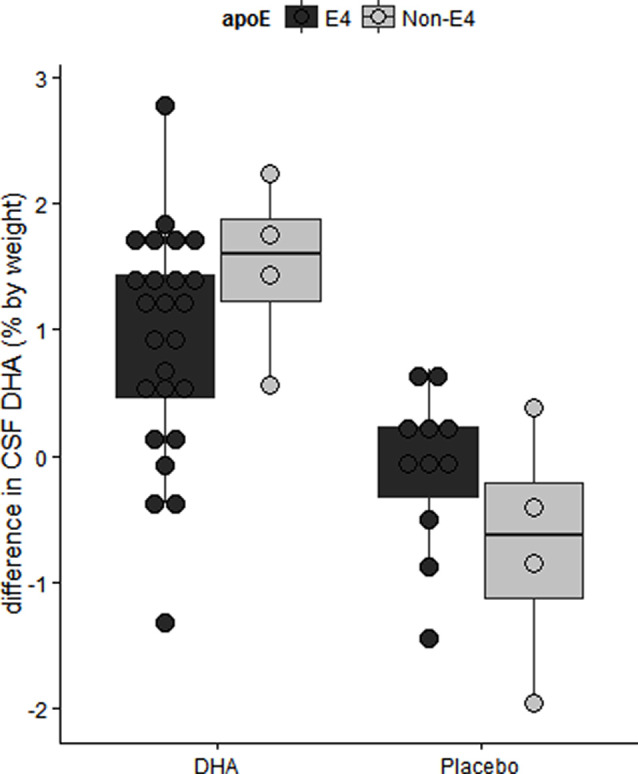
軽度アルツハイマー病の高齢APOE4キャリアでは、18ヵ月間のDHA補給後の脳脊髄液 DHAレベルが低かった。Yassine et al 2016b)より引用。
アルツハイマー病予防のために最もよく研究されている食事療法の中に、地中海式食事療法がある。この食事は地中海諸国によって異なるが、一般的には特に野菜、多価不飽和脂肪(魚やナッツ類)オリーブオイル、適度なタンパク質の消費量が多いことが特徴である。ほとんどの研究では、体重に対する適度な効果にもかかわらず、地中海食の認知またはアルツハイマー病バイオマーカーの利点が示されている(Tsivgoulis et al 2013;Ngandu et al 2015;Pelletier et al 2015)。Finger試験では、対照因子としてAPOE遺伝子型が含まれていた。この試験では、2年間の魚の消費量増加、果物、野菜の摂取量増加と運動、脳トレーニングを組み合わせた多成分介入研究により、認知転帰の中程度の改善が得られた(Ngandu et al 2015)。サブグループ解析では、APOE4キャリアはこの介入による複合NTB転帰の総計で2.6倍のベネフィットを示した(Solomon et al 2018)が、認知に関するAPOE遺伝子型と介入群との間の相互作用は統計的に有意ではなかった。
Multi-domain Alzheimer Prevention Trial(MAPT)は、認知刺激、身体活動、栄養、オメガ3多価不飽和脂肪酸の補給を組み合わせた介入が、アルツハイマー病リスクのある高齢者集団における認知機能の低下を遅らせることができるかどうかを評価するために設計された3年間の介入試験であった。2017年に発表された本研究の結果は、サブグループ分析により、脳アミロイド蓄積量が上昇した個人やAPOE4対立遺伝子のキャリアであった人に対する可能性のある(そして控えめな)有益性が示唆されたものの、3年間の研究期間中に認知機能の低下を有意に遅らせることを示すことはできなかった(Andrieu et al 2017)。
将来の介入をデザインする
本研究では、APOE4といくつかの遺伝的・環境的要因との複雑な相互作用を考慮し、APOE4キャリアの認知転帰を改善することを目的とした栄養学的臨床試験の新しいデザインを検討することを提案する。
- APOE4キャリアの状態による特異的なリクルートと層別化、治療法によるAPOE4相互作用の検出を可能にするのに十分なサンプルサイズ
- 大規模かつ広範な試験を実施する前に、介入の反応を予測するための脳特異的バイオマーカーの利用。例えば、図5に示されたAPOE4キャリアにおけるより大きなDHA脳取り込みを考えると(Yassine et al 2017b)PUFA濃縮食の有効性は、脳内DHA PET取り込みの変化によって導かれ得る。ケトン、グルコース、AAなどの他のPETイメージングモダリティは、特定の食事の選択を導くことができる。大規模な試験を導くために、より侵襲性の低い脳特異的な栄養バイオマーカーパネルのための緊急の必要性がある。
- APOE4の疾患リスクは複雑な相互作用によって影響を受けるため、APOE4と治療効果の両方を解決するためには、他のリスク因子(性、人種、肥満、更年期の状態、他の遺伝子変異のコイン相続)を含む試験が必要であろう。
- APOE4疾患のリスクは非常に早い年齢から始まるようである。不可逆的な神経変性変化の発症前に予防対策を行うためには、疾患の初期段階を特定するための新たな認知アウトカムが必要である。
- APOE4キャリアにおけるPPARγ応答の鈍化を考慮すると、APOE4キャリアにおけるPPARγシグナル応答を体重減少に回復させる薬物療法と運動介入を併用することを検討すべきである。
- 生体エネルギー/インスリン感受性PPARγプログラムの共発現とAPOE発現をアンカップリングする選択的PPARγシグナル伝達分子の開発は、創薬開発に役立つ可能性がある。
- アポE凝集を減少させることでアポEリサイクルを促進すると(例えば、HDL3の増加やABCA1アゴニストによる)細胞のエネルギー嗜好や脳の食事への反応に下流の利点があるかもしれない。
要約
要約すると、APOE4対立遺伝子を保有していると、人種や性別に特異的な加齢に伴う神経変性疾患、脳血管疾患、および心血管疾患のリスクが増加することが示唆された。APOE4は科学界の目を眩ませ続けており、機会と課題の両方を示している。
APOE4は加齢に伴う細胞のエネルギー嗜好に影響を与え、エネルギー源としてグルコースからPUFA脂肪酸へとシフトし、ω-3の摂取が制限されると脳の疾患感受性が高まることを示す前臨床および臨床的証拠がある。
しかし、APOE4の老化への影響は複雑であり、性別、人種、環境によって異なる。APOE4の疾患素因に対する遺伝子と環境の相互作用については、より洗練された介入が必要である。
APOE遺伝子型は炎症と複雑な関係にあり、人種や地域によって異なる。慢性炎症のマーカーを持つAPOE4キャリアは、いくつかの研究では感染症から保護されているように見えるが、他の研究では認知症のリスクが高い。
したがって、APOE4保因者の中には、環境が疾患感受性にどのように影響するかをより深く理解するためには、ターゲットを絞った個別化されたアプローチが必要である。今後数十年の間に、APOEのパーソナライズされた戦略は、APOE4関連の加齢性疾患の再分類と標的管理における我々のアプローチの指針となるであろう。
