Contents
- 要旨
- 1.はじめに
- 2.COVID-19ワクチンの開発状況
- 3.COVID-19 mRNAワクチン
- 4.COVID-19 mRNAワクチンの抗原について
- 5.COVID-19 mRNAワクチンを脂質ナノ粒子で包装する
- 6.COVID-19 mRNAワクチンの薬理とメカニズム
- 7.COVID-19 mRNAワクチンと他のワクチンプラットフォームとの比較
- 8.COVID-19ワクチンに関する今後の検討事項
- 9.COVID-19 mRNAワクチン候補と年齢別の推奨量について
- 10.COVID-19 mRNAワクチンの輸送とその特性への影響
- 11.COVID-19 mRNAワクチンの遺伝的内容はヒトゲノムに統合されるのか?
- 12.mRNAワクチンが次世代ヒトに与える影響について
- 13.COVID-19ブースタードーズ
- 14.COVID-19に関連する自己免疫疾患のリスク上昇
- 15.考察
- 16.結論
- 競合する利害関係の宣言
pubmed.ncbi.nlm.nih.gov/36867924
An insight overview on COVID-19 mRNA vaccines: Advantageous, pharmacology, mechanism of action, and prospective considerations
オンライン公開 2023年2月27日
要旨
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の世界的な流行により、この呼吸器ウイルス感染症に対する長期的な免疫を提供するために、科学者はこのパンデミックの間にいくつかの新しいワクチンプラットフォームを提示するように促されている。mRNAベースのワクチン投与に反対する多くのキャンペーンが行われたが、これらのプラットフォームは最も新しいタイプであり、COVID-19に対する防御を開発し、この呼吸器ウイルス感染症の重症化を抑えることで、世界の需要に応えることができた。
COVID-19のmRNAワクチンの投与について、接種されたmRNAがヒトゲノムに組み込まれる潜在的なリスクを懸念する社会もある。mRNAワクチンの有効性と長期的な安全性はまだ完全に解明されていないが、明らかにその適用によりCOVID-19パンデミックの死亡率と罹患率が変化している。
本研究では、COVID-19のmRNAを用いたワクチンの構造的特徴や製造技術について説明し、このパンデミックを制御した最も影響力のある要因であり、感染症や癌に対する他の種類の遺伝子ワクチンの製造を計画するための成功パターンであると述べた。
キーワード
SARS-CoV-2, ワクチン接種, 免疫, 水平遺伝子導入(HGT), mRNAベースワクチン
1.はじめに
2019年末から、新型コロナウイルス感染症(COVID-19)のパンデミックとその影響について世界的な議論が行われている[1]、[2]。2002年の重症急性呼吸器症候群コロナウイルス(SARS-CoV)、2012年の中東呼吸器症候群コロナウイルス(MERS-CoV)など、コロナウイルス科による2つの歴史的パンデミックの後、世界は別の危険なタイプのコロナウイルス、SARS-CoV-2に毒されていた[3],[4]。この原因ウイルス感染症の進化史は、これまでコロナウイルス科の系統学的研究によって明らかにされていた。今回のウイルスの塩基配列を、SARSやMERS-CoVの原因ウイルスとして知られるSARS-CoV BJ01(GenBank:.2), MERS-CoV HCoV-EMC (GenBank:.1) and RaTG13 (GenBank:.1)の類似性が高い(それぞれ75%, 55%, 96%)ことが確認されている。
SARS-CoV-2感染症は、無症状から部分的なインフルエンザ、肺炎、急性呼吸窮迫症候群(ARDS)による死亡まで、様々な臨床症状を引き起こす可能性がある。しかし、無症状のウイルスキャリアが世界的に高い有病率をもたらしているため、それらのすべてのケースを考慮する必要がある。世界保健機関(WHO)は、この流行を抑えるために、疑い例と確定例の隔離、適度な個人衛生対策、免疫力強化など、いくつかの戦略を用いた[3]。しかし、状況を俯瞰してみると、ほぼすべての国がSARS-CoV-2の致命的な攻撃に苦しんでいることがわかった[4]。
WHOホームページ(https://covid19.who.int)の日報によると、パンデミック開始から本日までの感染者数は670,000人、死亡者数は670万人を超え、感染者のシェアは欧州、死亡者のシェアは米国が最多となっている。2022年12月以降、全世界で毎週1,900人がCOVID-19に感染している。年明け以降、COVID-19の死亡率は1週間あたり12,000人となっている。この報告は、いくつかの懸念をもたらすことがある。2023年の初めから、における死亡の統計は、1週間に米国で5,900件、ヨーロッパで2,700件に増加している。
2.COVID-19ワクチンの開発状況
初期には、COVID-19の感染拡大に対する決定的な治療法は提案されていなかったが、マスクを着用して患者を社会的に隔離することで、ウイルスを制限できるかもしれないと考えられていた[5]。パンデミックのピークに達するまでの2年の間に、COVID-19の蔓延を抑制するために、WHOと疾病管理予防センター(CDC)から、すべての人(医療従事者と一般市民)を対象とした普遍的なガイドラインが発表された。マスク、フェイスシールド/バイザー、ゴーグル、手袋、ガウンなどの個人用保護具の使用は、住民に対する最初の防護線だった。COVID-19は空気中の飛沫で感染するため、換気のない閉鎖環境では、社会的距離を置いてもSARS-CoV-2の感染率が高くなる。一般に、過去の経験から、医学的対策(薬剤処方やワクチン)がない場合、感染拡大を管理するためには、最小限のコストで社会活動に支障をきたさないマスク着用が最も有効な.方法であるとされている。サージカルマスクとN95マスクの使用は、デザインや効率は異なるものの、細菌やウイルス粒子のろ過能力が高い[6],[7].実施された研究によると、COVID-19を使用したコミュニティにおける個人の健康遵守のレベルは、人々の意思決定における動機と理由と関連していた[8]。呼吸器感染症の予防におけるフェイスマスクの使用の有効性は、正確な科学的結果とそこからの結論が不十分であるため、特にエビデンスが不十分な社会では、まだ議論の余地がある[9]。Liらによって行われた研究では、メタアナリシスを通じて、呼吸器感染症予防におけるフェイスマスクの有効性と、世界各国での適用実績が調査された。2020年8月初旬以降のMEDLINE、PubMed、Cochrane、medRxiv、bioRxiv、Web of Scienceデータベースから得られた情報約21,341件で、そのうち8件はマスク感染予防に関するゴールドスタンダード研究、78件はフェイスマスク使用の意思と実践に関する研究であった。その結果、71%の人がフェイスマスクが感染予防に適していると考え、54%の人が呼吸器感染予防のためにフェイスマスクを使用していることがわかった[9]。公共の場でのフェイスマスクの着用は、世界70カ国以上で法律として施行されている[10],[11]。多くの人が無症候性キャリアであり、高い特異性を持つ検査を行わなければ発見できない。隔離された人々は、他の人々へのウイルスの感染を大幅に防ぐことができる。しかし、COVID-19のピーク時には、住民を隔離することで高い社会的・経済的コストが発生することが判明している[12]。パンデミックの後、人々、特に脆弱なグループ(慢性的な身体疾患、精神障害、感染者やその疑いのある患者、経済的地位の低い人々、最前線の労働者)を隔離することの負の心理的影響は、多くの研究がなされている。2020年の中国で2月28日から3月11日にかけて実施されたオンライン調査では、軟禁や集中検疫がこの時期の経験者に心理的影響を与えることが示された。それに伴い、一部の製薬企業や科学研究機関は、新しい有効な抗ウイルス薬の開発に向けて協力を開始した[13],[14]。抗ウイルス剤、免疫療法は、COVID-19感染に対して適用される戦略の候補であった[14]。
抗ウイルス薬の投与は、COVID-19の初期段階で使用するのが効果的である。SARS-CoV-2の診断アッセイがpositoveとなれば、感染の拡大を防ぐために迅速な対応が必要である。また、薬物療法の方法は、国民に公平に薬剤が行き渡るかどうかに強く影響される。ワクチンによる予防接種が世界的に行われていることからもわかるように、薬の公平な分配のための世界的な取り組みが必要である[15]。免疫療法に言及すると、デキサメタゾンや抗IL-6療法に反応しない患者が多く、一部の患者では投与後も炎症強度が高いままであり、ランダム化比較試験が正式に導入された例はない。COVID-19では、多くの症例で病態生理の異質性が観察された。このように、SARS-CoV-2に対する患者の反応は複雑であり、シグナル伝達経路や免疫反応カスケードは、治癒過程において有効にも有害にもなり得る[16]。
限られた時間でパンデミックを食い止めるため、研究者はSARS-CoV-2に対する新規有効ワクチンの開発に着手し、2020年12月に初回投与が行われた。パンデミックの間、100以上のワクチン接種製品が開発され、少なくとも24製品が緊急用として認可された[17]。SARS-CoV-2に対する特異的な中和反応を誘導するために、全長スパイクmRNA(Pfizer-BioNTechおよびモデルナワクチン)、スパイクアデノウイルスベースDNA(AstraZenecaおよびJohnson & Johnson)、スパイクプロテイン(Novavax)などの異なるワクチンプラットフォームが開発された。表S1に、COVID-19パンデミックの中で開発されたワクチンの概要を示す。
現在までに、全世界で約50億人(世界人口の27%)が完全接種を受け、40億人以上が少なくとも1回の接種を受けたとされている。COVID-19ワクチンによって救われた可能性のある命の数は不明だが、世界の統計に基づくと、70万人以上の命が救われた[18]。これらのワクチンはCOVID-19のパンデミックを効果的に制御しているが、危機は解決しておらず、単に流行の新しい段階に移行しているに過ぎない[5]。
COVID-19に対するワクチンが設計・製造されて以来、多くの人々が接種したが、未だに接種していない人々も多くいる。中国では、SARS-CoV-2の再流行により、現在も隔離されている。SARS-CoV-2については比較的理解が進んでいるが、このウイルスがより病原性・強毒性の高い新型に変化することで、人間の免疫システムが脅かされることになる。ワクチン接種の必要性については、人々の免疫力は感染経路のノードであり、感染経路を大きくコントロールすることができる[19]。ワクチン接種にもかかわらず、COVID-19のパンデミックは地域の公衆衛生に脅威を与え続けており、感染者数は増加している。SARS-CoV-2のゲノム変異と免疫抑制を含む2つの要因が、COVID-19の長期的な動態に関与している。Elishaらの研究では、南アフリカとカナダを含む2つの世界地域を、ワクチン接種のレベルや健康測定に基づいてモデル化した。この研究では、COVID-19の蔓延度と人々の免疫レベル、ワクチンの効果、移植性、発生率の漸減の関係が調査された。データ分析によると、制限の漸減、ワクチン接種の奨励、慎重な計画、SARS-CoV-2の進化の確認により、パンデミックによるリスクをほぼ防ぐことができる。しかし、オミクロンの変異型であるBA.2.12.1、BA.4、BA.5は、現在世界中で流行している心配な変異型である。ブースターワクチン(3回目、4回目)の接種スケジュールにより、COVID-19の予防は、免疫状態の持続期間は数ヶ月だが、よりコントロールしやすくなった。また、COVID-19に対する免疫を誘導するために、ハイブリッド免疫と呼ばれるワクチン接種(COVID-19に感染する前または感染した後)が応用されている。オミクロンBA.1急増時のケベック州の医療従事者を対象とした最近の研究では、感染歴のない人にmRNAベースのワクチンを3回分(BA.2.12.1、BA.4、BA.5)含むブースターワクチンを使用すると46%免疫力が向上したことが示された。また、BA.1亜種に感染した人は、BA.2亜種への再感染リスクを72%低減し、その免疫レベルはオミクロン以前のSARS-CoV-2株と比較して38%高かった。3回接種(BA.2.12.1、BA.4、BA.5)のワクチンとBA.1 variantによる過去の免疫の組み合わせにより、5カ月間95%まで免疫力を高めることができた[20]。
3.COVID-19 mRNAワクチン
3.1. mRNAワクチン
1990年、マウスの骨格筋細胞にmRNA分子を発現させ、センテス化するというブレイクスルー試みが行われた。それ以来、mRNAの生産と関連技術に関する研究は急速に発展してきた。しかし、初期の実験では、mRNAの不安定性、低い免疫力、生体内への投与など、いくつかの制約があった。今日まで、mRNAワクチンは、様々な疾患、特にインフルエンザウイルスH7N9、ジカウイルス、エボラウイルス、デングウイルス、呼吸同期ウイルス、サイトメガロウイルス、狂犬病ウイルス、およびフラビウイルスによるウイルス感染に対する防御について広く研究されてきた[21]。SARS-CoV-2のmRNAワクチンの開発は、その遺伝子情報をモデルナ社に公開してからわずか42日後という前代未聞のスピードで始まった。ワクチン製造の取り組みとその検討の間隔が短かったにもかかわらず、第III相臨床試験でほぼ90%の効率が達成された(図S1)[22]。Pfizer-BioNTech社のCOVID-19ワクチンは、FDA(米国食品医薬品局)の緊急使用許可を得て、一次予防のための2回接種ワクチンとして緊急使用許可(EUA)を取得した最初のmRNAワクチンである。COVID-19のmRNAワクチンの投与に反対するキャンペーンが数多く展開されたものの、COVID-19に対する新規ワクチンを製造することで、すでに世界的な需要に応えていると考えられている。Pfizer-BioNTech(BNT162b2)とモデルナ(mRNA-1273)の両ワクチンは、ヒトへの使用が広く承認されており、これらのレジメンの投与は2020年12月から開始されている[23]。他のmRNAベースのワクチン候補に関する情報は非常に限られているが、このプラットフォームに関する研究は進行中である。承認されたCOVID-19 mRNAワクチンと関連する臨床試験を表1に示す。
表1 COVID-19 mRNAワクチンの一覧
| COVID-19 mRNAワクチン | ターゲット | mRNAの投与量(μg) | レフ。 |
|---|---|---|---|
| mRNA-1273 | エスツーピー | 100 | [23] |
| CoV3 | S | 1 | [23] |
| Ptx-COVID-19-B | N.A | 16-100 | [23] |
| HDT-301 | S | 1-25 | [23] |
| BNT1626b2 | エスツーピー | 30 | [24] |
| BNT162b1 | アールビーディー | 1-100 | |
| BNT162a1 | アールビーディー | – | |
| BNT162c2 | エスツーピー | – | |
| CVnCoV | エスツーピー | 12 | [25] |
| ARCoV | アールビーディー | 15 | [26] |
| ARCT-021 | S | 5&7.5 | [27] |
| LNP-nCoVsaRNA-02 | エスツーピー | 0.1-10 | [23] |
| チュラコヴ19 | S | 1-25 | [27] |
| DS5670a | N.A | 10-100 | [23] |
| MRT5500 | エスツーピー | 15-135 | [23] |
| EXG-5003 | アールビーディー | – | [23] |
3.2.mRNAワクチンの優位性
COVID-19の免疫原を標的としたワクチン製造のアプローチとして、タンパク質ベースと遺伝子ベースの2つの主要なアプローチがあった。タンパク質ベースのアプローチでは、天然または組換え免疫原の直接投与により適応免疫応答が活性化され、遺伝子ベースのアプローチは、宿主細胞へのDNAまたはRNA分子の送達に基づいている[28]。mRNAワクチンは、他の利用可能なプラットフォームと比較して、簡単かつ高速に製造でき、細胞への送達が比較的可能であるなど、いくつかの利点がある[29]。mRNAワクチン接種の目的は、生体内試験での転写による標的免疫原の生産である。標的免疫原のコード配列を特定することで、mRNAワクチンの試験管内試験合成と製剤化は、現在進行中のプラットフォームに関する小さな変更を必要とするだけだ。
主に抗体産生を活性化する従来のタンパク質ワクチンと比較して、mRNAワクチンは体液性免疫応答と細胞性免疫応答の両方を刺激する[30]。mRNAワクチンの適用には、組換え技術に比べ、他のリスクはない[31]。DNAワクチンと比較して、mRNAワクチンは細胞の細胞質領域に送達されるだけであるため、ゲノム統合のリスクがない[31],[32]。DNAワクチンが宿主ゲノムに組み込まれ、mRNAワクチンで議論されている変異を引き起こす可能性があることを示す研究もある[31]。mRNAワクチンは、核膜バリアを通過する必要なく、高速の免疫原生産に直接つながるため、その発現はパッキングステップで無制限となる。細菌は、組換えタンパク質ベースのワクチンを製造するためにしばしば使用されるが、mRNA分子は宿主細胞によって翻訳される必要があるため、ウイルス感染後に起こるのと同様に、その場で製造されたタンパク質に翻訳後変化が起こる[33].
3.3. mRNAワクチンの構造
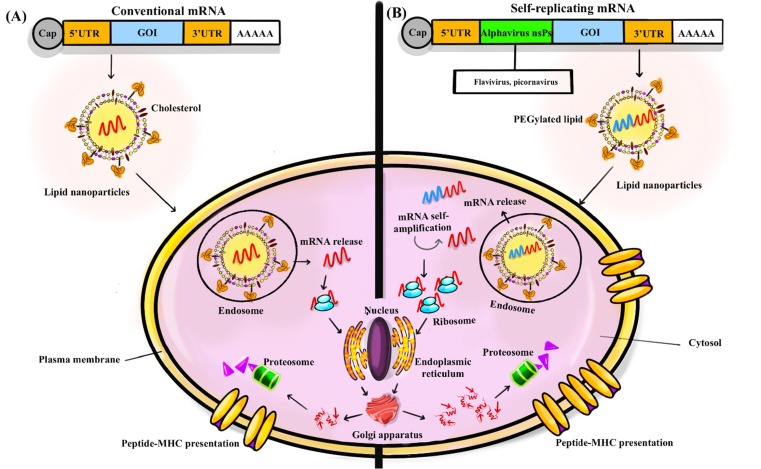
典型的なmRNAワクチンは、標的抗原をコードする配列と調節領域のみから構成されている。従来のmRNAワクチンは比較的小さいため、生体内での安定性や活性が制限される。細胞内のタンパク質機械による外部mRNA分子の発現時間が限られているため、ワクチンの処方とRNA構造要素の改変によって、標的抗原の発現と提示を最適化することができる。mRNA 分子の安定性、リボソームへのアクセス、および翻訳機との相互作用のために、5′キャップ UTR および 3′ ポリ A テールを使用することが一般的に適用される戦略である(図 1)[28].UTRは、mRNAをコードする領域の安定性と翻訳速度に影響を与える。また、ポリAテールはmRNAの安定性を高め、その短縮や欠失はmRNAの構造を破壊する。5′キャップは、翻訳の開始とタンパク質の生産速度に関与している。
図1 目的遺伝子(GOI)、UTR5、UTR3のターゲットコード配列
(A)これらの配列は、従来のmRNA構造配列の末端キャップ構造とポリ(A)テールを含んでいる。mRNAが細胞内に入り、エンドソームから放出されると、翻訳プロセスが始まる。自己増幅型mRNA配列の構造では、アルファウイルスなどの正一本鎖RNAウイルスのゲノムがよく利用される。細胞内RNAの増幅にはウイルスの非構造タンパク質(nsP)が必要であるため、標的抗原を高発現させるためにnsPを挿入したワクチンである。(B)自己増幅型mRNAにより、RNA中間体や抗原をコードしたサブゲノムmRNAのコピーを多数生成することで、高いレベルのコード化抗原を生成することができる。自己増幅型mRNAは、その自己増幅を制御してRNA中間体や抗原をコードするサブゲノムmRNAの多くのコピーを生成することができ、その結果、コード化された抗原の量を多くすることができる。リポソームナノ粒子の使用は、従来のmRNAワクチンや自己増幅型mRNAワクチンにおける細胞内への取り込みのための最も一般的な送達方法である。通常、mRNAキャリアはエンドサイトーシスにより細胞質に入り、その後翻訳とタンパク質プロセッシングが行われ、主要組織適合複合体(MHC)クレフトにターゲットペプチドが提供される。
さらに、グアニン-シトシン含量が高いmRNAは安定性が高く、in silicoワクチン設計の段階で、コドンの最適化など他の戦略と組み合わせることで、ワクチンの発現率を高めることができる[34]。使用頻度の高いコーディング配列」を選択することで、機能的半減期が長く、翻訳速度が向上する二次構造を作成することができる。例えば、mRNAの配列にウリジンの代わりにN1-Methylpseudouridine(m1Ψ)を使用すると、タンパク質の発現が増加する。最近、これらの修飾ウリジンが検討され、m1Ψの適用により、Pfizer-BioNTechおよびモデルナ mRNAワクチンの安定性と融点が効果的に増加した[34]。
自己増幅型mRNAワクチンは、フラビウイルス、ピコルナウイルス、アルファウイルスなどの一本鎖およびポジティブセンスRNAウイルスの複製特性に基づいて設計された。これらのmRNAを設計・製造する目的は、発現速度の向上とコード化された抗原の免疫原性の向上であった。シンドビスウイルス、ベネズエラウマ脳炎ウイルス、セムリキ森林ウイルスなどのアルファウイルスのゲノムは、自己増幅型mRNAワクチンの製造に望ましいモデルだった[28]。mRNAワクチンを効率的に宿主細胞に導入することは、これらのワクチンの有効性を左右する重要なパラメータである。そのため、mRNAワクチンは、RNAコンジュゲート、ベクターベースのmRNAワクチン、マイクロパーティクルやナノパーティクル埋め込み型など、さまざまなプラットフォームで設計されている[35]。
4.COVID-19 mRNAワクチンの抗原について
コロナウイルスは、エンベロープ型の非分節型一本鎖RNAウイルスで、26-32kbpとRNAウイルスの中で最も長いゲノム長を持っている。直径は60-140nmで、球形をしている。SARS-CoV-1やMERS-CoVと同様に、その外表面は長さ9〜12nmの明確なトゲで覆われており、ウイルスに雄鶏のような構造を与えている[36]。コロナウイルスは、エンベロープ(E)、スパイク(S)、ヌクレオカプシド(N)、膜(M)タンパク質などの構造抗原性タンパク質と、非構造タンパク質をコードしている。S、E、Mタンパク質を含むウイルス表面抗原は、抗体がアクセスできる。ウイルスRNAは、Nタンパク質に囲まれている。ゲノムRNAは、非コード5′-UTR領域、レプリカーゼをコードする遺伝子、アクセサリーおよび構造タンパク質(N、S、E、M)、および非コード3′-UTRからなる。RNAの5′末端にある最大のorf(orf1a/b)には、レプリカーゼと同様に約15種類の非構造タンパク質(nsp1-10、nsp12-16)とpp1a、pp1abを含む2種類のペプチドがコードされている。パパイン様プロテアーゼ(PL2proまたはnsp3)と3C様プロテアーゼ(3CLproまたはnsp5)を含む2つのシステインプロテアーゼがウイルスゲノムにコードされており、ウイルスポリペプチドを切断する。また、約8種類のサブゲノムRNA由来のタンパク質(3a、3b、6,7a、7b、8b、9b、orf14)もゲノム構造によってコードされている[37](図S2 )。
SARS-CoV-2は、シグナルペプチド、細胞外、膜貫通、細胞内ドメイン(アミノ酸1-14,14-1211,1214-1234,1234-1273)からなる1273アミノ酸のS糖タンパク質を通じて宿主細胞に結合する[38]。Sタンパク質は2つの機能的なサブユニット(S1およびS2)を持つ。S1サブユニットのC末端は受容体結合ドメイン(RBD)であり、ヒトのアンジオテンシン変換酵素2(hACE2)に結合し、S2サブユニットは膜融合を媒介する[39]。S1フラグメントのN末端ドメイン(NTD)、RBD、C末端ドメイン1(CTD1)、CTD2の4つのドメインが、S2フラグメントを下から包み込むように配置されている。S2サブユニットは左右対称の3量体であり、その第1ヘプタッドはウイルス膜に向かって折れ曲がっている。SARS-CoV-2のゲノムは、(1)RBDに複数の変異がある、(2)S1/S2サブユニットの境界に、SARS-CoVで見られた単一のアルギニンではなく多塩基性(フーリン様)切断部位(RRAR/S)がある、(3)プロテアーゼ部位に隣接して予測される3つのO結合型糖鎖が付加されているという特徴を有し、他のファミリーメンバーと異なる特徴を持っている[40],[41].RBDは、外側のサブドメインに位置し、ジスルフィド結合で固定された柔軟なリングで特徴づけられるhACE2検出部分と、5本の反平行βプレート鎖を持つ保存されたコアサブドメインの2つの構造要素を持つ[42].S-2PおよびRBDタンパク質はいずれも、非常に強力な中和抗体および細胞性免疫応答を誘導する効果が高い[43]。したがって、これらはCOVID-19 mRNAワクチンの開発において抗原として広く選択されている[27]。Pfizer-BioNTech mRNAワクチン(BNT162b1/BNT162b2)は、脂質ナノ粒子製剤を使用して、それに応じて設計された。BNT162b1は分泌型RBD抗原をコードし、T4フィブリチン(フォールドン)ドメインの追加による多価発現で免疫原性を高めるために三量化され、BNT162b2はS-2P全長タンパク質をコードする[27].
5.COVID-19 mRNAワクチンを脂質ナノ粒子で包装する
細胞外へのmRNA送達と樹状細胞ターゲットは、ポリマー、脂質、カチオン性分子、ナノ粒子などのドラッグデリバリーシステムにmRNAをカプセル化することで達成できる[31]。RNAを内包した脂質ナノ粒子(LNP)は、主に遺伝子治療や免疫学的刺激のためのRNA分子の移動に使用された。LNPsと関連する製剤は、mRNAワクチンの人体への効果的な送達方法として使用されている。これらのLNPは、免疫手段の有効性を大幅に向上させる[10]。
樹状細胞やその他の専門的な抗原提示細胞は、mRNAワクチンの主な標的である。これらの細胞は、翻訳されたmRNA分子の処理と発現を通じて、特異的な免疫応答を誘導する[44]。
mRNA-1273:LNPは、mRNA分子を効果的に送達し、RNaseから保護するのに役立つ[45]。LNPは安定した脂質二重膜にmRNA分子を包み込み、エンドサイトーシスを介してmRNA分子を取り込むのに役立つ。mRNA-1273は、少なくとも、WO2017070626およびWO2018115527を含む2つの特定のカチオン性LNPを有する。また、SM-102、ポリエチレングリコール-2000-デミリストイルグリセロール(PEG2000-DMG)、コレステロール、および1-ジステアロイル-sn-グリセロ-3-ホスコリン(DSPC)がそのナノキャリア疎水性部分に使用された[33]。
BNT162b mRNAである:このワクチンの送達効率を向上させる試みがなされている(臨床試験#[46].そのナノキャリアは、イオン化可能なアミノ脂質、リン脂質、コレステロール、PEG化脂質から、50/10/38.5/1.5の比率で調製されている[46]。mRNA-1273とBNT162bの両ワクチンは、筋肉内に投与される。
5.1.LNPsの免疫原性
1,2-ジオレオイル-sn-グリセロ-3ホスファチジルエタノールアミン(DOPE)または2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)、イオン化可能アミン含有脂質などのヘルパー脂質、コレステロール、ポリエチレングリコール(PEG)はリン脂質の構成脂肪である。mRNAデリバリー製剤にこれらの脂質が存在すると、単核食細胞系(MPS)、低免疫原性、エンドソームトラッピングを回避し、細胞への取り込みを促進し、ヌクレアーゼから保護する[47]。mRNAワクチンにおけるLNPの生物物理学的特性がその性能に及ぼす影響については、まだ詳細に検討されていない[48]。多分散性指数、成分の電荷とモル比、および表面化学は、免疫系と生体内分布への影響を無視できないLNPの物理化学的特性の1つである。Kimberlyの研究では、mRNAワクチンに使用される異なる脂質化合物の免疫原性効果を生体内試験で調査した。得られた結果によると、粒子の免疫原性レベルは、そのサイズに直接関連していた。小さいサイズのLNPはマウスでの免疫原性が低いのに対し、大きいサイズのLNPは非ヒトモデルでより大きな免疫反応を引き起こした。これは、すべての粒子が注射後に免疫反応を引き起こしたためである[48]。
免疫系の刺激は、LNPの表面電荷にも影響される。抗体は、中性の脂質よりも帯電した小胞(正負)の影響下でより効果的に中和することができる[49]。カチオン性脂質を用いたmRNAワクチンの製剤化は、自然免疫系の反応を高め、mRNAワクチンの効果を上昇させる[50]。
例えば、Lonez Cらによって行われた研究では、カチオン性脂質RPR206252によって活性化されるカスケード中に、ヒトまたはネズミのマクロファージ細胞株によってIL-6、IL-1β、IFN-γ、TNF-αの生産が誘導された。NOD 3(NLRP3)およびToll様受容体2(TLR2)は、この炎症カスケード中の炎症生成における出発点である[51]。別の例では、自己増幅型mRNA(SAM)ワクチンの効力は、LNPマンノシル化を用いて高められている。Goswamiらの研究では、マンノシル化LNPは樹状細胞の吸収を増加させ、免疫系反応を増加させることにつながった[52]。以上のことから、COVID-19 mRNAワクチンの免疫原性および反応原性は、ワクチン由来のmRNAによるMDA5-IFNAR1シグナル依存性(60)、ワクチン含有LNPによるアジュバント活性(30,44,62)、および/またはワクチンコード化Sタンパク質(66) であると考えられている。ヒトと実験動物の違いやLNP成分の違いなど、まだ解決すべき課題はあるが、今後の詳細な解析により、有効性と有害事象(AE)のバランスがとれたワクチンの開発が促進されるであろう[53]。モデルナ社が製造したCOVID-19 mRNAワクチン製剤(mRNA-1273)にPEGが含まれていたため、抗PEG抗体の産生と関連する免疫応答カスケードの活性化が引き起こされた。したがって、その接種は、アレルギー反応に敏感な人々にとって注意深く行われるべきである[54]。
6.COVID-19 mRNAワクチンの薬理とメカニズム
mRNAワクチン接種の背景にある考え方は簡単だ。標的抗原を選択したら、mRNAの配列を最適に合成することができる。mRNAワクチンの試験管内試験での転写が成功すれば、生体内試験での投与が可能になる。生体内試験システムでは、mRNA ワクチンはウイルス感染を模倣し、宿主細胞のタンパク質機構を利用して mRNAを防御抗原に変換し、強固な体液性および細胞性免疫応答を誘発する[55]。mRNAの活性は、細胞質への侵入と標的タンパク質への翻訳を経て開始される[56]。設計された。mRNA は、細胞内の翻訳機を使って抗原タンパク質を合成し、最終的に翻訳後修飾を受け、プロテアソームシステムによって分解され、免疫系に提示される。
mRNAワクチンの薬物動態には、mRNAの半減期と最終産物の翻訳後修飾という2つの重要な因子が関与している。高分子量とマイナスに帯電した細胞膜とmRNA分子間の静電反発による、迅速なRNaseベースの分解と細胞膜による不活性化は、細胞質内の外来mRNAの効率に影響を与える2つの大きな要因である[57]。RNaseは細胞外mRNAワクチンを急速に標的とし、その有効性を低下させる。いくつかのmRNAデリバリー剤は、mRNAワクチンの細胞への取り込みを増加させ、同時にエンドソームから細胞質への脱出を助けるように設計された。プロテアソームは翻訳された抗原を処理し、抗原決定基(エピトープ)は小胞体に活発に運ばれ、主要組織適合性複合体(MHC)クラスI分子に発現し、CD8+細胞傷害性T細胞をトリガーする。特異的中和抗体の産生とクラススイッチングは、CD4+ヘルパーT細胞によってMHCクラスII-結合ペプチドを介して引き起こされる。小胞体では、不変鎖(Ii)が最近生産されたMHC-II分子を内因性ペプチドとの結合から保護する。MHC II-Ii複合体はゴルジ体を経由してMHC II含有小胞を含む後期エンドソームコンパートメントに輸出され、そこでIiは抗原性ペプチドと置換される。最後に、MHC II-ペプチド複合体はCD4+T細胞にさらされる[35](図2)。
図2 正電荷を持つ脂質ナノ粒子のmRNAワクチンへの応用
ナノ粒子はmRNAを包み込み、エンドサイトーシスやマイナスに帯電した細胞膜を通過する際の酵素分解から保護することができる。その後、mRNAはナノ粒子から抜け出し、細胞質内に放出される。このように、外来タンパク質は、エンドソームから細胞質に逃れてMHC IIに提示される必要がない。病原体由来や目的別の内因性タンパク質は、まずMHC I経路で表示される。プロテアソームにおいて、タンパク質はより小さなペプチドに分解され、小胞体でMHC I分子に搭載される。ペプチドとMHC Iの複合体は、細胞表面でCD8+T細胞に提示される。
ワクチン設計の進歩により、自然免疫とToll様受容体(TLR)の複雑さについての理解が深まり、様々な病原体に対する哺乳類の免疫系のパターンを認識することが可能になった[58]。
膜貫通型タンパク質であるTLRの構造は、TIRドメイン、膜貫通領域、ロイシンリッチリピート(LRR)モジュールから構成されている。TLRは、LRRモチーフで病原体関連分子パターンを認識し、TIRドメインで細胞内シグナルを発生する[59]。TLRは、その位置から2つの一般的なカテゴリーに分類される。TLR1、TLR2、TLR4、TLR5、TLR6、TLR10は細胞膜の表面にあり、TLR3、TLR7、TLR8、TLR9は細胞内小胞にある。これらのTLRは、リソソーム、小胞体、エンドソームなどに分布している[59]。mRNA分子は、TLR7/8の強力な活性化因子と考えられているためだ。mRNAワクチンは、一連の内因性アジュバントである。mRNAワクチンを設計することで、免疫系の活性を変化させることは容易である。例えば、TLR7107はRNActive®ワクチン、シュードウリジン、1-メチルシュードウリジン(化学修飾ヌクレオシド)により活性化され、IFNタイプIの生産を低下させることができる。COVID-19に対するワクチンの設計については、ウイルスの連続的な変化を考慮し、より効果的で安全なワクチンを設計することが重要である。アジュバントの使用は、免疫系を抗原に対してより敏感にし、免疫反応の期間と速度を増加させるのに有用である。TLRアゴニストは、COVID-19ワクチンに対する免疫応答を刺激するアジュバントとして有効である。第一世代のアジュバントと比較して、このタイプのアジュバントの利点は、樹状細胞を成熟させ、その後、より強いT細胞応答を生成するように導くことである。TLRアジュバントの候補として、Pam3CSK4、ポリ(I:C)、モノホスホリルリピッドA(MPLA)、ロシキモド(R848)、CpGオリゴヌクレオチド(ODN)が、COVID-19予防に関するワクチン研究において使用されている[59]。
7.COVID-19 mRNAワクチンと他のワクチンプラットフォームとの比較
7.1.COVID-19 mRNAワクチムの効率性
迅速な開発、高い効力、低い製造コスト、安全な投与により、新世代のmRNAワクチンへの関心が高まっている。他のプラットフォームと比較して、mRNAワクチンを使用する利点は以下の通りである:(1) mRNAは非感染性のリボ核酸配列であり、その非集積性により感染性や変異原性を持つ部分がない。また、mRNAの半減期は通常の細胞内プロセスによって制御されており、容易に分解される。構造の安定性を向上させる必要がある場合は、その配列に変更を加えることができる。(2) mRNAは、キャリア分子に配合され、細胞質への迅速な吸着・発現が可能であるため、より効果的となる。mRNAは最小限の遺伝子ベクターと考えられるため、繰り返し投与することができる。(3)試験管内試験条件下でのmRNAの転写効率が高いため、mRNAワクチンは大規模生産に適しており、全体として他のワクチンプラットフォームよりもコストが低い[60],[61],[62].
SARS-CoV-2による入院や死亡を減らすために、mRNA-1273とBNT162b2という2つのトレンドワクチンの有効性が証明された。ただし、これらのワクチンの有効性は、様々な要因によって多少異なっていることに注意してほしい。どちらのワクチンもSARS-CoV-2のスパイクプロテインをコードしており、これらのワクチンのmRNAは修飾ヌクレオシドである。ワクチンの製剤や処方量の違いが、この違いの根源となり得る。BNT162b2ワクチンの1回あたりの注射量は30μg/0.3ml(100μg/mL)で、21日間隔で投与される。そして、モデルナの免疫原性用量は、100μg/0.5ml(200μg/mL)の量を28日間隔で接種している。このように、2つのワクチンの構造や製法が似ていても、BNT162b2ワクチンの各投与量では、スパイクプロテインのmRNAコピーが1/3になり、結局、免疫反応のプライミング効果が低くなる可能性がある。この2つのワクチンで産生される抗体のレベルを比較することで、この2つのワクチンの有効性について重要な結果を得ることができる。2種類のワクチンの臨床試験のうち、関節痛と筋肉痛の2つの副作用は、BNT162b2よりもmRNA-1273の接種例で高く、これはこのワクチンの免疫原性と直接関係している。また、製剤を通じて脂質組成が異なるため、その効果に違いが生じる可能性がある。BNT162b2にはALC-0315,ALC-0159,distearolyphosphatidycholine(DSPC),コレステロールが、mRNA-1273ワクチンにはSM-102,PEG-Colster,DSPG-DMGが脂質部分として配合されている[63].
mRNAの配列を最適化することにより(コドンの変化、宿主の転移RNA(tRNA)の頻度に合わせる、あるいは二次構造の導入の決定因子として)、タンパク質合成の速度やmRNA機能の半減期を変化させることができる。mRNAの翻訳を改善するには、1mΨのヌクレオチド変化を使用することができ、これは追加の塩基対安定性を提供し、二次構造に有用な変化を引き起こす。これらの変化は、エンドヌクレアーゼの攻撃や化学的分解プロセス(加水分解)に対して mRNAを安定化させる[64],[65],[66].
BNT162b2およびmRNA-1273は、mRNAの製造過程で1mΨのヌクレオチド置換とdsRNA断片の除去を組み合わせて行い、TLRシグナルおよび細胞質RNAセンサーの活性化を抑制することにより、mRNAに反応した自然免疫シグナルを強く抑制している。モデルナ社は、このようなアプローチにより、mRNA(ワクチン)投与による局所的および全身的な自然免疫の影響をマウスで最小限に抑えることができると主張している[36]。BNT162b2やmRNA-1273とは異なり、CVnCoV ワクチン候補は、配列工学(例えば、ウリジン含有量の減少)、選択された。UTR、および dsRNA 断片を除去する厳格な精製プロトコルを用いた「未修飾」 mRNAを含む[67],[68].
7.2.COVID-19 mRNA ワクチンの免疫原性
COVID-19は約270種類のプラットフォームで市販されているが、緊急ライセンスが発行されたのは、mRNAプラットフォームのモデルナ、BNT162b2 mRNAワクチン(Pfizer/BioNTech)、Gam-COVID-Vacワクチン(Gamale Research Institute監修)、ChAdOx1 nCoV-19 (University of Oxford/AstraZeneca)、アデノウイルスのプラットフォームではJohnson&JohnsonまたはAd26.COV2.S (Janssen)を含む5種類だけ。また、NVX-CoV2372; Novavax by protein subunit or BBV152; Bharat Biotech(不活化ウイルスワクチンベース)は、一部の国で緊急用として認可されたと報告されている。アデノウイルスベクターを用いたAd5-nCoV(CanSino Biologics)やCoronaVac(Sinovac Biotech)、BBIBP-CorV(Sinopharm)、WIBP-CorVS(WIBP-CorVS)は不活化ウイルスプラットフォームに基づいて設計されており、いくつかの国で緊急使用が許可されている。ペプチドワクチンEpiVacCorona(VECTOR Center of Virology、ロシア)、不活化ワクチンCoviVac(Chumakov Center、ロシア)、組み換えワクチンZF2001(Anhui Zhifei Longcom/Ch. Science)は、公開された有効性証拠を提供せずにいくつかの国でライセンスされており、いくつかの国で緊急使用のために承認されている。[22],[69],[70]mRNA-1273とBNT162b2ワクチンは、いずれも単回投与後、Sタンパクの受容体ドメインに結合する抗体である抗受容体結合ドメイン(抗RBD)の産生を誘発する。この問題は、回復しつつあるCOVID-19陽性患者に対してmRNAワクチンを接種した人の血清について行った臨床試験で確認されている。一方、低レベルのCD8 + T応答は、1~2回の接種で出現する。これらのデータは、これらのワクチンの1回接種後の保護は、他のエフェクター機構につながる極めて低いレベルの中和抗体を必要とするか、または比較的低い頻度の抗原特異的T細胞によって媒介されることを示唆していると考えられる。収集した情報によると、アデノウイルスベクターワクチンは、免疫系を活性化する方法においてmRNAワクチンと類似しているが、相違点もある。臨床試験において、これらのワクチンの有効性は様々であった。ChAdOx-1 nCoV-19の1~2回投与、Ad26.COV2.Sワクチンの1回投与では、その有効率は約70%だった。Gam-COVID-Vacワクチンの2回目の投与で、その効率は90%と報告されている。この種のワクチンの効率差は、1回目の投与でアデノウイルス26,2回目の投与でアデノウイルス5というワクチン処方に大きく関係していると考えられる[70],[71],[72].これらのワクチン投与後の死亡率、進行性感染症、入院率を調べると、Ad26.COV2.S接種例は、mRNA1273よりも遠かった[73]。2つの異なるプラットフォームを用いたChAdOx1 nCoV-19ワクチンとBNT162b2ワクチンの両方が、80%以上の入院と重症化に対して有効であった[70],[74].両方のプラットフォーム(アデノウイルスベースとmRNAベース)で中和抗体のレベルが上昇し、感染から回復した患者よりも高い値を示した。もちろん、比較すると、中和抗体の誘導レベルはmRNAワクチンでより高かった。単回接種のChAdOx1 nCov-19ワクチンは、多機能抗体の産生に導かれ、これらの抗体に依存するいくつかの有効なメカニズムを導入したが、これらはすべて免疫原性を目的として実施された。これらのワクチンはまた、好中球と単球の貪食活性を促進し、その両方が2回目の投与で増加した[70],[75].ChAdOx1 nCov-19ワクチンの1回目の接種後、抗体依存性補体沈着機構により抗体が産生され、2回目の接種でその活性が強まった。さらに、CD4 + T細胞からのTNF-αおよびIFN-γの産生に関する研究により、ワクチンの免疫原性メカニズムが強いT細胞応答の誘導に関連していることが示された[70]。米国で人気のあるこれら3つのワクチンを比較し、臨床試験データを収集した後、この国や世界の他の地域で公正かつ合理的なワクチン接種政策を検討することが可能になるであろう[73]。
8.COVID-19ワクチンに関する今後の検討事項
国民の信頼は、ワクチンの開発と応用が成功し、影響力を持つ上で最も重要な要素の1つです[1]。世界的なウイルス疫病の発生に伴い、COVID-19とワクチン接種に関する陰謀論が形成されてきた。COVID-19とそれに対する広範なワクチン接種が、世界人口のコントロールとマイクロチップのスパイを目的としていることを告発するアプローチもあった。ワクチン接種に関するこのような理論は新しいものではなく、1990年代には、MMRワクチンと自閉症や炎症性腸疾患との関連について同様の理論が展開されていた[76],[77],[78],[79],[80],[81], [82]。
COVID-19 mRNAワクチンに関する陰謀論は、主に4つの分野に分類される。
第一に、ワクチンの運用システムとその安全性に疑問があった。実際、臨床試験が成功したことで、安全性や起こりうる副作用に関する主な疑念は消え去った。
第二に、パンデミック時のmRNAワクチンの十分な有効性に疑問があった。
第三に、COVID-19が医療当局や専門家が説明するほど危険なものなのかどうかという疑問があった!例えば、マイノリティや有色人種の不道徳な扱いの歴史を考慮すると、システムが私たちの生活水準を向上させようとしていることを受け入れることができるのかどうかという疑問があった。
ワクチンとワクチン製造の組み合わせは、世論を巻き込んだ第4の倫理的懐疑であった[83]。

COVID-19ワクチンの開発と完成は急速に拡大しているため、COVID-19ワクチンの利点は潜在的なリスクやその副作用を上回ることが期待される[84]。アデノウイルスベースのワクチンは、未知の頻度でウイルスDNAが凝集し、予測できないエピジェネティックな結果が生じるリスクがあり、それはワクチン接種の数年後に観察されるかもしれない。また、アデノウイルスDNAに存在するウイルス遺伝子が細胞間物質によって活性化され、ワクチン接種後に一過性の症状として経験される異なる免疫記憶反応につながる可能性がある。幸いなことに、重篤な免疫反応が致命的な結果をもたらすことは非常にまれである[85]。このようなワクチンを扱う際、人々は「ワクチンが自分の遺伝子に入るのか」ということを気にする。ヒトアデノウイルスが腫瘍形成に関連するという証拠はないが、この可能性を簡単に否定することはできない[86]。
pubmed.ncbi.nlm.nih.gov/34087261/
外来遺伝物質の運命に関する懸念と、ウイルスのmRNA/DNAの統合の可能性は、さらなる調査が必要なヒトへの潜在的脅威である。Zhangらは、初めてSARS-CoV-2 mRNAワクチンの最近の臨床研究を科学的に概観し、社会の心配に妥当な回答を与えた[87]。
www.biorxiv.org/content/10.1101/2020.12.12.422516v1
9.COVID-19 mRNAワクチン候補と年齢別の推奨量について
米国におけるFDAの承認によると、COVID-19のさらなる拡散を防ぐために、6カ月以上のすべての年齢(乳児)への接種が推奨されている。CDCの勧告によると、一次接種のシリーズを完了し、ブースター用量の勧告に基づいて完了する方が良いとされている[88],[89].
一価ワクチンと多価ワクチンのブースター投与は、検討すべき非常に重要な問題である。M1価ワクチンは、ウイルスの1つの株または1つの成分から調製され、2価ワクチンはウイルスの2つの株または成分の成分を含んでいる。病気に対処するために製造された1次ワクチンと、メインのブースターは、1価ワクチンとされている。2ポットは、ブースター用量として使用されたファイザーとモデルナ COVID-19ワクチンの新しい生産と、BA.4とBA.5を含むオミクロンの新しい変種は、ワクチンの生産で一緒に使用されていた。これらのワクチンは、一次生産されたワクチンよりも、オミクロン変種に対する保護と病気/死に対するより長い免疫期間を誘導した[90]。二価のmRNAワクチンのブースター投与は、一次接種のシリーズを終えたすべての人に推奨されている。しかし、6カ月から4歳の小児は、Pfizer-BioNTechの初回接種を受けた後でも、一価または二価のワクチンの使用は許可されていなかった[88]。18歳以上で、FDAが承認した1価ワクチンの接種で、ブースター接種を受けていない場合で、2価のmRNAワクチンの接種に制限がある場合(入手不可能,禁忌),ノボバックスを使用できる[88],[89].
9.1.モデルナ COVID-19 mRNAワクチン
モデルナ(2価)のブースター投与が6カ月から4歳の子どもに推奨された。最初の2回の接種間隔は4~8週間で、ブースター投与は最初のシリーズ終了後2カ月後である。モデルナ COVID-19 mRNAワクチンのブースター投与は、一次接種(2回)が行われたこれらの年齢で許可されている。5~11歳の小児では、初回接種とブースター接種(モデルナまたはPfizer-BioNTechの2価)が推奨されている[89]、[91]。12歳以上の接種例では、初回投与2回とモデルナまたはPfizer-BioNTechの多価のブースター投与1回が推奨された。初回接種の時間間隔は4~8週間、ブースター投与は初回接種から少なくとも2カ月後(ブースター投与を受けなかった人、1価のブースター投与を受けた人のいずれにおいても)[88]、[89]。
9.2.ファイザー・バイオエヌテック COVID-19 mRNAワクチン
4~6歳児では、Pfizer-BioNTechワクチンによる3回の初回接種が推奨された。最初の2回の接種の間隔は3-8週間である。これらの小児には、1価または2価のワクチンの投与は許可されていない。5-11歳の子供には、2カ月の間隔で、2価のPfizer-BioNTechの初回投与と1回のブースター投与が行われた。実際、この年齢の子どもたちは、ブースター投与を受けていないか、1価のブースター投与から少なくとも2カ月が経過している。現在、2価のPfizer-BioNTechは、Pfizer-BioNTechの初回投与を2回受けた5歳児のブースター用量として認可されている。12歳以上の症例では、モデルナまたはPfizerBioNTechの初回投与2回と多価ブースター投与1回が推奨されてきた。初回投与の時間間隔は4~8週間、ブースター投与は初回投与から少なくとも2カ月後(ブースター投与を受けなかった人、1価のブースター投与を受けた人のいずれにおいても)[88],[89],[91].各 COVID-19 mRNA ワクチンの年齢別の初回接種時およびブースター接種時の種類と用量を表 2に示す。
表2 COVID-19 mRNAワクチンと年齢別の投与量
| モデルナワクチン
|
||||||
|---|---|---|---|---|---|---|
| 一次投与量
|
ボスターズの投与量
|
|||||
| 年代 | ワクチンの種類 | 投与量 | 射出量 | ワクチンの種類 | 投与量 | 植え付け量 |
| 6カ月~5歳 | 一価 | 25 µg | 0.25ml | 二価 | 10 µg | 0.2 µg |
| 6歳~11歳 | 一価 | 50 µg | 0.5ml | 二価 | 25 µg | 0.25 µg |
| ≥12歳 | 一価 | 100 µg | 0.5ml | 二価 | 50 µg | 0.5 µg |
| ファイザー・バイオエヌテック社製ワクチン | ||||||
| 6カ月~4歳 (1・2回目) |
一価 | 3 µg | 0.2 | – | – | – |
| 6カ月~4歳 (3回目投与) |
二価 | 3 µg | 0.2 | – | – | – |
| 5歳~11歳 | 一価 | 10 µg | 0.3 | 二価 | 10 | 0.2 |
| ≥12歳 | 一価 | 30 µg | 二価 | 30 | 0.3 | |
10.COVID-19 mRNAワクチンの輸送とその特性への影響
パンデミック予防のためのCOVID-19 mRNAワクチンの設計と製造が劇的に実証されて以来、しかし、この種のワクチンの維持とエンドユーザーへの配送を取り巻く課題がある[92]。mRNAのリボース糖の2位にヒドロキシル基が存在するため、環境条件下では生物学的ヌクレアーゼに対してワクチンがより敏感になる。mRNAのホスホジエステル結合は、分子内トランスエステル化反応により切断される。この問題の解決策として提案されているのが、ワクチンの凍結、凍結乾燥、または凍結乾燥で、mRNAを安定化させるものである。凍結乾燥したmRNAワクチン製剤にテレハロースなどの低温保護剤を添加すると、4℃で10カ月まで安定性が向上した。しかし、この方法はリポソームやLNPに製剤化されたmRNAワクチンには適用することができない。なぜなら、これらのナノ粒子は凍結融解プロセスに敏感で、自然な状態を失ってしまうからだ。Pfizer-BioNTechが製造したCOVID-19 mRNAワクチンは、液体状態で-80℃でも安定である。フリーズチェーン設備のない地域でこれらのワクチンを保管することは、その国へのCOVID-19 mRNAワクチンの輸入を制限することになった。一方、先進国では、これらのワクチンの保管に制限はなかった。mRNAワクチンの脂質製剤にスクロースやトレハロース(5%w/v)などの他の凍結保護剤を適用することで、ワクチンの有効性を最大3カ月間安定させることができるが、製剤に関連する今後の課題は、脂質ベースのmRNAワクチンを液体窒素で保存することで、市場配信システムにとって困難である[93]。
11.COVID-19 mRNAワクチンの遺伝的内容はヒトゲノムに統合されるのか?
ウイルスORF配列を含むワクチンは、キメラmRNAの細胞質発現により、宿主染色体への侵入の潜在的リスクがある[94]。最近開発されたmRNAベースのワクチンの利点は、送達と安定性の問題をカバーしているが、RNAの分解と免疫に関する懸念については、より詳細な研究が必要である[95]。
SARS-CoV-2感染から回復した数週間後、一部の患者は診断テストが陽性であり、複製を伴わないウイルスRNAの存在を示している。感染細胞のゲノムへのSARS-CoV-2の統合を研究するために、Zhanglらは、長期ナノポアシーケンス、イルミナペアの末端での全ゲノムシーケンス、Tn5タグ付きDNA融合濃縮シーケンスを含む3つのシーケンスアプローチを使用した。3つの方法とも、SARS-CoV-2の配列が逆転写法によって宿主細胞ゲノムに組み込まれることが証明された。このことは、初感染から回復して数ヵ月後、再感染もなく、検出可能なウイルスがない状態でSARS-CoV-2検査が陽性となる人がいることの説明になると考えられる。一方、感染者におけるゲノム統合の直接的な証拠はない[96]。
外来遺伝物質が人間のゲノムと組み合わさる可能性は、水平遺伝子伝達(HGT)を通じて説明できる。進化の過程で、人間は多くのウイルスに感染し、免疫システムがウイルスと闘っていた。しかし、ウイルスの特定のゲノム領域が人間のDNAに組み込まれている。人間のゲノムの約45%は、長鎖および短鎖間隔反復要素(LINEおよびSINE)を含む可動性要素で構成されており、これらは5~8のウイルス遺伝子配列に由来している[97]。ただし、ウイルス配列が人間の染色体に組み込まれると、遺伝子の破壊、癌原性、細胞の早期死、遺伝的ゲノム変化を通じた宿主種の進化が生じる可能性がある[98]。
昆虫のRNAウイルス感染は、宿主がコードするレトロトランスポゾンを介した逆転写酵素媒介プロセスにより、内在的事象と系統的に関連していることが示されている[99]。ウイルス感染では、水平遺伝子伝達(HGT)は通常、宿主細胞の遺伝子が攻撃しているウイルスへの転送を介して発生し、逆方向(ウイルスから宿主細胞へのHGT)はほとんど発生しない。レトロウイルスやAnelloviridae、Circoviridae、Geminiviridae、Nanoviridaeなどの一部の円形一本鎖DNAウイルスが例外である[100]。さまざまな生物の一般的なゲノムデータベースにおいて、広範な配列類似性が示されている[101]、[102]。例えば、パルチウイルスおよびトーティウイルスのRNA依存性RNAポリメラーゼおよびカプシドタンパク質をコードする遺伝子は、真核生物の核ゲノム(菌類、原生生物、節足動物、線虫、植物を含む)において、広範な相同遺伝子を持っている[103]。ゲノムシーケンシングおよびウイルスと宿主ゲノム配列間の連鎖の他の比較的証拠は、水平伝達された真核生物のゲノム内にウイルスゲノムの相同が存在することを示している[103]。ただし、血液媒介ウイルスの一部では、宿主ゲノムへのウイルス遺伝子セグメントの組み込みが必要である(Table S2)[98]。LINE-1または他の転写因子による逆転写を経て、SARS-CoV-2 RNAの一部がDNA分子に逆転写され、不明な位置および頻度でゲノムに組み込まれることがある。したがって、COVID-19 mRNAベースのワクチン接種と同様に、感染細胞へのSARS-CoV-2 RNAトランスクリプトの組み込みの可能性は無視できない[85]。
pubmed.ncbi.nlm.nih.gov/34087261/
12.mRNAワクチンが次世代ヒトに与える影響について
mRNAワクチンを使用する主な目的は高い効率を達成することだが、生命コードの操作は、完全に予測できない、長期的、あるいは永久的で不可逆的な副作用をもたらす可能性があることに注意する必要がある[104]。潜在的なリスクは、mRNAワクチンの接種後すぐに妊娠した女性における、mRNAワクチン接種の心配な状況である。リポソームに埋め込まれたmRNAは精子に入り、LINE-1によってDNAに変換される。こうしてSタンパク質のコード遺伝子を含む循環型プラスミドが作られ、やがて卵子と受精することがある。この場合、赤ちゃんはSタンパクに反応できず、免疫系がSタンパクを自己分子として認識し、長期にわたってSARS-CoV-2感染の素因となる。これは仮説に過ぎないが、このようなシナリオを簡単に否定することはできない。したがって、レトロトランスポゾン、精子、受精、免疫系、ウイルスの間の関連性を示す証拠は、あり得ないことではない[104]。
COVID-19ワクチンによる生殖器系へのダメージについてはいくつかの噂があり、この点ではPfizer-BioNTechワクチンが強く非難された[105]。SARS-CoV-2のスパイクプロテインを検出する抗体が、母体のシンシチン1タンパク質と相互作用して胎盤を損傷する可能性があると主張されている。この仮説によれば、すべてのワクチンプラットフォームと自然感染は胎盤を損傷する可能性がある。しかし、妊娠直前または妊娠初期にSARS-CoV-2に感染した女性は、感染していない同世代の女性に比べて中絶する可能性が低かった。この観察結果はこの仮説に反論するものであったが、免疫学者たちはより合理的な回答を示した。彼らは、SARS-CoV-2抗原とシンシチン-1との間に血清学的に有意な交差反応性はないことを発見した。なぜなら、回復期のCOVID-19患者の血清はシンシチン1とは反応しなかったからである[105]。
若年成人(特に学生)や小児に対する市販ワクチンの投与は、多くの国で議論が続いているテーマである。2021年8月末以降、小児へのワクチン処方について、異なる国々が同じ判断に至っていない[106]。
Walterらによる研究では、12歳未満の小児を対象としたCOVID-19の安全な接種が検討された。BNT162b2ワクチンの臨床試験フェーズ1では、6カ月から11歳の小児を対象に、21日間の間隔をおいて調査された。臨床試験フェーズ1では、10,20,30μgを16名の小児に投与した。免疫反応を調べるために、10μgの用量が使用された。研究の継続で、2268人の研究対象児童が臨床試験フェーズ2に選ばれ、そのうち1517人の児童にワクチンが、751人の児童にプラセボが投与された。これらの試験は2-3カ月間実施された。得られた結果は、ワクチン接種レジメン(10μgを21日間隔で2回投与)に規定されたワクチンの免疫原性を示していた[107]。
妊娠中や授乳中のワクチン接種に関する懸念に反して、COVID-19ワクチンの有害作用は今のところ観察されていない。妊娠中および授乳中の女性に対するワクチンの影響を調査すると、通常、母親、赤ちゃん、胎児の健康が脅かされるため、ワクチンは使用されてかなかった[108]。制限のため、授乳中および妊娠中の母親の健康と免疫に対するワクチンの影響に関するデータは限られている。結果によると、ワクチンを接種した妊婦と接種していない妊婦の流産率に差はなく、妊婦や授乳婦の集団におけるワクチンの免疫原性は一般集団と大差ないようである[109]。
ヤンセン社、ファイザー社/バイオテック社、モデルナ社の動物モデルでの試験結果を分析した結果、生殖、胚形成、胎児成長への悪影響はなかった。出生後に生まれた胎児も流産していない。ジカウイルス、インフルエンザウイルス、狂犬病ウイルスに対するmRNAワクチンの先行研究も、パンデミック前の女性の妊娠中に高い免疫原性でポジティブな効果を示している[110],[111]。
McLaurin-Jiangらによって行われた研究では、調査対象となった母親の母乳育児に対するワクチン接種の影響を調査することが目的だった。この研究では、子どもたちの症状もモニターされた。その結果、2回目の接種では、4455人の授乳婦に疲労、頭痛、筋肉痛、注射部位の痛み、悪寒、発熱、アレルギー反応などの症状が多く、母乳育児への悪影響や子どもの症状の出現はほとんど見られなかった[112]。
13.COVID-19ブースタードーズ
13.1.一次接種用またはCOVID-19感染後用のSARS-CoV-2 mRNAボスターワクチン
COVID-19ワクチンのブースター投与は、集団における本疾患の制御と本疾患の経済的・健康的水準の低減に非常に重要であると思われる。初回にワクチンを投与した結果の検討がワクチン接種の必然となっていることから、ブースターワクチンの接種時期や種類は、その後の接種において考慮すべき重要な要素である[113].
初期の研究では、免疫原性を高めるために同種ワクチンを使用し(初回投与と同じワクチンを使用)、その免疫原性と副作用を調査した。このような同種ブースターは、SARS-CoV-2のデルタ変異株に対する抗体価の上昇につながった。ミキシング&マッチングでは、ブースター用として、異なるプラットフォーム(Ad26.COV2.SやmRNA-1273など)のワクチン、または同じプラットフォームの異なるタイプのワクチン(Ad26.COV2.SやmRNA-1273など)からなる特別なワクチンプログラムを接種し、異種変異体を含むブースター用量として使用される。この戦略の成功率は、同種ワクチン接種と同様の免疫原性を提供できるだけでなく、その特定のプラットフォームに基づくワクチンの免疫原性の範囲と寿命を拡大し、SARS-CoV-2新変異体に対する免疫原性の可能性を高めることができる[113]。
多くの国は、COVID-19ワクチンが緊急使用リストに基づきWHOに承認されるとすぐに、国家的なワクチン接種プログラムを開始した。この承認には、ファイザー・バイオエヌテック、モデルナ、アストラゼネカ、ヤンセン、シノバック、シノファームが製造するCOVID-19ワクチンが含まれている。Pfizer-BioNTech、モデルナ、Janssenは、米国でブースター用量として使用されているワクチンである。CDCの承認によると、人々はこれらのタイプのワクチンのうち、以前に使用したことのあるタイプやプラットフォームに関係なく、ブースター用量としてどれかを選択することができる。ただし、これらのワクチンを混合して一次接種を2回行う場合は、追加接種を行う必要はない。COVID-19 mRNAワクチンプラットフォームの投与は、免疫不全患者に対するブースター用量として2021年8月12日にFDAによって承認された。Pfizer-BioNTech社およびモデルナ社のブースター用量処方は、COVID-19の接触リスクが高い仕事に就いている65歳以上の方にも拡大された。2021年11月、これら2種類のワクチンは、最初の一連のワクチン接種でこのプラットフォームを使用した18歳以上の人々に対してFDAによって承認された[89],[114]。
ブースター用量としてのPfizer-BioNTechとモデルナの投与は、初回接種から少なくとも6カ月後、他のプラットフォームでは少なくとも2カ月後に行う必要がある[114]。イスラエルでの大規模なワクチン接種は、他国での初回接種を目指す国があったときに行われた。その結果、2021年3月末までにイスラエル国民の50%以上がPfizer-BioNTech COVID-19ワクチンの2回接種を受けた。このワクチン接種にもかかわらず、イスラエルでは流行の第4波が発生したため、同国保健省による免疫不全者へのPfizer-BioNTechワクチンの3回目投与が必要となった。このプログラムにより、60歳以上の人が接種を受けた。2021年8月30日までに、12歳以上のすべての人がブースター投与を受けた[89],[114]。
英国のJCVI(Joint Committee on Vaccination and Immunisation)によると、1次接種で使用したプラットフォームの種類にかかわらず、Pfizer-BioNTechを用いたブースター投与(3次接種)が望ましいとされている。Pfizer-BioNTechとモデルナの両ワクチンはブースター投与により高い免疫率を発揮するが、COVID-19 mRNAワクチンを使用できない場合は、AstraZenecaのワクチンを3次投与として使用することができる[114]。
13.2.異なる変異体に対するSARS-CoV-2 mRNAボスターワクチン
2020年春、SARS-CoV-2はゲノムの4つの変異(スパイクプロテインの点変異)で形状が変化した。次に、出現したSARS-CoV-2変種は、感染力や免疫系からの逃避能力が高い以前のものに取って代わられた。イギリスのアルファ型(B.1.1.7)、南アフリカのベータ型(B.1.351)、ブラジルのガンマ型(P.1)、インドのデルタ型、オミクロン型(B.1.1.529)などはパンデミック時に共通して現れた変異型である。現在では、オミクロン型が最も一般的な変異型として残っている。これらの変異体の中で、構造上50以上の変異(少なくとも30個の変異がスパイクプロテインに発生)を持つオミクロンが1位に位置している[41],[115]。これらの変異は、SARS-CoV-2がワクチン接種や以前の変種への感染で作られた抗体の攻撃から逃れる能力を高めるものであった。オミクロンの亜種は、BA.1、BA.1.1、BA.2、BA.2.12.1、BA.4、BA.5で、最後の亜種(BA.5)の中和抗体価は前の亜種(BA.4)に対して3倍以上に増加している[115].
急性コロナウイルス症候群(B.1.1.529 [omicron])の最初の変異株は、南アフリカで出現した。その後、この品種は世界中に急速に広がり、WHOの宣言によれば、再流行が懸念されるまでになった。[116].ワクチン開発における課題の一つは、新型株に対する有効性と安全性である。モデルナとPfizer-BioNTechのワクチンの有効性は、α株またはδ株が流行していた2021年にMayo Clinicで行われた2つの試験で評価された。両ワクチンとも、入院に対して良好な有効性を示した。mRNA-1273の有効性はBNT162b2の有効性よりも高かったが、最近の変異体への感染に対する両ワクチンの有効性は低下していた。BNT162b2の有効性はmRNA-1273の有効性よりも低かった。完全接種した同一人物の感染率の低下に関する同様の研究の結果、mRNA-1273はBNT162b2よりも新規感染リスクをわずかに低下させることができた[63]。ほとんどのワクチンで2回接種した後、有効率は上昇する。そのため、脆弱な集団の間で2回接種によるワクチンの有効性を最大限に高める努力が必要である[117]。マレーシアで行われたオミクロン種に対するAZD1222,BNT162b2,CoronaVacワクチンの有効性に関する研究では、ブースター投与により、感染抑制率95.4%,症状性感染抑制率97.4%,死亡率91.7%と算出された。また、AZD1222、BNT162b2、CoronaVacのブースター投与による死亡率への効果は、それぞれ95.2%、91.8%、88.8%となった。この結果から、ブースター投与は非ブースター投与と比較して、感染症による症状に対してより有効であることがわかった[118]。
13.3.心筋炎とCOVID-19 mRNAワクチンとの関連性についての仮説
mRNAワクチン接種の満足な結果に加えて、稀な現象として心筋炎がCOVID-19 mRNAワクチン接種の脅威となる可能性があると考えられる。この免疫炎症反応は主に成人男性で観察され、mRNAの調製工程で生成されるdsRNAの不純物に起因している可能性がある。正確な説明はないが、炎症の原因は、ワクチン接種の副作用の可能性に関連している可能性がある[119]。心筋炎は、BNT162b2の接種を受けた人々におけるmRNAワクチンの副作用である可能性があり、その発生率は10万人あたり2.13人で、男性(29人中16人)の発生率がかなり高くなっている[120]。この疑問に対する信頼性の高い回答を得るためには、COVID-19ワクチン接種後の心筋炎の遺伝的可能性,性差,臨床的発生率および長期的影響を評価する必要がある[120]。
免疫抑制剤とCOVID-19 mRNAワクチンの関連性
COVID-19に対するワクチン製造会社が承認を得ようとしている重要な注意点の1つは、高齢者に対するワクチンの有効性を向上させることである。高齢者にとってワクチン接種プログラムが必要であるという事実に反して、これらの人々は通常、臨床試験で除外されている。ファイザー・バイオエヌテックとモデルナの第3相臨床試験では、高齢者での有効性に関する情報が公表されている。しかし、基礎疾患や障害を持つ高齢者については、あまり研究されていない。年齢が上がるにつれて、免疫力は低下していく。また、ワクチンに反応するT細胞の産生も低下する。その結果、CD8 T細胞の数が減少し、その結果、正常な細胞の比率(CD4:CD8)が妨げられる。また、これらの細胞の受容体の種類も減少し、そのすべてがT細胞の生存率を低下させる効果がある。加齢に伴い、選択されたタンパク質の減少により抗体価が低下するため、高齢者におけるワクチンの有効性が低くなる可能性がある[121]。自己免疫疾患や免疫抑制剤を服用している患者に関しては、ワクチンの有効性に関する情報は限られており、これはこれらの特定のグループが臨床試験から除外されているためだ。また、この集団の死因の多くはCOVID-19感染によるものだった。しかし、リウマチのデータによると、これらの人々のCOVID-19への感染と感染性の副作用については示されておらず、高用量のコルチコステロイドを使用したケースにのみ記録されている[122]。メトトレキサートとリツキシマブは、新抗原に対する抗体反応を中和する役割を果たす2つの液性免疫抑制剤である。リツキシマブはCD20 + B細胞を標的とし、メトトレキサートはB細胞活性化因子(BAFF)を攻撃し、免疫抑制性アデノシンを増加させることによって免疫系B細胞を抑制する。これらの薬剤が免疫原性のレベルに及ぼす役割に関するこれまでの研究や季節性インフルエンザワクチンに関する経験から、COVID-19ワクチン投与後、薬剤を中止すると、副作用や関節リウマチの悪化なしに最大2週間、ワクチンの免疫原性が上昇することが実証された。これらの患者に関するCOVID-19ワクチンの効果は、限界のため正確にはまだわかっておらず、さらなる評価が必要である[122]。Lucaらの研究では、BNT162b2ワクチンの免疫原性が、嚢胞性線維症患者260人と肺移植者18人を対象に調査された。抗SARS-CoV-2 IgGおよびIgAレベルは、2回の接種後にチェックされた。研究によると、ワクチン接種後に産生されたIgGとIgAのレベルは、健常者と有意に同等であった。移植患者、特にミコフェノール酸モフェチル服用者では、BNT162b2ワクチンの有効性が損なわれた。また、COVID-19ワクチンの有効性を確認し、感受性の高い層における免疫原性のレベルを測定することは非常に重要である[123]。
14.COVID-19に関連する自己免疫疾患のリスク上昇
COVID-19のパンデミック抑制につながったものの、副作用やその効果については、今後さらに検討すべき重要なポイントである。近年、COVID-19ワクチン接種後に免疫性血小板減少症、自己免疫性肝疾患、ギラン・バレー症候群、IgA腎症、関節リウマチ、全身性エリテマトーデスなどの自己免疫疾患の出現に関する報告がある。ワクチン接種後の自己免疫の現象については、自己抗体の産生、分子模倣、ワクチンアジュバントのスクリーニングが可能であることに留意する必要がある[124]。ワクチン接種後の血栓性血小板減少症の発症に関連して、多くの症例が観察されている[125]。また、28歳の女性がAZD1222ワクチン投与後に頭痛、体幹の紫斑、発熱、口腔内の出血性病変と診断されたことから、COVID-19ワクチン接種と免疫性血小板減少性紫斑病の関連性が問われている[126]。モデルナワクチンの2番目の関連症例は72歳の女性で、ワクチン投与1日後に血小板減少、皮疹、自然口腔内出血、頭痛、腕、脚、腹部の広範囲の点状出血、自己出血性水疱などの症状がみられた[127]。
また、35歳の白人女性がSARS-CoV-2に感染し、ワクチン注射から約13日後に全身のかゆみ、コレラ、黄疸などの症状が現れ、抗核抗体と二本鎖DNA抗体が陽性となり、疑義が生じたことが確認された[128]。また、36歳のイラク人医師が、ワクチン接種26日後に軽度の発熱反応や肝機能検査異常などの症状で受診している[129]。この2つの事例を含め、現在も調査中である。この結果から、COVID-19ワクチン接種後に現れる長期的な合併症に注意する必要があることが明らかになった[124]。しかし、自己免疫疾患患者を対象とした研究では、これらの患者にとって、これらのワクチンはほぼ安全であることが示された。
また、末梢神経系に関連する自己免疫疾患として、ギラン・バレー症候群(GBS)がある。この病気は、エプスタイン・バーウイルス、サイトメガロウイルス、ジカウイルスなどのウイルス感染によって引き起こされる。また、A型肝炎やB型肝炎、狂犬病、インフルエンザワクチンとの関係も解明されている。COVID-19のワクチン接種後にGBSが発生したというエビデンスがある[124]。ワクチン接種1週間後に全身倦怠感と身体痛の徴候を呈した82歳の女性は、GBSとワクチン接種の関連を示した最初の症例であった[130]。さらに、インドとイギリスで、GBSとヤンセンのワクチン,ChAdOx1-S/NCoV-19に関連する臨床症状が観察された[130],[131].
イランでは、スプートニクVを接種した人の3.3%が関節痛を発症した。724人のリウマチ・筋骨格系患者を対象とした研究では、BBV152とChAdOx1を接種した後、4人がこの病気になったことが示されている。関節炎の最初の症例は、慢性疾患の既往がなく、SARS-CoV-2に感染していない人で、Sputnik Vのワクチン接種後に症状が現れた。23歳の女性に対するCoronaVacワクチン接種は、左膝関節の腫れを引き起こしたが、ベタメタゾンによる治療で改善した。COVID-19 mRNAワクチン(mRNA-1273)と関節リウマチの関連性がFDAで承認された。
15.考察
世界的なワクチン接種プログラムでは、ワクチン成分の生物学的副作用に注意を払うことが必要であり、メタアナリシスによって調査することが可能である。現在、従来のワクチン接種に代わる方法はない。したがって、世界的なワクチン接種とパンデミックの沈静化の後、予期せぬ疾患の出現や、特にワクチン接種者において起こりうるヒト疾患の頻度が増加した場合は、その旨を報告する必要がある[85]。新しい技術を使用しているにもかかわらず、ワクチンの開発とスケールアップは労力と時間のかかる手順であり、品質と安全性の問題に対して大規模なテストを必要とする。幸いにも、mRNAワクチンは迅速にスケールアップすることができ、新興の状況において有望な候補となる。COVID-19のパンデミックでは、様々なワクチンプラットフォームが短期間で大量生産され、問題をコントロールすることで社会的信用を築いた。一方、大量生産のため、本来の品質を維持することが優先された。しかし、ほとんどの地域でmRNAワクチンの3回目の接種が行われ、接種者数は飛躍的に増加しており、心筋炎、不妊症、新種に対する効果なし、mRNAワクチンのゲノムへのウイルス核成分の組み込みなど、予想外の安全性所見に遭遇する可能性がある。mRNAワクチンに対する信頼は、世論とワクチン接種の目的を一致させるために、あらゆる側面から深く理解し、検討する必要があることは明らかである[18]。
外来mRNAの宿主染色体への組み込みは一般的な現象ではないが[133]、この可能性について注意し、除外する必要がある[134]。ヒトの体内には、数種類のレトロウイルスやLINEレトロトランスポゾンなどのレトロトランスポゾンが存在し、ストレス状態、炎症、アンバランスな免疫反応の刺激などで、細胞質内にモバイルRNAの一部を排泄し、ワクチンからmRNAをcDNAに転写することができる。そのため、レトロトランスポゾンが細胞質内に存在する場合、あるいはレトロウイルスが複製され、cDNAの核内移行とヒトゲノムへの統合を導くことができる場合、この統合を促進すると考えられる。このような現象は、ウイルス感染(HIVなど)の際に、統合の可能性を高める可能性がある。レトロウイルスの標的部位への組み込みの特異性については、まだ明確な理解が得られていないが、ウイルスのインテグラーゼは組み込みの効率に影響を与えることがある。細胞障害にはいくつかの制御系と修復系がある。多くのプロセスの制御は、細胞内でエピジェネティックに媒介される現象である。しかし、そのような構造は通常、統合の際にメチル化のような転写後のプロセスに非難されるか、あるいは免疫系によって除去される。
SARS-CoV-2からの逆転写RNAが培養ヒト細胞のゲノムに統合され、その結果COVID-19患者由来組織で発現することができるという統合の危険性を示す調査は少ないが[134]、事実、このようなワクチンの副作用、免疫原性、有効性に関する情報はまだ非常に少なく、科学的根拠に基づく最近のコメントはしばしば不明瞭で、時に誇張されている。また、mRNAワクチンの長期的な副作用についてはまだ誰も知らないし、短期的、中期的な副作用についてもまとめられていない。COVID-19パンデミックの高い罹患率と死亡率のため、ついに、COVID-19 mRNAワクチンはFDAによって緊急用としてのみ承認された。幸いにも、ワクチン接種プログラムは、欧州医薬品庁(EMA)、FDA、WHOの規制当局の厳しい管理下にある。COVID-19 mRNAワクチンに関連して報告された有害事象はそれほど多くのケースではなく、その利点はリスクや副作用を上回っている[135]。ワクチン接種はCOVID-19パンデミックへの対応の基礎となっているが、まだ地域社会の完全な支持を得ているとはいえない。本研究では、まず、多くのコミュニティが持つワクチン接種の普及に対する疑念を軽減し、次に、COVID-19 mRNAワクチンのような新世代のワクチンに対する人々の認識を高めるための小さな窓口として、情報を提供する試みを行った。
16.結論
ここ数十年、新型コロナウイルスが続々と開発されていることから、将来、このファミリーやその他の新興ウイルスが新たに開発される可能性があり、安全で信頼性が高く、強固なワクチンの迅速な開発が不可欠である。適切な前臨床モデルがない、標的病原体に対する自然免疫が存在する、ワクチンのバイオプロセスのスケールアップなど、新興ワクチン基質に関する共通の課題に加え、これらの課題に対処するためには、ワクチン学の領域における熱意や楽観主義が非常に重要であることは注目すべき点である。さらに、反ワクチン派の人々に明確で科学的な文書を提示し、これらのハイテクワクチンの利点を納得させ、SARS-CoV-2の変異型の流通と発展を防ぐために、利用可能なあらゆるワクチンで公衆接種を行う必要性を説明する必要がある。将来、COVID-19と共存し、この感染症の高い罹患率と死亡率に目を向けることは、あまりにも辛いことである。私たちは、反ワクチン集団の好みを安全なワクチン接種のアイデアに変えなければならない。この総説は、普遍的なワクチン接種プログラム後の人類を改善するために、偏見を持たずにワクチンのあらゆる側面を考察しようとしたものである。COVID-19ワクチンに関するより良い認識と包括的な理解のための努力は、メーカーに不信感を抱かせるべきではない。しかし、mRNAベースのCOVID-19ワクチンは、感染症や癌などの非感染症に対する他の種類の遺伝子ワクチンの設計と製造のための成功した科学的パターンとなる可能性があることを考慮しなければならない。
競合する利害関係の宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる既知の競合する金銭的利益または個人的関係がないことを宣言する。
ファンディング
本研究は、公的、商業的、非営利的な分野の資金提供機関から特定の助成を受けたものではない。