Contents
Alzheimer’s Disease: Experimental Models and Reality
www.ncbi.nlm.nih.gov/pmc/articles/PMC5253109/
要旨
アルツハイマー病の実験モデルは、病因のより良い理解を得るために、また、新しい治療法の可能性を評価するために重要である。最も一般的に使用される実験動物モデルは、アミロイド斑の形成をもたらす家族性アルツハイマー病(家族性アルツハイマー病)に関連するヒト遺伝子を過剰発現させるトランスジェニックマウスである。しかし、アルツハイマー病はアミロイドプラークと神経原線維絡み合い病理の両方の存在と相互作用によって定義されている。これまでのところ、アルツハイマー病の臨床試験の成功の実績は非常に悪い。一部では、この失敗率の高さは、アルツハイマー病病理学の限られた側面しか反映していない動物モデルで非常に成功した結果をヒトに移植するのが早かったことに関係している。様々なモデルの長所と短所をより深く理解し、潜在的な治療法を評価するために複数のモデルを使用することは、前臨床試験から患者への治療法翻訳の成功を高めるのに役立つであろう。このレビューでは、トランスジェニックマウス、トランスジェニックラット、散発性アルツハイマー病の様々な生理学的モデル、および試験管内試験ヒト細胞培養モデルを含むアルツハイマー病の主要な実験モデルの病理学的特徴と限界についてまとめている。
はじめに
実験モデルは、アルツハイマー病の病態をさらに理解し、新規治療薬の前臨床試験を行うために不可欠である。現在までのところ、実験モデルの大部分は動物モデルであり、ほとんどがアミロイドプラークの形成をもたらすヒト遺伝子を発現するトランスジェニックマウス(ヒトAPP単独またはヒトPSEN1との組み合わせによる)および神経原線維性血管束(ヒトMAPTの発現による)から構成されている[14, 34, 117, 172, 173]。他のモデルとしては、ショウジョウバエメラノガスターや線虫などの無脊椎動物やゼブラフィッシュなどの脊椎動物が挙げられるが、これらのモデルは人間の生理学から距離を置いているため、あまり広く使われていない[13, 53, 104]。1995年に実質的なアミロイドプラーク負荷を持つ最初のトランスジェニックマウスモデルが開発されて以来[42]、新しいトランスジェニックモデルが増殖しており、それぞれがアルツハイマー病関連病理の異なる表現型を持っている[34, 117, 173]。トランスジェニックモデルの開発は、これまでヒトでは調べることが不可能であった疑問に答えることができるようになり、アルツハイマー病の病態の理解に多くの期待が寄せられている。そのため、アルツハイマー病トランスジェニックモデルを用いた研究の数は急速に増加した。しかし、質問はますます利用可能なトランスジェニックモデルに依存することの妥当性について提起されている、特にアルツハイマー病治療薬の臨床試験の非常に高い失敗率(〜99.6%の)に照らすと、これらの動物モデルを用いた前臨床試験で成功したものの多くは[6, 27, 139]。これらの結果は、これらの動物モデルがアルツハイマー病を持っていないという見落とされがちな事実を強調し、彼らは、効率的な実験を可能にするように設計された非生理学的な方法で、最も一般的に、特定の病理学的特徴を再現している。動物モデルの大部分(トランスジェニックと生理学的モデルの両方)は、アルツハイマー病を定義するアミロイド蓄積のみを開発する。これはしばしば(常にではないが)特定の記憶関連の認知障害をもたらす。しかし、重要なことに、これらのモデルでは、神経細胞の喪失や最も重要なことに神経原線維のもつれの発生を含む、アルツハイマー病を定義する他の病理学的特徴が広範囲に存在しないことが多い。このような追加的なアルツハイマー病関連病理学的特徴の欠如は、前臨床試験と臨床試験の間の翻訳の欠如の少なくとも一部を説明することができる[6]が、トランスジェニックモデルで最初に試験されなかったアプローチの臨床試験の失敗もいくつかある[69]。このように、結果をより正確に解釈し、ヒト研究への翻訳の可能性を高めるために、各モデルに存在する正確な神経病理学、特にこれがヒトのアルツハイマー病とどの程度相関するかについて十分に理解しておくことが重要である。実験モデルから得られた結果は、研究者が各モデルに関連する限界を認識していれば、アルツハイマー病の特定の側面について非常に有益な情報を得ることができる。したがって、本レビューでは、アルツハイマー病の病態に関する我々の理解と、トランスジェニックマウス、トランスジェニックラット、散発性アルツハイマー病の生理学的モデル、無脊椎動物および試験管内試験ヒト細胞培養モデルを含む、この病態を反映したアルツハイマー病の主要な実験モデルの特徴と限界について議論する。
アルツハイマー病神経病理学
アルツハイマー病は複雑で多因子性の疾患であり、ヒトに特有の疾患であると考えられている。発症年齢、進行率、病理学的発達は患者間で大きく変動する。アルツハイマー病は、脳実質および血管系における細胞外プラークへのアミロイドβ(アミロイドβ)の病理学的蓄積によって脳内で定義されており(共親和性アミロイド血管症[脳アミロイド血管症]として知られている異常にリン酸化されたタウが脳内に蓄積して神経原線維のもつれ(NFTs)を形成している[102, 136]。アミロイドβとリン酸化タウの病理学的な凝集は、連続したプロセスで起こる。少数のモノマーが最初に脳内でオリゴマーに凝集し、その後、アミロイド斑やNFTで観察されるフィブリルに凝集し続ける [136, 144]。これらの種のレベルがプラークやNFTの存在よりも認知症状との相関性が高いため、オリゴマーがアルツハイマー病における最も神経毒性の高い種であることが示唆されている[166]。アミロイド斑は主に凝集したアミロイドβからなる。アミロイドβの最も豊富な形態はアミロイドβ1-40およびアミロイドβ1-42であるが、他の重要なアミロイドβ種には、アミロイドβ1-38,アミロイドβ1-43,およびアミロイドβN3pE(ピログルタミン酸修飾を有するN末端で切断されたアミロイドβpアミロイドβ(8または26位にリン酸化されたセリンを有するアミロイドβおよびアミロイドβ5-x(N末端で切断されたアミロイドβ)のような翻訳後修飾を有するアミロイドβが含まれる[144]。これらの異なるアミロイドβ種の存在および量は、それぞれの種が異なる凝集速度を有し、それらが優先的に異なる凝集種を形成し、いくつかは他の種よりも毒性が強いために重要である。例えば、pアミロイドβは、オリゴマー形成および伝播を促進することが示されており、その存在は、アミロイド沈着物の生化学的ステージングにおいて使用されている[84, 122, 158]。アミロイドβは、アミロイド前駆体タンパク質(APP)の切断産物である。APPは、最初にBACE1によって切断され、その後、単量体のアミロイドβを放出するためにγ-セクレターゼ(プレセニリン-1,ニコストリン、APH-1およびPEN-2で構成されるプロテアーゼ)によって切断される。アルツハイマー病では、アミロイドβの産生の増加および/またはアミロイドβのより凝集しやすい種の産生(家族性アルツハイマー病の場合)またはアミロイドβのクリアランス障害(散発性アルツハイマー病[散発性アルツハイマー病]の場合)のいずれかが、脳内のアミロイドβ蓄積で結果を得る[144]。広範な証拠は、このプロセスが最初に脳内で、主にシナプスで発生することを示している[50, 166]。この蓄積はアミロイドβの可溶性アミロイドβオリゴマーへの凝集をもたらし、これは最も毒性の高いアミロイドβ種と考えられている[166]が、その後、大脳実質(プラーク)と血管(脳アミロイド血管症)で線維性アミロイドに凝集する。
アルツハイマー病のリスクを増加させることが示されている多くの環境因子や遺伝的因子があるが、これらのリスク因子とアルツハイマー病の病因への個々の寄与との相互作用を理解することは、現在進行中のプロセスである。アルツハイマー病は家族性早期発症(若年性アルツハイマー病:全アルツハイマー病患者の5%未満、発症年齢65歳未満)または散発性後期発症(散発性アルツハイマー病:発症年齢65歳以上)のいずれかとして特徴づけられる。プレセニリン1,プレセニリン2(PSEN1とPSEN2)またはアミロイド前駆体タンパク質(APP)の常染色体優性突然変異は、若年性アルツハイマー病症例の5-10%(全アルツハイマー病症例の~1%)しか占めておらず、若年性アルツハイマー病の大部分の原因は解明されていない[17, 52, 170]。ゲノムワイド関連研究(GWAS)は、自然免疫、コレステロール代謝、シナプス/神経細胞膜機能に関与する遺伝子を含む、散発性アルツハイマー病のリスク増加をもたらす20以上の遺伝子座を同定しており、散発性アルツハイマー病の病態は非常に異質であることを示唆している[28, 52, 75]。散発性アルツハイマー病の最も強力な遺伝的危険因子として同定されているのは、アポリポ蛋白質(apo)E4対立遺伝子の継承であり、この蛋白質産物は脳アミロイドβの凝集とクリアランスに影響を与える [63, 115]。骨髄細胞2上に発現するトリガー受容体をコードする別の遺伝子(TREM2)のまれな変異は、アポE4と同様のオッズ比で、散発性アルツハイマー病の有意な危険因子として報告されている[162]。家族性アルツハイマー病(家族性アルツハイマー病)は散発性アルツハイマー病と比較して発症年齢が早く、神経病理学的および臨床的特徴が異なる[80, 127, 147, 156]。個々の家族性アルツハイマー病症例の正確な表現型は大きく異なり、存在する突然変異に依存する。家族性アルツハイマー病は皮質下のアミロイドβ42の不均衡な蓄積を示し、線条体タウ病理の亢進と関連している [147]。後者は、突出したミオクローヌス、構音障害、錐体外路症状などの家族性アルツハイマー病における非定型臨床症状の有病率の上昇の原因となる可能性がある[147]。さらに、家族性アルツハイマー病では、TDP-43やアルギロフィル性穀粒病などの関連する神経病理の発症は散発性アルツハイマー病と比較して有意に異なっている;アルツハイマー病NIの散発性アルツハイマー病コホートでは、後者の2つの病理が被験者の約20%にみられたが、家族性アルツハイマー病 DIANコホートではこれらの病理はみられなかった[18]。散発性アルツハイマー病と家族性アルツハイマー病の間のこれらの違いは、家族性アルツハイマー病に連結した変異を含むAPPとPSEN1の過剰発現に主に基づいているトランスジェニックマウスモデルにおける治療所見の翻訳性に影響を与えるかもしれない。
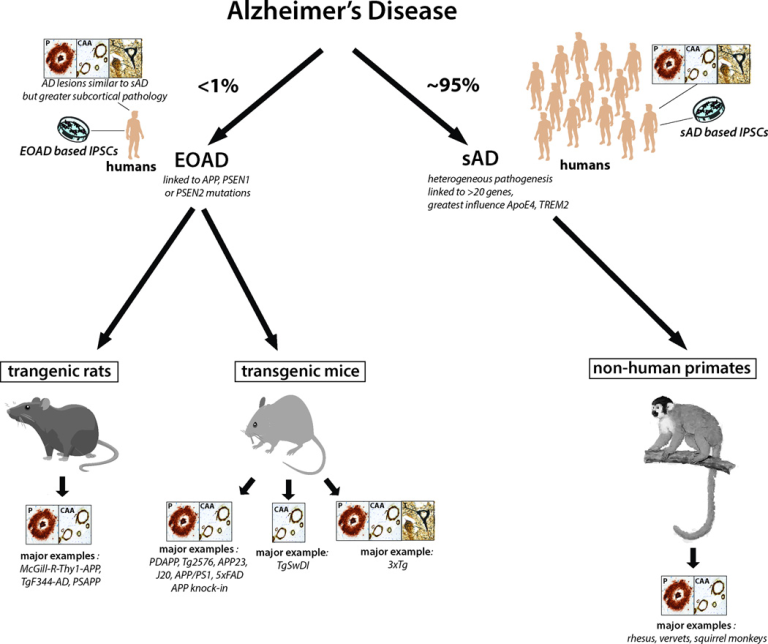
図1 アルツハイマー病の主要な動物モデルの模式図
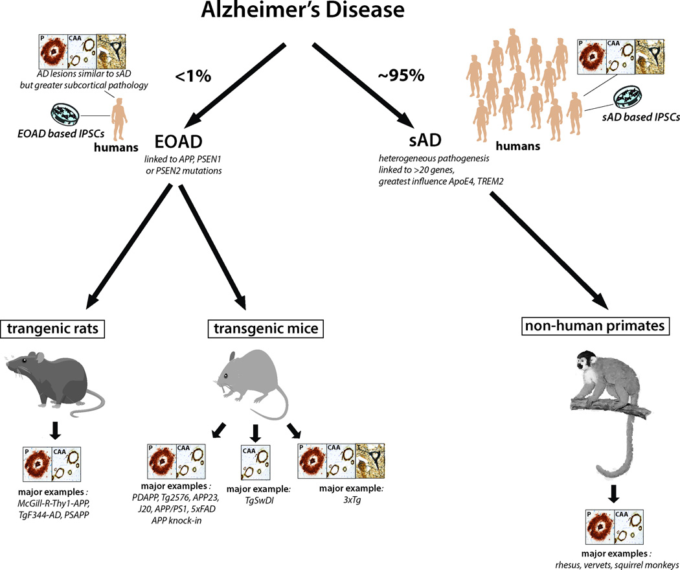
アルツハイマー病症例の1%未満は、APP、PSEN1またはPSEN2の常染色体優性変異によって引き起こされる早期発症家族性アルツハイマー病(若年性アルツハイマー病)症例である。しかしながら、すべての主要なトランスジェニックげっ歯類モデルは、APPおよびPSEN1のこれらの変異型を発現している。散発性アルツハイマー病について利用可能な最良の動物モデルは、非ヒト霊長類である。各モデルに存在する神経病理のタイプの一貫した存在は、ボックスに示されている;P:プラーク;脳アミロイド血管症;コンゴフィリン性アミロイド血管症;T:神経原線維のもつれ。我々は、これらの動物モデルにおけるプレタングル病理の存在を、神経原線維性タングル病理の存在を示すのに十分であるとは考えなかった。そのため、3xTgマウスのみがアルツハイマー病の3つの病理学的特徴を全て発現している。各カテゴリーに含まれる特定の種類の動物モデルは、現在アルツハイマー病研究で使用されている最も一般的な動物モデルの例である。
アルツハイマー病の神経病理学的評価のための現在のコンセンサスガイドラインは、3つのパラメータ(アミロイド、BraakおよびCERアルツハイマー病病期分類)でランク付けされ、神経斑とNFT病理学の両方を定量化する「ABC」スコアを得ることになっている[65, 99]。アミロイド斑とアルツハイマー病の認知障害とを相関させた多くの臨床病理学的研究があり、最も強い相関関係は疾患の初期段階に存在し、NFTと大脳新皮質変性がより広範囲になるにつれてこの関連性は大幅に弱くなるという新たな画像がある[9, 102, 103, 157, 160, 169]。一方で、多くの研究が、新皮質NFTと認知機能低下との間の強い関連を文書化している[26, 46, 48, 97, 123, 160, 169]。このデータは、アミロイドβプラーク/アミロイドβオリゴマーが広範なタウ/NFT病理を誘発するというアミロイドカスケード仮説と一致しており、後者は臨床疾患の根底にある神経細胞やシナプスの喪失のより直接的な原因を表している[144]。しかし、このシナリオでは、アミロイドβ病理の蓄積はアルツハイマー病の前臨床およびMCI段階でのみ顕著な役割を持ち、一方、タウ病理は初期の臨床アルツハイマー病ではすでに顕著である。したがって、アルツハイマー病のアミロイドβモデルでのみ成功することが示されている治療アプローチは、病気の前臨床またはMCIの段階でアルツハイマー病の病理学の軌道に影響を与える可能性が期待されるだけである。確立されたアルツハイマー病における潜在的な効果のためには、アミロイドβとタウの両方の病理学を持つアルツハイマー病のモデルで病理学を減少させる治療法が示されなければならない。さらに複雑なのは、内側側頭タウ症がアミロイドβ沈着に先行していることを示す広範な証拠があることである[15, 25, 35]、おそらく独立したメカニズムを介して、タウ病理に直接対処するための成功したアルツハイマー病治療アプローチの必要性を強調している。過去には、これらの事実は、ADモデルから患者への研究の翻訳においてしばしば考慮されていなかった[171, 172]。
アルツハイマー病の臨床診断は現在、認知の特定領域の低下とアミロイドおよび/またはタウPETを含むアルツハイマー病バイオマーカーアッセイでの陽性結果に基づいている。アルツハイマー病の確定診断は、アミロイド斑とタウ病理の両方の死後神経病理学的評価に依存しており、これらは非常に少数のADモデルで一緒に存在している。
トランスジェニックマウスモデル
アルツハイマー病研究に用いられる動物モデルの大部分はトランスジェニックマウスである。野生型マウスAPP(695アイソフォーム)はヒトAPPと97%の配列相同性を有している。重要なことに、マウスとヒトの間の配列の違いは、アミロイドβ配列内の3つのアミノ酸(R5G、Y10F、H13R)を含む[155,174]。これらの違いはアミロイドβ凝集を阻害し、野生型マウスではアミロイドプラークの形成を阻害する。したがって、ヒトAPPの発現は、マウスのアミロイドプラーク形成に必要である。初期のトランスジェニックモデルは、マウスで野生型ヒトAPPを発現させたが、これらのトランスジェニックマウスはアミロイドβ産生を増加させたが、それらは一貫して広範なアルツハイマー病関連神経病理学を示すことができなかった[14, 34, 117, 172, 173]。対照的に、家族性アルツハイマー病に関連する変異を含むヒトAPPの発現は、一貫したプラーク病理学と、その結果として生じる下流のアルツハイマー病関連病理学的特徴の量の変化をもたらした。複数のトランスジェニック株が作製されており、各トランスジェニック株の正確な表現型は、家族性アルツハイマー病変異、使用されたプロモーター、およびバックグラウンドマウス株に強く依存している。大多数のアルツハイマー病トランスジェニックモデルは家族性アルツハイマー病変異の発現に依存する病理を有し、ほとんどのアルツハイマー病臨床試験は、アルツハイマー病の病態が家族性アルツハイマー病と大きく異なる散発性アルツハイマー病患者で実施されているので、これは、これらのモデルでの成功の翻訳可能性のための1つのつまずきのブロックを表している。アルツハイマー病研究で最も一般的に使用されているトランスジェニックマウス株の神経病理学と関連する認知障害は、表1に詳述されている。各モデルは、実施された認知テストの感度、タウ関連病理の量、シナプス病理の程度(超微細構造研究および/または電気生理学によって示される)の点で特徴づけられる程度が大きく異なり、モデル間の絶対的な比較を困難にしていることに留意すべきである。
表1 アルツハイマー病の最も一般的なトランスジェニックモデル
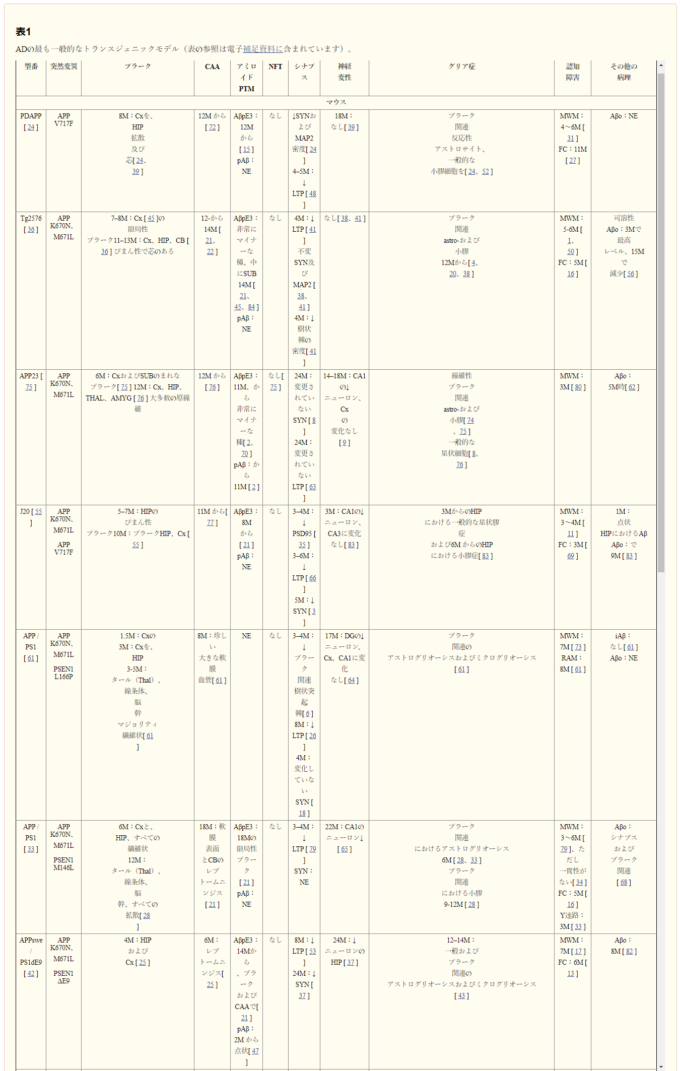
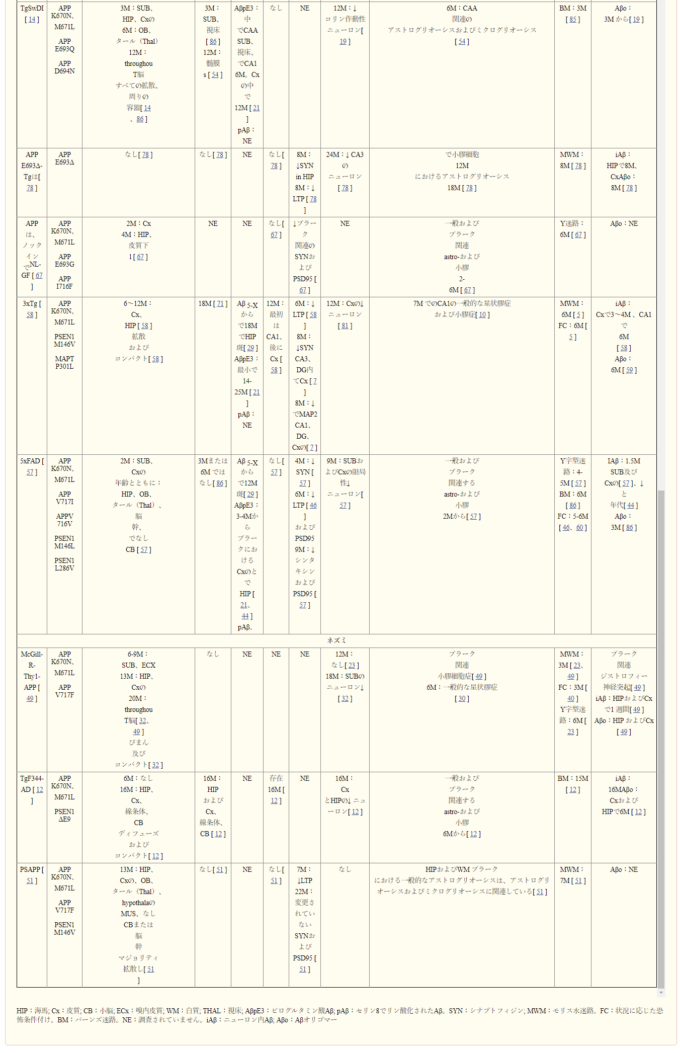
HIP:海馬;Cx:皮質;CB:小脳;ECx:内耳皮質;WM:白質;THAL:視床;アミロイドβpE3:ピログルタミン酸アミロイドβ;pアミロイドβ.セリン8でリン酸化されたアミロイドβ;SYN:シナプトフィシン;MWM:モリス水迷路;FC:文脈的恐怖条件付け;BM:バーンズ迷路;NE:未調査;iアミロイドβ:脳内アミロイドβ;アミロイドβo.アミロイドβオリゴマー
ヒトAPPおよびPSEN1を発現するトランスジェニックマウスに家族性アルツハイマー病変異を導入
最初に開発されたトランスジェニックマウスモデルは、個々の家族性アルツハイマー病変異を有するAPPを発現させた。そのようなモデルの最初の例は、PDGF-βプロモーターによって駆動されるインディアナ変異(APPV717F)を持つヒトAPPを発現したPDAPPマウスであり、APPの劇的な過剰発現(10倍以上)を引き起こした[42]。この結果、大脳皮質および海馬におけるプラーク形成、脳アミロイド血管症、グリア症、シナプス障害および認知障害を含むヒトADに関連する病理をもたらした(表1)。Tg2576マウスモデルの生成は密接に続いた。Tg2576マウスは、PrPプロモーターによって駆動される二重スウェーデン変異(APPK670N/M671L)を有するヒトAPPを発現し、これはまた、APPの有意な過剰発現(5倍以上)をもたらした[62]。Tg2576マウスでは、前頭葉、側頭葉、大脳皮質、海馬、小脳にプラークが発生した。さらに、脳アミロイド血管症、シナプス障害、グリア症、記憶障害も認められた(表1)。APP23マウスはAPPK670N/M671Lも発現しており、Thy1プロモーターによって駆動されるAPP751アイソフォーム(Tg2576マウスで発現しているPrPプロモーターによって駆動されるAPP695アイソフォームと比較して)を発現していることから、Tg2576マウスと対照的である[151]。APP23マウスは、Tg2576マウスに見られるびまん性プラークと比較して、より顕著な脳アミロイド血管症を有し、直ちにコンパクトなプラークを形成し、Tg2576マウスには見られない局所的な神経変性を有する(表1;[152])。これらの違いは、APPトランスジーンの発現レベルが類似しているにもかかわらず、プロモーターとAPPアイソフォームがトランスジェニックモデルにおけるアルツハイマー病関連神経病理の種類と時間経過に大きく影響することを示している。
その後、複数の家族性アルツハイマー病関連変異を一度に発現させると、より重篤な病態を持つトランスジェニックマウスが若年で発症することが明らかになった。これは、スウェーデン変異とインディアナ変異の両方を発現させたJ20マウス[100]のように、複数のAPP 家族性アルツハイマー病変異を発現させたマウスで観察されたが、より一般的には、APPとPSEN1 家族性アルツハイマー病変異を一緒に発現させた場合(APP/PS1トランスジェニックマウスと呼ばれる)に観察された。様々なAPP/PS1トランスジェニックマウスモデルが開発され、アルツハイマー病研究で一般的に使用されている。各モデルの特定の表現型は異なり、特定の家族性アルツハイマー病変異および使用されるプロモーターに依存する(最も一般的なモデルは表1に詳述されている)。例えば、APPK670N/M671LおよびPS1L166Pの発現は、約6週間から始まる非常に初期のプラーク形成をもたらす[118]一方、APPK670N/M671LおよびPS1M146Lの発現は、約6ヶ月で後期のプラーク形成をもたらす[58]。広く使用されている最も極端なAPP/PS1マウスモデルは、5x家族性ADモデルである;これらのマウスは、スウェーデン(APPK670N/M671Lロンドン(APPV717Iフロリダ(APPI716V)のAPP変異、およびPS1M146LとPS1L286Vの変異を発現している[107]。5つの家族性アルツハイマー病変異の発現は、6週目に非常に早い段階で脳内アミロイドβ蓄積をもたらし、その後2ヶ月目にはプラーク形成が密接に起こる。
全体的に、ヒトAPPを発現するトランスジェニックマウスの一般的な特徴は、ヒトPSEN1の有無にかかわらず、特に大脳皮質や海馬のようなアルツハイマー病のプラークに典型的に豊富な脳領域での強固なプラーク形成である。いずれもアルツハイマー病に類似したプラーク関連グリア症を有し、大多数は、長期増強の低下やシナプトフィシンなどのシナプスマーカーのレベル低下などのシナプス障害に関連した局所的な病理学的病理学を有している。彼らはすべて、特に空間記憶タスクで、認知障害の証拠を持っている。しかし、認知障害のタイミングは、アルツハイマー病よりもはるかに早く発症することに注意することが重要である;典型的には、ヒトのプラーク発達の数十年後に比べて、トランスジェニックマウスのプラーク発達の発症と一致している。これらのトランスジェニックマウスモデルの大きな限界の一つは、アルツハイマー病に見られる広範な神経変性や脳の局所的な萎縮がないことである。これらのマウスモデルのほとんどで軽度の神経変性の証拠があるが、それは非常に高齢の動物でのみ発生し、非常に特定の脳領域に局在していた。これらのマウスモデルの他の主要な制限は、いくつかは「プレタングル」[107,118,151,159]を表すかもしれない局在化した高リン酸化タウの証拠を示したが、どれも神経原線維性のタングルを開発しなかったということであった。
タウを発現するトランスジェニックマウス
野生型マウスのタウでは、神経原線維のもつれは発生しない。これは、マウスとヒトのタウの配列の違い(88%の配列相同性しか共有していない)と、成体マウスが4Rアイソフォームのみを発現しており、ヒトに存在する3Rと4Rの混合型ではないという事実に起因すると考えられる。重要なことに、ヒトタウの6つのアイソフォームすべての発現は、内因性タウを欠いたマウスでのみもつれの形成をもたらすことから、内因性マウスタウがヒトタウの凝集を阻害することが示されている[2]。対照的に、FTLDに関連する変異を含むヒトタウを発現するトランスジェニックマウスでは、NFTが容易に形成される;最も一般的に使用されているモデルは、P301LまたはP301S変異を有する4Rタウを発現するマウスである[49, 91, 92, 135, 177]。これらのマウスでは、NFT、神経変性、萎縮、運動障害が発現する。これらの変異はヒトのアルツハイマー病とは関連しておらず、変異タウの発生は、アルツハイマー病で起こることを代表するものではない方法で、その毒性やアミロイドβとの相互作用に影響を及ぼす可能性があるため、NFTの発生にこれらの変異が必要であることは、これらのトランスジェニックマウスモデルの明らかな限界である。さらに、変異したタウの過剰発現は、アルツハイマー病では見られない著しい運動障害をもたらし、認知テストを妨害する。
プラークとタウの両方を有するトランスジェニックマウス
限られた数の研究ではあるが、プラークとタングルの両方を示す動物モデルの開発が報告されている [10, 51, 91, 109, 121]。これらのモデルでは、APP、MAPT、そして時にはPSEN1またはPSEN2の変異型の同時発現に依存して、同じモデル内でプラークとタングルの形成を誘導している。しかしながら、プラークとタングルの両方の一貫した豊富な発現は厄介であることが証明されており、これらのモデルでは、プラークとタングルの両方の発生は、典型的には高齢になるまで観察されない。報告されているすべてのモデルのうち、3xTgマウスモデルのみがアルツハイマー病研究に広く使用されており、利用可能なアルツハイマー病病理の最も完全なトランスジェニックマウスモデルと考えられている[108]。3xTgマウスは最初に3-4ヶ月で脳内アミロイドβを発現し、その後大脳皮質と海馬で約6ヶ月でプラークが形成される。NFTは、最初はCA1で、その後大脳皮質で、約12ヵ月で形成される;しかしながら、彼らはアルツハイマー病組織と比較してはるかに広範ではない(図2を参照)。マウスはまた、6ヶ月後から軽度の局所的な神経変性、シナプス障害の証拠、および認知障害を有する(表1)。しかし、3xTgマウスは、まだ散発性アルツハイマー病におけるそれの代表的なものではなく、非生理学的な方法で非常に過剰に発現している変異アミロイドβとタウの産生によって制限されている。さらに、プラークやタングルの広範な存在は、典型的には、これらのマウスでは高齢になるまで観察されず、その時でさえも病理学は、典型的なアルツハイマー病で見られるよりも少ない(図2を参照)。
図2 ヒトのADモデルとトランスジェニックマウスのADモデルとの神経病理学的差異
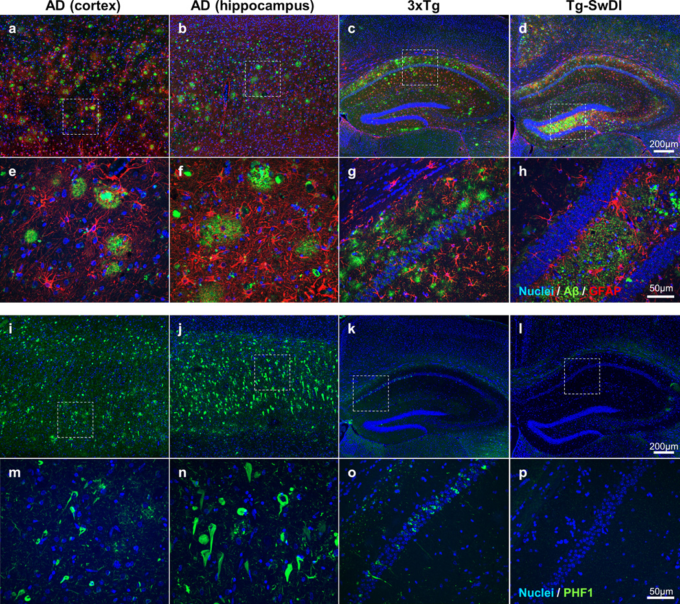
蛍光免疫組織化学は、種の違いを強調するために、ヒトとマウスの組織のための同じ条件を使用してホルマリン固定パラフィン埋め込まれた脳切片上で行った。ヒトAD皮質(a、e、I、mヒトAD海馬(b、f、j、n3xTgマウス(28ヶ月齢)海馬と皮質(c、g、k、oおよびTg-SwDIマウス(16ヶ月齢)海馬と皮質(d、h、l、p)の免疫染色を示す。a-h:アミロイドβ(緑色;4G8抗体と6E10抗体の組み合わせで標識)とアストロサイト(赤色;GFAPで標識)の免疫組織化学を示す。a-dおよびi-lは、海馬と皮質全体の低倍率でのアミロイドβ、アストロサイトおよびリン酸化タウの分布の違いを示している(すべてのスケールバー = 200μm)。e-hおよびm-pは、a-dおよびi-lのボックスで囲まれた領域の高倍率(すべてのスケールバー = 50μm)でのプラークおよび神経原線維のもつれの形態の違いを示している。最も明白な種の違いは、3xTgマウス(c)またはTgSwDIマウス(d)と比較して、ヒト(a)では皮質にプラークが優先的に存在すること、ヒト(e)ではコア付きプラークとびまん性プラークの両方が広範囲に存在するが、マウスでは存在しないこと(g、hおよび3xTgマウス(k)と比較して、ヒト(i、j)では神経原線維性のもつれの密度が高いことなどである。予想されたように、Tg-SwDIマウスでは、神経原線維のもつれは存在しなかった(l、p)。
アルツハイマー病研究に有用なユニークなトランスジェニックマウスモデル
アルツハイマー病の特定の病理学的特徴を再現するのに特に優れている多くのトランスジェニックマウスモデルが開発されている。例えば、Tg-SwDIトランスジェニックマウスモデルは、脳アミロイド血管症の特に優れたモデルである[29]。このモデルは、スウェーデン語(APPK670N/M671Lオランダ語(APPE693Q)およびアイオワ語(APPD694N)のAPP 家族性アルツハイマー病変異を発現している。オランダ型とアイオワ型の変異は、アミロイドーシスを伴う遺伝性脳出血(HCHWA)と関連しており、ここではプラーク病理学的にはより限定的であるが広範な脳アミロイド血管症が存在する[73]。Tg-SwDIマウスでは、生後3ヶ月からフィブリル状の血管アミロイドβの強固な蓄積と、それほど顕著ではないびまん性の実質プラークが発生する[29](図2参照)。脳アミロイド血管症は主に毛細血管に存在し、アルツハイマー病における顕著な動脈脳アミロイド血管症とは対照的である。Tg-SwDIマウスはまた、コリン作動性ニューロンの局所的な神経変性と認知障害を有する(表1)。合併症を伴わずに血管アミロイド沈着を減少させる治療的アプローチの能力をテストすることは、特に重要である。現在進行中の受動的免疫化アルツハイマー病臨床試験において、主な合併症は、出血を伴う/伴わない血管性浮腫(または脳炎)である(浮腫を伴うアミロイド関連画像異常(ARIA-E)または出血を伴うアミロイド関連画像異常(ARIA-H)と呼ばれる)[116, 132, 133, 171, 172]。ARIAは、最近報告されたducanumab試験でも大きな問題となっている(高用量およびAPOEε4キャリア群では55%の患者に影響を与え、この副作用の発現による患者の脱落率は35%であった)[136, 145, 171]。したがって、血管新生性浮腫や脳炎を誘発することなく脳アミロイド血管症に対して有効な治療法を開発することは非常に重要である[116, 132, 133, 136, 144, 172]。したがって、広範な脳アミロイド血管症(実質的にすべてのアルツハイマー病患者と高齢の認知機能正常者の約3分の1が有する)を有するモデルを用いて治療法の前臨床試験を行い[68, 179]、微小出血を誘発しないことを示すことが重要である。APP E693Δ-Tgモデルは、大阪(APPE693Δ)変異を発現しており、生後8ヶ月からアミロイドβオリゴマーの発現が有意に増加し、シナプス障害や認知障害が生じるというユニークな表現型を示すが、プラークやタウの病理形成は認められない[159]。このことは、アミロイドβオリゴマーの病理学的効果および/または最も毒性の高いアミロイドβ種と考えられているアミロイドβオリゴマーに特異的に作用する治療薬の効果を調べる機会を可能にしている[79]。これら2つのマウスモデルの主な利点は、他のモデルよりも堅牢にアルツハイマー病の特定の病理学的特徴を再現していることである。これらのモデルの制限は、彼らはアルツハイマー病のすべての機能を再現していないため、アルツハイマー病の完全なモデルとして使用することはできないということである。
ノックインマウスモデル
アルツハイマー病に関連する病理学を再現する最も最近開発されたトランスジェニックマウスモデルは、ノックインマウスである。これらのマウスは、マウスアミロイドβをヒト化し、特定のAPP 家族性アルツハイマー病変異をノックインすることにより、他のすべてのトランスジェニックマウスモデルに存在するAPP過剰発現の交絡効果を回避するように設計されているので、これらのマウスは、はるかに多くのアルツハイマー病の生理学的モデルであると考えられている。その結果、ノックインマウスは、野生型マウスと同じAPPおよびAICDの発現を有し、APPの発現は、正しい脳領域および細胞型において生理学的な方法で行われる。他のトランスジェニックマウスモデルと同様に、病理のタイミングは発現した変異に依存する。例えば、スウェーデン型、ロンドン型、オランダ型の変異をノックインした場合、PS1M146Vノックインマウスの背景に繁殖させた場合にのみ、プラークが発生する。対照的に、スウェーデン突然変異とイベリア突然変異のノックインでは、6ヵ月後にプラークの発生が始まり、18ヵ月後からグリア症、シナプス変化、記憶障害が生じる [129]。これらのマウスに北極突然変異を追加でノックインすると、2ヵ月後からプラークが発生して脳全体に広がり、6ヵ月後からは記憶障害が生じるなど、より急速な病理学的発達を示すようになる [129]。これらのトランスジェニックマウスは、より生理学的なトランスジェニックモデルの生成において重要な一歩を踏み出したものであるが、これらは家族性アルツハイマー病のモデルであって散発性アルツハイマー病のモデルではないこと、そして特定の複数の家族性アルツハイマー病変異の組み合わせをノックインした後にのみ病理が発現することを認識しなければならない。
トランスジェニックラットモデル
アルツハイマー病のトランスジェニックラットモデルのより少ない数も開発されている。トランスジェニックラットは、トランスジェニックマウスよりも多くの潜在的な利点を持っている;彼らは彼らの生理学的、形態学的および遺伝的特性において、より人間に似ている、彼らの大きな脳は、脳脊髄液の収集、電気生理学とイメージングを容易にし、彼らはより複雑な行動テストを可能にし、より豊かな行動表現型を持っている[32]。3つのトランスジェニックラットモデルは、文献[24,90,95]でよく特徴付けられていると各モデルの特定のアルツハイマー病関連の神経病理学的特徴は、表1に概説されている。トランスジェニックラットはトランスジェニックマウスと同様の表現型と限界を持っている;複数の家族性アルツハイマー病変異の発現は病理学的発達を加速させる。APP発現の分布、範囲および局在は、使用されるプロモーターに依存する。すべてのモデルで、(トランスジェニックマウスよりも低いレベルではあるが)頑健なアミロイドプラークの発現を示し、興味深いことに、TgF344-アルツハイマー病ラットでは、ヒトのタウではなく、内因性のラットのタウのみを発現しているにもかかわらず、NFTs [24]を有していた。これは、内因性ラットタウの6つのアイソフォームが存在するという点で、ラットタウとヒトタウの間の類似性が高いためであろう。すべてのラットモデルはある程度の認知障害を有するが、その程度はMcGill-R-Thy1-APPラットでのみ広範囲に特徴づけられている[90]。まとめると、トランスジェニックラットはアルツハイマー病研究に有用な可能性があり、トランスジェニックマウスよりも特定の利点がある;しかしながら、これらのモデルの使用が比較的少ないことは、ADモデルとしての適合性を適切に決定するためには、より大きな特徴付けを行う必要があることを意味している。
生理モデル
トランスジェニックげっ歯類モデルの2つの主要な制限は、彼らがモデル家族性アルツハイマー病ではなく、散発性アルツハイマー病であり、これらのモデルにおける病理学的発達は、一般的に非生理学的であることである。彼らはより正確に散発性アルツハイマー病で発生する変化を表すであろうので、アルツハイマー病の自然発生モデルを見つけることは魅力的である。複数の種が自然にアルツハイマー病脳で見られるものと同様の神経病理学的特徴を開発し、散発性アルツハイマー病の自然発生モデルとしての可能性が検討されている。アルツハイマー病に類似した神経病理学的特徴を示す最も一般的に使用されている種は、以下で議論されている。
非ヒト霊長類
最もよく特徴付けられたアルツハイマー病神経病理学的特徴を持つ種は、非ヒト霊長類である。モデルアルツハイマー病に非ヒト霊長類を使用する利点は、ヒトへの生物学的近接性、行動の複雑さ、イメージング研究や脳脊髄液の収集とヒトアミロイドβと100%の配列相同性を有するアミロイドβの自然蓄積のために有利である大きな脳が含まれている[16,19,57]。彼らの長い寿命と研究研究研究のために偉大な類人猿を使用しての倫理的な懸念のため、偉大な類人猿(チンパンジー、ゴリラとオランウータン)のアルツハイマー病病理を特徴付けているアルツハイマー病研究は比較的少数であった。類人猿は脳内にアミロイドβを蓄積し、その結果、高齢動物ではアミロイド斑と脳アミロイド血管症が発生する [43, 44, 78, 112, 113, 124]。プラークは主にびまん性で、人間のアルツハイマー病に見られるものよりも少ない。典型的には、類人猿はプラークよりもフィブリルアミロイドβを含む可能性が高い脳アミロイド血管症がより一般的である。ヒトとヒトのタウの間には非常に高い配列相同性があるにもかかわらず(ヒトのタウとチンパンジーやゴリラのタウの間にはそれぞれ100%と99.5%の配列相同性があるタウ症はまれである。ゴリラでは、リン酸化されたタウを含む局所ニューロンやグリアが観察されているが、NFTやタウ陽性ジストロフィー性ニューライトは存在しない[112]。グレート類人猿はNFTを形成する能力がある[124]が、これは研究されたチンパンジー1頭でしか観察されていない稀な事象である。追加のアルツハイマー病関連危険因子(脳卒中、高コレステロール、肥満)の存在がこの症例でのNFT形成に寄与した可能性が高い。また、記憶障害は軽度であるように見える;ではなく、アルツハイマー病[57]で見られる広範な認知機能の低下よりも、典型的な加齢に関連したメモリの低下に似ているように見える。
より多くの研究は、旧世界のサル(例えば、アカゲザル、シノモルグスザル、ヒヒおよびバーベット)を使用して行われている。研究の大部分はアカゲザルを使用している。ここでも、ヒトとアカゲザルのアミロイドβの間には100%の配列相同性がある。アミロイドβレベルは加齢とともに蓄積し、大脳皮質ではヒトのアルツハイマー病で観察されるレベルと同様のレベルに達し、しばしばアミロイドβ40よりも多くのアミロイドβ42が存在する[126]。プラークは典型的には25歳以上のアカゲザルで発見され、それらはヒトで観察されたものと同様の分布をしている;海馬よりも皮質に多く存在している [54, 56, 96, 134, 146, 150, 164, 165]。類人猿とは対照的に、アカゲザルでは実質プラークの方が脳アミロイド血管症よりも有病率が高く、老齢化したアカゲザルの約3分の1に脳アミロイド血管症が存在している[164, 165]。プラークの大部分はびまん性であり、フィブリルアミロイドβを含むのは約20%にすぎない [134, 146]。コンパクトプラークの直後には軽度の神経細胞の喪失が観察されるが、プラーク負荷の高い脳領域でさえ、広範囲の神経細胞の喪失を示す証拠はない[146]。プラーク病理には動物間でかなりのばらつきがあることは注目に値する。アカゲザルにおけるプラークの存在を調査した2つの大規模な研究では、老齢動物(25-31歳)の約40%が自然死後にプラークまたは脳アミロイド血管症の証拠を認めなかったことが明らかになった[164, 165]。しかし、これはプラークが形成される前に死亡したことによるものである可能性がある。アカゲザルは、ヒトとアカゲザルのタウの間に高い配列相同性があるにもかかわらず、タウ症を持っていない。興味深いことに、高齢のヒヒは海馬で重いが高度に局在したタウ症を示し、これは年齢とともに増加し、26歳以上の動物の90%で観察されている[142]。大脳皮質などのプラークや脳アミロイド血管症を含む領域を含む他の脳領域ではNFTは観察されない。アミロイドβ沈着はヒヒでは軽度から中等度と考えられており、プラークともつれとの間には明らかな関係はない。また、限られた数の研究では、ヴァーヴェットにおけるアルツハイマー病関連の神経病理を検討している。ヴェルヴェットは、飼育下で約30年まで生きており、年齢とともにアミロイドβ沈着、グリオシスと神経ジストロフィーの証拠を持っている[72,88,89]。アミロイド沈着は約15歳で初めて観察され、実質プラークよりも先に血管系に最初に現れる。拡散性プラークとコンパクトプラークの両方が存在し、アミロイドβN3pEは新たに発達した脳アミロイド血管症とプラークに一般的なアミロイドβと約1:1の比率で存在する[39]。神経性プラークが観察され、いくつかはリン酸化タウ免疫反応性ジストロフィー性神経突起を有する[88]。NFTは存在しない。他の非ヒト霊長類と同様に、ヴェルヴェットにおける病理の存在には、動物間でかなりのばらつきがある。
新世界のサルはまた、自然にアルツハイマー病のそれに似た神経病理学を開発し、最もよく研究されているリスザルである。リスザルは、主に動脈や毛細血管の脳アミロイド血管症の形で、年齢の12年後に広範なアミロイドβ蓄積を持っている[22,36,167,168]。リスザルにおける脳アミロイド血管症の顕著性は、このモデルを、治療的アプローチが患者の合併症としてのARIAと関連しているかどうかの評価に特に適したものにしている[140, 141]。プラークも存在し、それはびまん性またはコンパクトなものであり、典型的にはヒトのアルツハイマー病におけるプラークよりも小さい。プラークおよび毛細血管脳アミロイド血管症はアミロイドβ40およびアミロイドβ42の両方を含むが、動脈脳アミロイド血管症は主にアミロイドβ40を含む。アミロイドβの沈着は、主に海馬ではほとんど沈着と大脳皮質と扁桃体で観察される。最近の質量分析法の研究により、リスザルはヒトの脳に存在するすべての主要なアミロイドβ種(アミロイドβ1-40,アミロイドβ1-42,アミロイドβ1-34,アミロイドβ4-40,アミロイドβ4-42,アミロイドβN3pE、酸化アミロイドβを含む)を持っていることが示された[125]。リスザルアミロイドβもまた、ヒトと同様のSDS安定な二量体および三量体を形成していたが、これらのオリゴマーはおそらくヒト種とは異なる三次構造または四次構造を有していた[125]。最小限のリン酸化タウは時折ニューロンで観察されるが、NFTは存在せず、高齢動物でも存在する[36]。
アルツハイマー病に関連する神経病理学はまた、また、アルツハイマー病の前臨床試験[70,161]を使用しているグレーマウスキツネザル、で特徴付けられている。これらのプロシミアンの最長寿命は、飼育下で18年である。プラークは8歳と若いグレイマウスキツネザルで観察されており、びまん性プラークとコンパクトプラークの両方が観察され、主に大脳皮質で観察される[11]。プラークは脳アミロイド血管症よりも多く観察され、プラークはアミロイドβ42が優勢であるのに対し、脳アミロイド血管症はアミロイドβ40とアミロイドβ42の両方から構成されている[98]。グレーマウスキツネザルは、加齢とともに増加する脳内リン酸化タウの蓄積を持っているが、これは大脳皮質で主に観察され、海馬では観察されない(アルツハイマー病の場合とは異なり)[12, 47, 83]。皮質萎縮は3歳以上の動物の亜集団で観察されており[31, 83]、これは加齢に伴う認知機能の低下と相関している[114]。
まとめると、霊長類以外の動物は典型的には年齢に関連したアミロイドβ病理を持っているが、タオパシーは稀であるか、あるいは非常に限られたものである。これまでの研究に基づいて、アカゲザルは、それが非常によく特徴づけられているので、アルツハイマー病を研究するための最も実用的な非ヒト霊長類モデルであり、リスザルは、脳アミロイド血管症を研究するための最高の利用可能な非ヒト霊長類モデルである。
その他の生理学的モデル
他の種は、自然に年齢とともにアルツハイマー病に関連する病理学を開発し、最もよく特徴付けられた例は、犬とモルモットの親戚オクトドンデグーである。老化した犬は、人間と同じアミロイドβ配列を持っており、彼らは年齢[137,143,148]の8-9歳で始まるプラークと脳アミロイド血管症を開発している。プラークは最初に前頭前野に、後に側頭皮質と後頭皮質に発生し、ヒトと似ているが同一ではないパターンをたどっている。しかし、これらのプラークは主にびまん性であるため、ヒトのアルツハイマー病のものとは異なり、したがってプラーク発達の初期段階を表している可能性がある。少数の高齢犬では、限られた数のコンパクトなプラークが認められる。アミロイドβN3pEはプラークの一部の集団に存在する。高齢犬に見られる他の神経病理学的特徴には、皮質萎縮、脳脊髄液 アミロイドβ42:40の比率の低下、アミロイドβオリゴマーの増加、および酸化的損傷およびミトコンドリア機能不全の存在が含まれる[16]。NFTは典型的には観察されない;しかしながら、プレタングルおよび可能性のあるNFTは、非常に限られた数の高齢で衰弱したイヌにおいて観察されている[137, 148]。さらに、衰弱したイヌのシナプトソームは、衰弱していないイヌに比べて総量およびリン酸化タウが増加しており、高齢のイヌの認知障害はシナプス障害に起因する可能性があることを示唆している[148]。イヌ特有の認知テストのバッテリーが開発されており、これは、高齢犬が複雑な学習タスク、実行機能、空間学習と注意力、および記憶の障害を開発することができることを示しており、認知機能の低下の程度は、いくつかの研究ではなく、すべてではないが、アミロイドβ沈着と相関している[30]。測定可能な認知機能の低下、アルツハイマー病に関連する神経病理学、および死亡前の病理学の3-4年の窓の組み合わせは、多くの前臨床治療研究で使用されている高齢犬に結果をもたらした[30]。しかし、限界は、NFTの欠如、コンパクトなプラークの欠如、長い寿命、およびすべての動物における一貫した病理学の欠如を含む。
オクトドンデグーは、ヒトアミロイドβと高い配列相同性を有する(アミノ酸置換が1個ある)。いくつかの研究では、オクトドンデグーは細胞内および細胞外のアミロイドβ蓄積、老年期のプラーク、細胞内タウ蓄積、アストロサイトーシス、シナプス変化、記憶障害を有し、オリゴマーレベルの増加と相関することが明らかにされている([16, 131]でレビューされている)。しかし、他の研究が高齢動物におけるアルツハイマー病関連病理を報告しているように、この病理は一貫性がないようである[149]。
まとめると、生理学的モデルは散発性アルツハイマー病の利用可能な最良のモデルである。しかし、これらのモデルの普及を妨げる科学的および実用的な限界がまだ存在する。例えば、最良のモデルは寿命が長く、病理は個々の動物間で変動する可能性があり、実験には費用と時間がかかり、前臨床試験のための動物の選択が困難な場合があることを意味する。さらに、認知試験は、標準化されておらず、実施が困難な場合がある。最後に、ヒトのタウとのより大きな配列相同性にもかかわらず、タウ症の証拠を持っている生理学的モデルは非常に少なく、アルツハイマー病に類似したNFTが広く存在するものはない。
細胞培養モデル
ヒト組織から得られた実験モデルを使用することで、種の違いによる交絡効果に関連する懸念を回避することができる。しかし、代表的な成体ヒト細胞を用いた実験モデルの作成に関連する主な制限の一つは、利用可能な質の高い死後組織が不足していることである。誘導多能性幹細胞(iPSC)の開発は、この限界に対処するものである [153]。iPSCは現在、線維芽細胞、血液細胞、尿由来の上皮細胞を含む複数のヒトドナー細胞タイプから生成されている。複数のグループが、家族性アルツハイマー病および散発性アルツハイマー病患者からのドナー細胞からのiPSC株を特徴づけており、それらは、年齢をマッチさせた非ドナー対照に由来するiPSCと比較して、アミロイドβ、特にアミロイドβ42の産生の増加、およびタウの過リン酸化を示す[66, 82, 101, 175]。いくつかのiPSC株はまた、GSK3βの活性化の増加[66]、大きなエンドソームの数の増加[66]、および脳内アミロイドβオリゴマーの蓄積[82]などの追加のアルツハイマー病関連病理の証拠を有する。
ヒト細胞培養モデルを使用することに関連する制限は、これらの細胞株を生成および維持するために使用される標準化されたプロトコルの欠如、ドナー細胞に存在するエピジェネティック修飾が再プログラミング後に維持される可能性、および患者間のばらつきに起因する個々のiPSC株に存在する表現型のばらつきが含まれている。もう一つの合併症は、これらの細胞株は、アルツハイマー病関連の表現型を開発するために老化させる必要があるかもしれないということであり、これは、分化したニューロンを使用している場合に達成するために技術的に困難である可能性がある。これらの制限のいくつかは、将来の研究でこれらの細胞株がより徹底的に特徴付けされるにつれて、おそらく克服されるであろう。
もう一つの懸念は、細胞培養モデルが正確に脳内で見られる複雑な環境を表現していないことである。これは、ニューロン間の複雑な相互作用や、アルツハイマー病の発達に非常に重要な役割を持つ可能性が高いニューロン以外の細胞タイプ(例:グリア)の存在を含む。この懸念は、部分的に3D細胞培養モデルの開発を通じて対処されている。これらは、3次元でのニューロンとグリアの間のより生理学的な相互作用を可能にする足場(ハイドロゲルやマトリゲルなど)の使用によって、または細胞が3Dオルガノイドとして発達する足場のないモデルによって製造することができる[23, 119]。最近、APPK670N/M671L/V717IおよびPS1ΔE9をマトリゲル足場にトランスフェクトしたヒト神経幹細胞の3次元培養を行うと、アミロイドβのプラークへの細胞外凝集、およびジストロフィー性神経突起および細胞ソーマにおけるタウの細胞内凝集が生じることが示された[23, 77]。プラークとタングルが試験管内試験で再現されたのはこれが初めてである。
これらの細胞培養モデルの大部分は家族性アルツハイマー病ドナー細胞から生成されていることに注意することが重要であり、家族性アルツハイマー病と散発性アルツハイマー病の間の異なる表現型を比較するためには、今後利用可能な散発性アルツハイマー病系統の数を増やす必要があるだろう。これは、これまでの研究で、特定の家族性アルツハイマー病変異が特定のiPSC表現型と関連していることが示されており、したがって、散発性アルツハイマー病 iPSCラインはさらに異なる可能性が高いため、重要である。
ADモデルとしてのショウジョウバエ、C.エレガンス、ゼブラフィッシュ
無脊椎動物モデル(ショウジョウバエ、C.エレガンスなど)と低次動物モデル(ゼブラフィッシュなど)もまた、いくつかのアルツハイマー病研究研究で使用されている。アルツハイマー病研究におけるそのような動物の使用は、これらの低次動物におけるはるかに単純化された遺伝子構成のために、ヒトとの遺伝的相同性の欠如によって制限されている。さらに、彼らの神経系と行動は、人間に見られる複雑さを欠いている、人間の病気との比較を非常に困難にしている。ショウジョウバエ、C.エレガンス、ゼブラフィッシュは、アルツハイマー病の病態に不可欠な遺伝子(APP、PSEN1,MAPT、BACE1など)のいくつかのオルソログを発現していることが確認されているが、これらのオルソログの存在とヒトの遺伝子との遺伝的類似性は種によって異なる。全体的に、アルツハイマー病に関心のある遺伝子における配列相同性は、無脊椎動物とヒトの間では最小限であり、これらの無脊椎動物のオルソログは、しばしばアルツハイマー病の病態生理に重要なこれらの遺伝子の領域を欠いている。最も顕著な例は、ショウジョウバエとC. Elegansにおけるアミロイドβの欠如である[1, 38]。したがって、無脊椎動物は、APP、アミロイドβおよび/またはタウのヒトトランスジェニック遺伝子を発現させるための遺伝子操作なしでは、アルツハイマー病のモデルとは考えられない。無脊椎動物を使用する主な利点の一つは、遺伝子操作の容易さであり、ヒトAPP、アミロイドβおよびタウを発現する複数のトランスジェニック系統が各種で開発されている[1, 38, 111]。無脊椎動物モデルを用いることの他の一般的な利点としては、取り扱いが容易であること、低コストであること、動物の寿命が短いことなどが挙げられる。これらの利点を考慮して、いくつかのグループがトランスジェニック無脊椎動物モデルをハイスループット遺伝学的または薬物スクリーニングに使用してきた。例えば、このアプローチはショウジョウバエをモデルにしたタウ毒性の修飾因子の同定に成功していることが証明されている[53]。しかし、このような研究から得られた結果は、ヒトと無脊椎動物との間には大きな違いがあり、最も重要なことは、保存された機能的経路がないことや、ヒトの発現遺伝子の下流応答に関与する重要な相互作用因子/媒介因子がないことであるため、注意して解釈し、より関連性の高い動物モデルを用いて確認する必要があることに留意しなければならない。
最適なモデルを選択する際に考慮すべき要因
アルツハイマー病の病理学の多くの利用可能なモデルがあり、それぞれが独自の利点と限界を持っている。利用可能なモデルのどれもがヒトの アルツハイマー病 のすべての機能を再現していないことを認めることは非常に重要であり、したがって、完全な疾患としての アルツハイマー病 の代表的なモデルであるとは考えられない。しかし、現在利用可能な動物モデルの使用は、選択したモデルと実験結果の解釈を確実にヒトのアルツハイマー病に変換することができることを保証するために、その本質的な限界について非常によく知っている限り、ヒトを使用して答えることができないアルツハイマー病の病態生理についての重要な質問に答えるための手段を提供することができる。アルツハイマー病で実験モデルを使用する際に考慮すべき最も重要な要素と考えられることは以下の通りである。
プラークとタングルの両方が存在するモデルは非常に少ない、特に生理的に発達するモデルである。プラークとタングルの両方の存在はアルツハイマー病の診断に必要であり、プラークとタングルの複雑な相互作用がアルツハイマー病の発症にどのように影響するのかは、まだ解明されていない。アミロイドβとタウの間のクロストークが毒性に有意な影響を与えうることは明らかである;アミロイドβ産生の増加は家族性アルツハイマー病およびダウン症におけるNFT形成をもたらし、一方でタウはアミロイドβ関連毒性(特にシナプトトキシン)を増加させることを示す証拠もあり、両方の病理学的特徴の存在がヒトのアルツハイマー病で起こる毒性を再現するために重要であることを示唆している[106]。したがって、プラークとタングルの両方に対する新しい治療法の効果を決定することは特に重要であり、理想的には両者を含むモデルにおいて、両者の間のクロストークの病理学的効果に対処できるようにすることが重要である。
アミロイドβおよびタウの非生理学的発現を有する動物モデルにおける下流の病理学的変化を解釈することは困難である。下流の病理学的変化は、APP、PS1またはタウの過剰発現、またはアミロイドβ以外の他のAPP切断産物(例えば、N-APP、APP C末端断片、AICD)に起因するアーチファクトである可能性があることを考慮しなければならない。これらの追加のAPP切断産物もまた、アミロイドβとは無関係に毒性を引き起こす可能性がある[45, 105]。さらに、APPの過剰発現は、トランスジェニックマウスを用いた研究に基づいて当初示唆されたようなアミロイドβへの下流反応ではなく、2つの著名なアルツハイマー病表現型の根本的な原因であることが最近示唆され、これがトランスジェニックマウスモデルで観察された下流のアルツハイマー病病理学の他の解釈された例にも当てはまるかどうかに疑問を投げかけている[130]。APPまたはタウの非生理的過剰発現の問題は、ヒト化されたマウス内在性タンパク質の生理的発現を有するノックインマウスモデルを使用することによって対処することができる。アミロイドβ以外のAPP切断産物の付加的な毒性効果は、技術的にはより困難であるが、ネズミの脳内でアミロイドβの特定のアイソフォームの発現を誘導するためのウイルスベクターの使用は有望であり、トランスジェニック動物モデルの使用を補完する可能性がある[33, 87, 120]。
また、齧歯類の内因性タンパク質やタンパク質経路は、特定のヒトタンパク質の非生理的発現に反応して異なる反応を示す可能性があり、そのような下流効果がヒトでも起こるとは考えられないことも考慮しなければならない。最も明白な例は、家族性アルツハイマー病変異を有するヒトPS1のみを発現させた動物モデルからの結果に由来する。ヒトではPS1の一部の変異が家族性アルツハイマー病の初期発症を引き起こすにもかかわらず、家族性アルツハイマー病変異を有するヒトPS1のみを発現させたトランスジェニックマウスではプラークの発症は見られず[138, 154]、ヒトPS1に対するマウス内在性タンパク質の応答がヒトとは異なることが示されている。さらに、アミロイドβを過剰発現させたマウスモデルでNFTが発生しないのは、マウスとヒトのタウの内因性の違いによるものである可能性が高い。この仮説を支持するエレガントな研究では、APP E693Δ-Tgモデルと野生型ヒトタウマウスを交配させると、内因性マウスタウを持つマウスでは決して発達しなかったNFTがロバストに形成されることが示された[163]。これらは、トランスジェニックマウスで発現させたヒトタンパク質の下流への影響が、内因性タンパク質の違いによりヒトで発生するものとは異なるという例の2つの例に過ぎず、下流の病理学的影響(またはその欠如)は慎重に解釈すべきであるという概念を裏付けるものである。
げっ歯類とヒトの間の内因性種差は、トランスジェニックげっ歯類におけるヒトアミロイドβの開裂および生化学に影響を与える。例えば、トランスジェニックマウスからのプラークコアは、ヒトADのものよりもはるかに可溶性であり、これはトランスジェニックマウスにおけるアミロイドβ翻訳後修飾(N末端分解、異性化、ラセミ化、ピログルアミル形成および酸化など)の欠如に起因することが示唆されている[37, 71, 85]。この増加した溶解性は、アミロイドクリアリング薬がヒトよりもトランスジェニックマウスにおいてはるかに優れた働きをすることに寄与する可能性があるので、これは考慮すべき重要な因子である。さらに、マウスのバックグラウンド株は、APPのC末端の切断に変化をもたらす可能性がある。例えば、C57BL6のバックグラウンドでヒトAPPを発現するトランスジェニックマウスでは、ヒトで最も顕著なCT99とCT83フラグメントの産生が非常に少なくなっている[37, 64]。興味深いことに、種の違いもまた、生理学的モデルにおけるアミロイドβの生化学と沈着に影響を与えているようである。生物学的にはヒトに最も近い存在であるにもかかわらず、非ヒト霊長類でさえもアミロイドβ生化学において重要な違いを示している。非ヒト霊長類は、共通の翻訳後修飾種の存在を含め、脳内のアミロイドβ種はヒトと同様であるが、アミロイドβはヒトとは異なる集合体を形成し、その結果、共通のアミロイドβ抗体に対する免疫反応性が変化し(配列の相同性にもかかわらずPIBの結合を阻害する可能性が示唆されている[125, 126]。
トランスジェニック動物モデルは家族性アルツハイマー病の部分モデルであり、散発性アルツハイマー病ではない。家族性アルツハイマー病と散発性アルツハイマー病の類似点と相違点を決定するためには、ヒトでのさらなる研究が必要である。現在のところ、アミロイドβとタウの蓄積の分布は家族性アルツハイマー病と散発性アルツハイマー病で異なり、家族性アルツハイマー病では皮質下領域に多く存在することが知られている[147]。また、家族性アルツハイマー病では大脳皮質下領域の灰白質萎縮が多く[20]、非定型認知症状は家族性アルツハイマー病の方が多い[147]。さらに、家族性アルツハイマー病と散発性アルツハイマー病の間の類似性にもかかわらず、2つのサブタイプのアルツハイマー病の根本的な原因は非常に異なっている;家族性アルツハイマー病はアミロイドβの過剰発現に直接起因し、散発性アルツハイマー病は脳からのアミロイドβのクリアランス不良に寄与する複数の因子に起因する可能性が高い。なぜなら、前臨床研究とヒトでの研究の間で翻訳が行われていないのは、家族性アルツハイマー病と散発性アルツハイマー病の間に内在する差異が原因である可能性があるためであり、前臨床研究で非常に優れた効果を示したこれらの治療薬は、家族性アルツハイマー病患者および/またはダウン症候群(DS)(APPが過剰発現している)の臨床試験でより良く翻訳される可能性があることを示唆しているからである[55]。もしそうであれば、散発性アルツハイマー病における新規治療薬の効果をより正確に検証できるように、散発性アルツハイマー病をより代表する新しいモデルを開発することが不可欠である。
遺伝学的研究により、散発性アルツハイマー病のリスクを高める複数の遺伝子座が同定されている。今後の研究では、これらの遺伝的危険因子がどのようにアルツハイマー病に関連する病態に寄与しているのか、また、これがこの疾患の動物モデルで再現されているかどうかを明らかにすることが重要になる。散発性アルツハイマー病に関連する最も強力に同定された遺伝的危険因子であるApoE4の役割を検討した研究では、これは種の違いにより、動物モデルにおいて最初に予想されたよりも複雑である可能性が示唆されている。トランスジェニックマウスの研究では、ApoEがフィブリル性アミロイドプラークおよび脳アミロイド血管症の形成に必要であることが確認されたが[4, 5, 41, 61]、マウスとヒトのApoEの間に重要な違いがあることも確認された。マウスApoEの発現はヒトApoEの発現よりも大きなプラーク形成をもたらし、マウスApoEは優先的に大脳皮質プラークの形成を促進し、ヒトApoEは脳アミロイド血管症の形成を促進した[59, 60, 94]。このことは、トランスジェニックマウスでヒトApoEの異なるアイソフォームを発現させると、apoE3やapoE2に比べてapoE4の発現がアミロイド沈着を促進し、プラークと脳アミロイド血管症の負担が異なるレベルになるという事実によって、さらに複雑になる。結局のところ、このことは、関心のある他のヒトトランスジェニック遺伝子(例えば、GWAS研究で同定された他の遺伝子座)も、アルツハイマー病で起こるタンパク質相互作用を再現するために、アルツハイマー病トランスジェニックモデルで共発現させなければならないかもしれないという懸念を提起している。これは、これらの相互作用を標的とする治療薬を試験する際に考慮することが特に重要である。後者は、apoEとアミロイドβの間の相互作用を標的とする治療アプローチの開発および前臨床試験において重要であった[110, 128, 176]。
ヒトにおけるアルツハイマー病の最も一般的な症状は認知障害である。大多数の動物モデルはある程度の認知障害を示しているが、この障害の種類と時期は、特に前臨床研究において慎重に考慮されなければならない。前述したように、トランスジェニックマウスやラットモデルでは、ヒトとは異なる病理学的発達の段階で認知機能障害が発生する。対照的に、初期の研究では、生理学的ノックインマウスモデルではプラーク発生から数ヶ月後に認知機能障害が発生することが示されており[129]、これはヒトとより類似している。このことは、トランスジェニック動物モデルにおける認知障害を媒介するプロセスが、ヒトにおける認知障害を媒介するプロセスと同じであるかどうかという問題を提起している。
結論
ヒトに最も近いものを含む複数の種における神経病理学と認知障害の慎重な検討は、アルツハイマー病がヒト特有の疾患であることを示している。アルツハイマー病をターゲットとした臨床試験での~99.6%の非常に悪い成功率は、トランスジェニックマウスで成功した病理学的減少のヒトへの翻訳が早かったことによって部分的に説明することができる[6, 27, 139]。したがって、可能な限りヒト組織を用いた研究を行うことがゴールドスタンダードであるべきである。動物モデルとヒト研究との間の一貫した翻訳の欠如は、よりヒトを中心としたアプローチの開発につながっている。これらのアプローチの多くはまだ開発中であり、完全に特徴付けされていないが、大きな可能性を提供している。例えば、臨床試験のための初期の薬物スクリーニングや患者の層別化は、ヒト細胞培養モデル(iPSCsなど)を用いて行うことができ、疾患の発症機序は、疾患中に変化したネットワークをゲノムまたはプロテオーム全体でスクリーニングすることができる「オミックス」アプローチを用いてよりよく調べることができ、神経イメージングアプローチの開発を拡大することで、ヒトにおける疾患の進行についての重要な情報を提供することができる。
動物モデルは、生体内で前臨床試験を行うオプションを提供し、新しい治療法の一般的な毒性の試験を可能にし、認知試験を行うことができるシステムを提供するという明らかな利点がある。新しいノックインマウスモデルは、より代表的なアルツハイマー病の生理学的モデルとなる可能性があるが、今後の研究でさらに検証する必要がある。非ヒト霊長類は、ヒトとの遺伝的類似性が高く、トランスジェニックモデルと比較して散発性アルツハイマー病に見られるものによく似た病理学的に関連した発達というユニークな利点を提供するが、研究は、入手可能性、コスト、表現型の発症までの時間、およびすべての動物における病理学的な一貫性のない存在によって制限されている。新しいヒト細胞培養モデルは、ヒト細胞を直接用いて新規治療薬のハイスループットなスクリーニングを可能にするという利点があるが、前臨床試験のための生体内試験モデルに代わるものではないことは明らかである。したがって、今後は、前臨床試験の結果をヒト臨床試験に反映させるために、より完全で生理学的な散発性アルツハイマー病の動物モデルが利用できるようになるまで、それぞれがアルツハイマー病の病態のユニークな側面を例示する複数の動物モデルで前臨床試験を行う必要がある。