Contents
Alzheimer’s disease as a systems network disorder: chronic stress/dyshomeostasis, innate immunity, and genetics
www.ncbi.nlm.nih.gov/pmc/articles/PMC7585078/
オンラインで公開2020年9月21日
Alexei Kurak(アレクセイ・クラーク) Dale E. Bredese(デール E. ブレデセン)
要旨
200以上の抗アルツハイマー病薬候補を対象とした臨床試験において、99.6%の離脱率で効果が得られなかったことは、現在のアルツハイマー病(AD)のパラダイムが不完全である可能性を示唆しており、代替的・補完的なフレームワークの探求が必要である。
我々は、仮説独立検索と専門家による異種データの統合のためのアルゴリズムを用いて、初期段階のアルツハイマー病患者のマルチモーダルな臨床プロファイルと蓄積された研究データを解析的な枠組みの中で調和させることを試みた。その結果、アルツハイマー病は脳の病気ではなく、進行性のシステムレベルのネットワーク障害であり、ネットワークの慢性的なストレスや不調和が原因であることが示唆された。
後者は、慢性炎症状態、感染症、血管障害、頭部外傷、環境毒性、免疫疾患など、さまざまな内因性および外因性の要因によって引き起こされる。慢性的なストレス、毒性、炎症は、脳に起因するものであれ、末梢に起因するものであれ、体液性および神経性の経路を介して中枢神経系に伝達され、神経系の高中心性の制御ノードや回路を優先的に標的とし、最終的には神経変性中枢神経系疾患として現れることになる。
本報告では、アルツハイマー病をシステムネットワークの障害としてとらえる視点を紹介するとともに、アルツハイマー病の病因・病態・生物学的研究において、慢性的な組織傷害・不恒常性、自然免疫反応、炎症が中心的な役割を果たしていることを示唆する生化学的・遺伝学的証拠を紹介する。
キーワード
アルツハイマー病、神経変性、複合慢性疾患、ネットワークバイオロジー、システムバイオロジー
はじめに
アルツハイマー病は、世界的な疫病となっており、過去10年間で急速に進行し、世界の死因の第5位、高所得国では死因の第3位となっている[1]。アルツハイマー病には治療法がなく、現在承認されているいくつかの薬は、わずかで一過性の症状改善しかもたらしない。
アルツハイマー病の神経病理学的特徴は、細胞外に沈着したアミロイドβ(Aβ)ペプチドと、細胞内に存在するリン酸化タンパク質であるタウからなる神経原線維のもつれである[2, 3]。アミロイドカスケード仮説は、何十年にもわたって、ADの研究および薬剤開発の努力を導く礎となるパラダイムであり、膨大な量の裏付けがなされている[4]。この仮説では、ADに至る一連の事象は、アミロイドβの過剰産生および蓄積に始まり、神経炎症、神経原線維タウのもつれの沈着、シナプスおよび神経細胞の機能障害および喪失の開始、そして最終的には明らかな脳萎縮に至るとしている[4, 5]。
残念ながら、アミロイドカスケードモデルのさまざまな重要な側面を標的とした200以上の薬剤候補が、ほぼ一様に臨床試験で効果を得ることができず、中には症状の悪化やその他の有害な結果をもたらしたものもあった[6-9]。臨床試験が一貫して不成功に終わったことで、アミロイドカスケード仮説に疑問が投げかけられ、ADの代替パラダイムの模索が始まった[10-13]。
アミロイドカスケード仮説に基づいて作成された知識やデータのほとんどを、簡潔で検証可能かつ予測可能な枠組みの中に自己矛盾なく収容しなければならないからである。蓄積された知識の膨大さと多様性,専門性と学際性の壁による研究の断片化,そして人間の記憶と情報処理の能力の限界を考慮すると,コンピュータを使って専門家が代替的な視点,仮説,パラダイムを生み出すのを支援する可能性を探ることは価値があるかもしれない[14-16]。これは,アルツハイマー病のような複雑な多因子疾患の場合,関連する情報が多数の独立した専門家の領域に分散しているため,特に重要である.
我々は、仮説に依存しない検索と専門家による情報の統合のためのアルゴリズムを用いて、初期段階のAD*患者のマルチモーダルな臨床プロファイルと蓄積された研究知識を、一般的な概念的枠組みの中で解析的に調和させることを試みた。
具体的には、ある患者のマルチモーダルな臨床プロファイル(生化学、遺伝学、画像診断、医療記録など)を、人間の専門家が使用して、その患者の疾患構成を特徴づける代表的な用語のセットを生成する。生成されたセットは、クエリ用語の密度が最も高い情報ブロック(タイトル、要旨、論文、データベースエントリ)を研究文献やデータベースで検索するためのクエリとして機能する。選択され、順位付けされた情報ブロックは、専門家によって分析され、検索用語のクリケットを相互に結びつける概念の解析的なセットが特定される。識別された概念は、次の反復処理で新規または追加のクエリ用語として使用され、より高いレベルのコネクタを識別し、すべての検索用語が解析的に相互接続されたネットワーク内に同化されるまで使用される。生成された疾患ネットワークを人間の専門家が分析することで,新たな仮説を立てることができる.検索は網羅的ではなく,仮説の生成は人間の専門知識や選択によってどうしても偏ってしまうが,生成された仮説の相対的な価値は,仮説の予測を経験的および/またはin silicoで検証することによって,その実用性の観点から評価される。
早期アルツハイマー病患者のマルチモーダルな臨床プロファイルと、蓄積された研究情報を調和させる試みの結果、アルツハイマー病は、従来想定されていたような均質な中枢神経系の疾患ではなく、慢性的なネットワークのストレスと不調和によって引き起こされる、不均質なシステムレベルのネットワーク障害である可能性が示唆された。ネットワーク障害は、多様な内因性、外因性の因子とその相互作用によって引き起こされるため、ADには複数の病因と進化の過程が存在し、それらはアルツハイマー病という共通の臨床病理学的エンドポイントに収束する可能性がある。
本報告では、アルツハイマー病の病因・病態に慢性的な組織傷害・不恒常性、自然免疫反応、炎症が中心的な役割を果たしていることを示唆する生化学的・遺伝学的証拠を紹介するとともに、アルツハイマー病をシステムレベルのネットワーク障害と捉える概念を紹介する。また、アルツハイマー病のシステム的性質の提案が、認知機能低下の治療や予防に与える影響についても簡単に説明する。
慢性炎症と中枢・末梢障害の相互関係
アルツハイマー病をはじめとする様々な慢性複合疾患には、慢性低炎症、代謝異常(多くの場合、糖尿病予備軍)内分泌異常、免疫恒常性障害が共通して見られる。ここ数年、これらの全身的な機能不全の原因を明らかにすることを目的とした研究により、中枢または末梢を問わず、慢性的な炎症が複合疾患における恒常性制御や生理学的システムの進行性の調節不全の原因と結果の両方になりうることが明らかになった[17-20]。
具体的には,中枢神経系の神経炎症は,インスリン抵抗性,高血糖,脂質異常症,メタボリックシンドローム,2型糖尿病(2型糖尿病),自己免疫疾患,心血管疾患,神経変性疾患などの代謝・内分泌・免疫系疾患やその後遺症の発症・進展に関連しているとされている[21-24]。脳毒性の薬理学的モデルでは,小胞体ストレスを誘発する化学物質であるタプシガルギンを脳室内に注射することで短期間の脳ストレスを与え,実験動物に耐糖能異常,全身および肝のインスリン抵抗性,血圧上昇を引き起こすのに十分であった。これらの全身的な変化は、交感神経緊張の上昇を伴い、交感神経抑制によって阻止されたことから、神経経路を介して作用することが示された[25]。Aβオリゴマーを脳室内に注入して脳に負荷をかけると,末梢での耐糖能異常やその他のインスリン抵抗性の特徴が引き起こされた[26].ADの主要な中枢神経系標的である海馬でインスリン抵抗性を誘導すると,グルコース不耐性などの代謝異常に加えて,不安や認知機能の低下など,予期せぬ全身的な影響が生じる[27]。マウスADモデル(3xTg-AD)の加齢動物は、重度の自己免疫/炎症性疾患を発症し、進行性の全身異常や行動・認知障害を伴うが、これらはβアミロイドやタウの顕著な神経病理に先立って現れる[28]。ヒトでは、高インスリン血症および高血糖の人は、血漿および脳内のβアミロイドレベルが上昇しており[29-31]、以前の研究では、アルツハイマー病患者の末梢血糖不耐症が明らかになっている[32]。現在では、アルツハイマー病と代謝異常との関連性がしっかりと確立されており、2型糖尿病の患者はADのリスクが高く、その逆もまた然りである[33]。
同時に、ここ数年、皮膚や胃腸の炎症、ウイルスや微生物の感染、有害物質への暴露、腸内細菌の異常、動脈硬化や肥満に関連する炎症など、多様な末梢免疫の課題が、中枢神経系における自然免疫の活性化を遠隔的に誘発し、それによって中枢神経系の神経炎症を促進したり、呼び水にしたりすることが、繰り返し証明されていた[12, 34-45]。中枢および末梢の炎症レベルは、早期のアルツハイマー病患者の臨床転帰と関連しており、疫学的研究では、炎症マーカーの上昇は、臨床症状が現れる数十年前から明らかになっている可能性があることが示唆されている[46, 47]。ADの危険因子に関連した慢性炎症および/または免疫反応の異常が、神経炎症およびADの神経病理に対する個人の感受性に影響を及ぼすメカニズムについては、最近レビューされている[48]。
全体として、慢性的な中枢神経系の神経炎症や障害が、慢性的な末梢の障害や炎症を引き起こす可能性があることを示す証拠が蓄積されている。同時に、慢性的な末梢の免疫課題や炎症は、中枢神経系のストレス、神経炎症、障害を引き起こしたり、その一因となったりする。中枢と末梢の異常が互いに強化し合う循環ループを形成する可能性があるように、中枢であれ末梢であれ、組織の恒常性を乱す持続的な要因が、中枢神経系および末梢における自然免疫の慢性的な活性化を開始し、永続させる可能性がある。そして、時間の経過とともに、恒常性制御の漸進的な不調、影響を受けた組織およびシステムの疲弊と機能不全、そして、私たちが複雑な慢性疾患として認識しているそれらの多様な後遺症につながる。
アルツハイマー病における慢性ストレス応答と組織障害・恒常性障害
急性期反応(Acute Phase Response: APR)とは、ストレスや課題に対する生体の中心的な反応である。通常、組織の損傷、感染症、ストレス、新生物、炎症などの際に活性化される。歴史的には、病原体による急性炎症に関連していたが、APRの症状は慢性炎症性疾患にも見られる[49-53]。
早期アルツハイマー病患者のマルチモーダルプロファイルは、低亜鉛血症、低赤血球血症、高ナトリウム血症、コルチゾールの上昇、甲状腺ホルモン(T3)値の低下、補体(C3,C4)の上昇、ステロイドホルモンの低下、インスリン抵抗性、高血糖傾向、負の窒素バランス、筋肉量の減少、さらには抑うつ、不安、無気力など、古典的なAPRプロファイルと多くの顕著な類似点を示している[52, 54-56]。
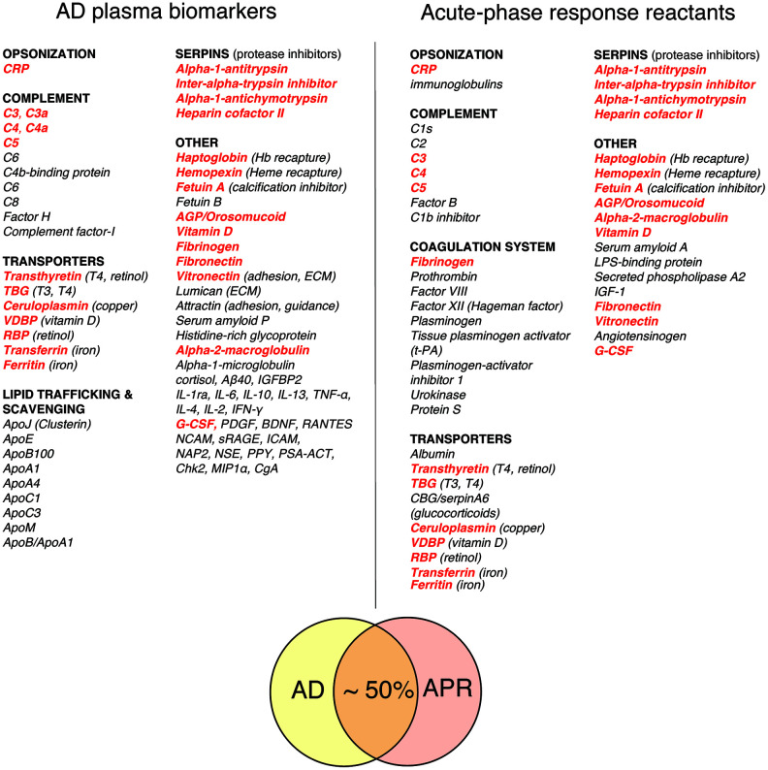
図1は、ストレス反応の急性期に肝臓から全身に分泌される古典的な急性期反応物質(APRR)の代表的なリストと、バイオマーカー探索研究から得られた有望なAD血漿バイオマーカーの代表的なリストを比較したものである[49, 52, 53, 57-63]。APRRとADのバイオマーカーの重なりは、控えめに見積もっても約50%である。さらに、全身性APRRのリストに載っていないAD血漿バイオマーカーを詳しく調べてみると、ほぼすべてのバイオマーカーが、全身性APRRに関連する因子か、局所的なストレス応答の産物であることがわかった。後者の分子群には、様々なスカベンジャー、トランスポーター、シャペロン、接着・誘導因子、サイトカイン、ケモカイン、成長因子、補体成分、細胞外マトリックス(ECM)の要素などが含まれる。これらの因子は、組織のストレス、損傷、炎症、感染などに反応して、活性化された常在細胞やリクルートされた細胞、周囲の組織によって損傷部位で産生、分泌される。局所的に分泌されたストレス因子は、炎症反応の促進と解決、血管や組織の伝染性の促進、ECMの解体・再構築・修復、漏出物質の回収、創傷整理・組織修復・再増殖プロセスの支援など、さまざまな機能を発揮する。慢性炎症反応症候群(CIRS)や多くのアルツハイマー病患者で特徴的に上昇する血漿バイオマーカーであるC4a、TGF-β1,MMP-9は、損傷や炎症を受けた領域で産生されるストレス因子の一例である[54, 64-67]。
図1 ADの血漿バイオマーカーと古典的な急性期反応の反応物質の比較
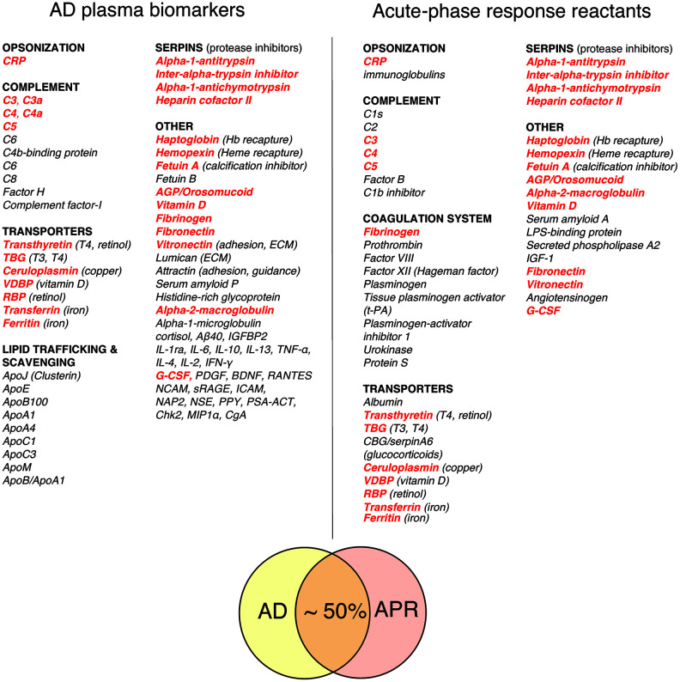
共通する因子は太い赤で強調されている。古典的な急性期反応物質ではないADバイオマーカーのほとんどは、APR関連タンパク質、あるいは局所的に産生されるストレスおよび/またはシグナル伝達因子のいずれかを表している(本文中の考察を参照)。略語は以下の通り。CRP (C-reactive protein); TBG (thyroxine-binding globulin); CBG (corticosteroid-binding globulin, 別名transcortin, serpin A6); VDBP (vitamin D-binding protein); RBP (retinol-binding protein); AGP (alpha-1-acid glycoprotein, 別名orosomucoid); IGP (alpha-1-acid glycoprotein, 別名olosomucoid) オロソムコイド);IGF-1(インスリン様成長因子1);G-脳脊髄液(顆粒球コロニー刺激因子);Aβ40(アミロイドベータ1-40);IGFBP2(インスリン様成長因子結合タンパク質2);IL-1ra(インターロイキン1受容体拮抗薬。IL-6,IL-10,IL-13,IL-4,IL-2(それぞれ、インターロイキン6,10,13,4,2)TNF-α(腫瘍壊死因子α)IFN-γ(インターフェロンガンマ)PDGF(血小板由来成長因子)BDNF(脳由来向神経性因子)RANTES(regulated on activation normal T cell expressed and secreced、a. k.a. CCL5(chemokine (C-C motif) ligand 5);NCAM(neural cell adhesion molecule);sRAGE(soluble receptor for advanced glycation end-products);ICAM(intercellular adhesion molecule);NAP2(nucleosome assembly protein 2);NSE(neuron-specific enolase);PPY(pancreatic polypeptide)。PSA-ACT(前立腺特異抗原-α-1-チモトリプシン複合体);Chk2(セリン/スレオニン-プロテインキナーゼChk2);MIP1α(マクロファージ抑制タンパク質1α)。CgA(クロモグラニンA);ApoJ(クラスターリン)ApoE、ApoB100,ApoA1,ApoA4,ApoC1,ApoC3,ApoM、ApoB(アポリポタンパク質J、E、B100,A1,A4,C1,C3,M、対応)。まとめの参考文献:急性期反応反応物[49, 52, 53, 57, 58]、AD血漿バイオマーカー[59-63]。
古典的なAPRRとADの血漿バイオマーカーを比較分析することで、ADに関連した組織の損傷や炎症の性質や標的について貴重な知見が得られる可能性がある。この点に関して、図1に示したリストの中で最も明らかな違いは、ADの血漿バイオマーカーの中に多数のアポリポタンパク質と局所的に産生されるストレス因子が含まれていることであり、これらは全身性のAPRRのリストにはほとんど含まれていない。
正常時も疾患時も、アポリポタンパク質は、脂質、コレステロール、親油性の廃棄物や毒素を含む親油性の種を、細胞から生体全体まで、組織階層の複数のレベルで、輸出、輸入、輸送、再分配を仲介している[68-70]。これに対応して,アポリポタンパク質は,親油性物質のスカベンジャーとして,細胞表面の受容体のリガンドとして,また,血液やその他の体液中で親油性物質を輸送するリポタンパク粒子の必須構造成分として機能している。
ADの有望なバイオマーカーにアポリポタンパク質が多く含まれていることは、組織の慢性的な損傷、酸化ストレスや脂質膜の損傷、コレステロールや脂質の代謝や輸送の異常、積極的な解毒、脂質やコレステロールの過剰な生産や輸送に関連した組織に依存しない細胞の表現型や代謝様式への移行などを示していると考えられる。ADのバイオマーカーにアポリポタンパク質が多く含まれていることは、早期のアルツハイマー病患者の典型的な脂質プロファイルとよく一致している。これらの患者は、高レベルの総コレステロール、低密度リポタンパク質コレステロール(LDL-C)まれに高密度リポタンパク質コレステロール(HDL-C)を含む脂質異常症や高コレステロール血症の兆候を示すことが多い(図示せず)。
以上のことから、アルツハイマー病患者の生化学的プロファイルは、症例ごとに分析した場合(臨床データ)と、患者集団を平均化して分析した場合(バイオマーカー探索研究)のいずれであっても、慢性的な組織損傷/不均一性と、進行中の局所的および/または全身的なストレス反応が、多くのアルツハイマー病患者に共通する特徴であることが示唆される。多くのアルツハイマー病患者において、局所的に産生されるストレス因子の定常的な血漿レベルが慢性的に、そしてしばしば大幅に上昇していることから、これらの患者における慢性的な組織損傷/不整脈や炎症は、肺、腸、血管系、リンパ系などの比較的大きな表面積に影響を与えていると考えるのが妥当である。
アルツハイマー型認知症の遺伝
アルツハイマー病は、遺伝的要素の強い多因子性の神経変性疾患であり、遺伝率も高い。長年の研究の結果、アルツハイマー病に関連する複数の非常に多様な遺伝的危険因子が同定されてきた[71-73]。しかし、アルツハイマー病のアミロイドカスケード仮説の観点から、発見された関連性を合理化しようとする試みは、これまでのところ、遺伝的なAD感受性因子を一般的で自己矛盾のない枠組みで統一するには至っていない。多くの著者は、意外にも多くのAD関連多型が自然免疫の機能を持つタンパク質に生じていることを指摘しているが、そのような関連性は、典型的には、不適切な中枢神経系神経炎症とβアミロイドの生成および/またはクリアランスの観点から解釈されている[73-76]。我々は、ADが脳のみの疾患であるという仮定を緩和することにより、遺伝的AD感受性因子の大部分は、慢性的な組織損傷/不均一性、自然免疫反応、炎症、進行中の創傷クリアランスと組織修復などの用語を介して解析的に統合できることを提案する。
図2 アルツハイマー病に関連する遺伝子多型のネットワーク
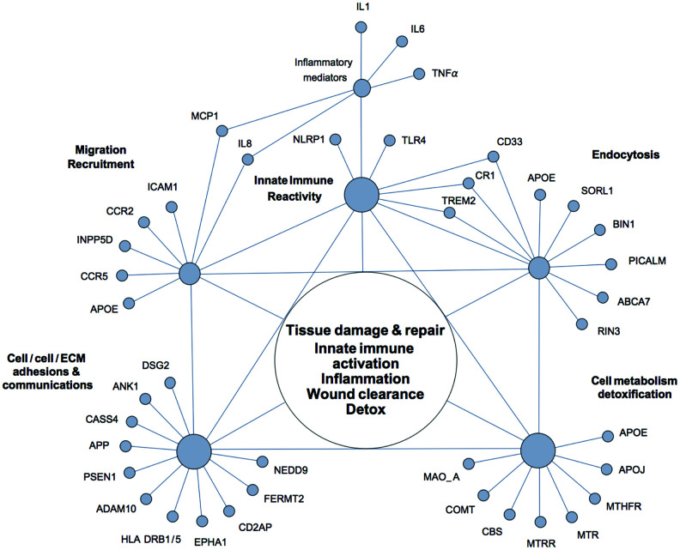
アルツハイマー病に関連する遺伝子多型の多くは、大まかには少数の重複する機能グループに割り当てられ、組織の損傷と修復、自然免疫の活性化、炎症、創傷クリアランス、解毒などの用語を介して相互に関連しており、これらのプロセスが中枢神経系で起こるか、周辺部で起こるかは特定されない。
実際、AD感受性因子のほとんどは、条件付きで少数の重複する機能グループに割り当てることができる。
最も大きなグループは、自然免疫反応や炎症反応の制御に関与するタンパク質で構成されている。ADのリスクは、NLRP1(NACHT, LRR and PYD domains-containing protein 1)やTLR4(toll-like receptor 4)などの自然免疫の重要なセンサーや、十数種類の免疫メディエーターの遺伝子多型と関連している。その中には、炎症性サイトカインであるIL-1,TNF-α、IL-6,接着分子であるICAM-1,ケモカインであるIL-8,MCP-1,ケモカイン受容体であるCCR2,CCR5などが含まれている[75, 77]。大規模なゲノムワイド関連解析(GWAS)で同定されたAD感受性因子の多くは,自然免疫や炎症反応においても機能している[74, 78]。CD33 (Siglec-3) (骨髄系細胞表面の受容体)、TREM2 (Triggering receptor expressed on myeloid cells 2)、MS4A6AおよびMS4A4AE (membrane-spanning proteins expressed on myeloid cells)、CR1 (Complement receptor 1)、INPP5D (SHIP-1) (phosphatidylinositol (PtdIns) phosphatase)などが挙げられる。ApoE4(アポリポ蛋白質Eε4アリル)SORL1(ソルティリン関連受容体L)ABCA7(ATP結合カセットサブファミリーAメンバー7)PICALM(ホスファチジルイノシトール結合クラスリンアセンブリー蛋白質)BIN1(ブリッジングインテグレーター蛋白質1)RIN3(Ras and Rab interactor 3)などがある。これらのタンパク質の機能説明や疾患との関連性については、付録の表1やその他の文献に記載されている[71-73]。
表1 特定のAD感受性因子のクイックリファレンスガイド
| 名前 | 主な機能 | 表現 | 疾病協会 |
| 自然免疫反応性と炎症反応 | |||
| NLRP1 | 細胞内PAMPおよびDAMPのセンサー。NLRP1インフラマソームのセンサーコンポーネント。微生物産物、粒子状物質、結晶(コレステロールや尿酸の結晶など)、シリカ、アスベスト、Aβ、プリオン、変異体SOD1などに反応して炎症を引き起こします。 | 広い; 免疫細胞や上皮細胞が豊富 | AD、慢性末梢炎症性および自己免疫疾患 |
| TLR4 | 細胞外PAMPおよびDAMPの主要なセンサー。LPS、ウイルス、細菌、oxLDL、飽和脂肪酸、熱ショックタンパク質、Aβ、フィブロネクチン、フェチュイン-A、およびβ-ディフェンシンを含むさまざまなリガンドの認識時に炎症を引き起こします | 主に骨髄起源の細胞で | AD、黄斑変性症、クローン病、潰瘍性大腸炎、扁桃炎、感染症 |
| CD33 | シアル酸SAMPの受容体(自己関連分子パターン); 細胞間相互作用、エンドサイトーシスで機能します。同族のSAMPと結合すると、免疫細胞の活性化を抑制します | 主に自然免疫細胞で | 広告 |
| TREM2 | 細胞表面受容体; 自然免疫細胞の炎症反応の開始と抑制に関与します。食作用における機能 | 広い; 脳、肺、脂肪組織で増強 | AD、COPD、GI損傷、感染症、那須ハコラ病 |
| CR1 | 細胞表面免疫付着受容体(補体系); 補体因子、例えば、C1q、C3b、およびC4bによってオプソニン化された細胞、破片、および病原体の食作用 | 赤血球、単球、白血球、好中球ですが、脳細胞にはありません | AD、慢性末梢炎症性および自己免疫疾患、感染症 |
| INPP5D | ホスファチジルイノシトールホスファターゼ; 細胞表面受容体のシグナル伝達に関与します。走化性、活性化、恒常性、食作用など、免疫細胞の複数の機能を調節します | 免疫細胞、骨髄、リンパ組織が多い | 広告 |
| RIN3 | RasエフェクターおよびRab5に向けられたグアニンヌクレオチド交換因子。細胞シグナル伝達; エンドサイトーシス、移動、シナプス機能、免疫応答 | 広い; マスト細胞が豊富 | AD、パジェット病 |
| PICALM | ホスファチジルイノシトール結合クラスリン集合タンパク質; エンドサイトーシス | ブロード | AD、急性白血病 |
| 細胞間および細胞マトリックスの接着とコミュニケーション | |||
| DSG2 | 細胞間結合の不可欠な成分であるデスモソームカドヘリン。機能的な細胞間接着を仲介します。プラークタンパク質と細胞骨格をリンクします。EMTとバリア機能を調整します | 上皮細胞、心筋細胞、癌が多い | AD、不整脈源性右室異形成症、癌 |
| ANK-1 | アンキリンは、膜タンパク質と接着分子を細胞骨格に結び付けます。細胞を組織に統合し、細胞の運動性、活性化、増殖、EMTの調節に関与 | 赤血球、骨髄、リンパ組織、脳 | AD、球状赤血球症、遺伝性溶血性貧血 |
| NEDD9 | 細胞接着、細胞付着、遊走、浸潤の機能を備えたCasタンパク質ファミリーの足場。EMTを規制します。複数の癌における転移マーカー | ブロード | AD、癌、ヘモクロマトーシス |
| CASS4 | タンパク質のCasファミリーの足場。フォーカルアドヒージョンにおけるフォーカルアドヒージョンキナーゼの調節を介した細胞接着、遊走、および運動性における機能 | 肺、脾臓、白血球に豊富に含まれています | AD、アトピー性喘息、嚢胞性線維症、肺がん |
| CD2AP | 細胞骨格への細胞表面受容体の付着を仲介する足場分子。接着結合とEMTの形成に機能します。接着結合の制御を介して、BBBを含むバリアの完全性と透過性の維持に関与 | 広い; 脳が少ない; 腎臓、内皮細胞、上皮細胞が多い | AD、腎疾患 |
| FERMT2 | フォーカルアドヒージョンタンパク質のフェルミチンファミリーのメンバー。インテグリンの活性化、インテグリンのシグナル伝達、および細胞接着に関与します。接着結合で機能し、創傷治癒、組織修復、血管新生において役割を果たします。EMTと浸潤を促進する癌で過剰発現 | 広い; 内皮細胞が多い | AD、癌 |
| EPHA1 | 接触依存性の双方向の細胞間通信を媒介する細胞表面エフリン受容体ファミリーのメンバー。Eph受容体は、発達中および損傷中の組織の形成に関与し、成熟組織の機能と恒常性をサポートします。傷害および炎症の部位でアップレギュレートされます。内皮、血液脳関門、腸関門の透過性、EMT、神経発達、可塑性、再生の制御に関与します。癌腫で過剰発現 | ブロード | AD、癌、慢性炎症性疾患 |
| APP | 軸索ガイダンス、ニューロン癒着、およびシナプス形成において機能する細胞表面受容体。ECM成分(ヘパリンおよびコラーゲン)への結合を介して神経突起伸長を調節します。EMTを制御する保存されたYAPおよびTAZ転写因子を介して核へのシグナル | 脳は中程度、GIおよびその他の上皮は低い | AD、癌 |
| ADAM10 | 膜貫通タンパク質の細胞外ドメインを切断および脱落させる幅広い特異性の膜メタロプロテアーゼ。APPプロセッシングにおける重要なαプロテアーゼ。細胞間接着、遊走、コミュニケーションを調節します。EMTで機能する可能性があります。基質:ノッチ、APP、N- / E-カドヘリン、クロトー、VEGF、TNF-αおよびIL6受容体、エフリン、および他の多くの分子 | 広く、ほとんどの免疫細胞で広く | AD、乳がん |
| プレセニリン1 | 内在性膜タンパク質の膜内切断を触媒するγ-セクレターゼ複合体の重要な成分。細胞接着、運命、移動、神経突起伸長、シナプス形成の調節に関与します。基質:ノッチ、APP、DSG2、N- / E-カドヘリン、SORL1、LRP1、クロトー、HLA; VEGF、IL1およびIL6受容体、エフリン、インスリン受容体、および他の多くの分子 | 大脳皮質、甲状腺、呼吸器系、消化器系が広く、高い | AD、FTD、ピック病、心筋症、癌 |
| 細胞代謝と解毒 | |||
| MTHFR、MTR、MTRR、CBS | 基本的な細胞代謝の中心的なハブである葉酸依存性一炭素代謝(OCM)の酵素。OCMは、タンパク質、脂質、核酸、および神経伝達物質の生合成に利用される多種多様な代謝経路と反応をサポートします。OCMは、組織および細胞の修復、細胞増殖、DNA修復、解毒、および抗酸化防御に不可欠です。 | MTHFR、MTR、MTRR-幅広い; CBS-主に肝臓、肝細胞、およびCNS | AD、および神経学的、精神医学的代謝、心血管、免疫および血液学的障害; ホモシスチン尿症、癌 |
| ApoE | 脂質代謝、および細胞と組織内、特に脳内の脂質とコレステロールの輸送と再分布において最もよく知られている役割を持つ多機能アポリポタンパク質。怪我の際に分泌されるストレス要因(シャペロン/スカベンジャー)として機能します。Aβシャペロン | 脳、肝臓、副腎が高く、他の場所では低から中程度 | AD、FTD、ピック病、TBI、アテローム性動脈硬化症、冠状動脈性心臓病、感染症 |
| ApoJ | 小さな熱ショックタンパク質ファミリーのメンバー。一般的なストレス要因(シャペロン/スカベンジャー); 細胞のストレス/損傷によりアップレギュレートおよび分泌されます。脂質代謝/輸送、細胞接着、アポトーシスで機能します。ApoJとApoEは、脳からのAβクリアランスの主要なシャペロンです。 | ブロード | AD、HD、アテローム性動脈硬化症、癌、心臓血管および代謝障害 |
| ABCA7 | ATP結合カセットトランスポーター; 脂質輸送とホメオスタシス(主に免疫細胞)、およびマクロファージを介した食作用で機能します | 白血球、骨髄、胸腺、脾臓が多い | 広告 |
| SORL1 | 多機能のエンドサイトーシス、輸送、および選別受容体。リポタンパク質とプロテアーゼの取り込みを仲介します。APPのトラフィッキングとソートに関与 | 脳内で高く、他の場所では低から中程度 | AD、血管疾患 |
| COMT | メチラーゼ; 分解とクリアランスのために反応性カテコール化合物を標的とします;基質:エピネフリン、ノルエピネフリン、カテコール-エストロゲン、薬物、他の化合物 | ブロード | AD、認知障害、行動および精神障害 |
| MAO-A | モノアミンオキシダーゼ; モノアミンの酸化的脱アミノ化; 基質:セロトニン、メラトニン、ドーパミン、エピネフリン、ノルエピネフリン、その他の化合物 | ブロード | AD、神経障害および精神障害 |
詳細、参考文献、略語、および追加の危険因子については、付録、図2,および本文の考察
最近のAD感受性因子のパスウェイ解析では、APOE、INPP5D、TREM2,ABCA7,CR1,PICALM、BIN1が、免疫反応、食細胞や骨髄細胞の移動、細胞外物質の取り込みという3つの機能カテゴリー、すなわち、組織の恒常性、創傷の除去、組織の修復を媒介する基本的な自然免疫プロセスに共同で関与していることが示されていることは注目に値する[73]。
AD感受性因子のもう一つの主要なグループには、細胞外環境と細胞内のコミュニケーションを媒介する、細胞と細胞、細胞とマトリックスの接触や接着に機能するタンパク質が含まれる。このグループのほとんどのタンパク質は、細胞の静止状態と活性化状態の間の可逆的な移行や表現型に大きな役割を果たしている。例えば、EMT(上皮から間葉への移行)とその反対のMET(間葉から上皮への移行) [79, 80]、内皮間葉移行(EndMT) [81]、伝染性バリアの緩みと締め付け、免疫細胞の活性化と非活性化などが挙げられる。
組織化された組織では、組織の損傷や恒常性の乱れなどにより、細胞と細胞、細胞とECMの結合が破壊されたり緩んだりすると、細胞が活性化され、部分的に脱分化した、運動性の高い、エンドサイトーシス性の高い、分泌促進型の細胞表現型に移行し、組織やアンカーに依存しない活動、生存、増殖・拡大が可能となる。逆のプロセスでは、細胞と細胞、細胞とECMの安定した結合が(再)確立され、細胞の活性化や独立した細胞活動が阻害され、静止状態、組織依存性、高分化の細胞表現型がもたらされる。細胞の活性化と個性的な表現型への移行は、細胞代謝が酸化的リン酸化から、効率は悪いが柔軟性の高い(糖鎖)溶解モードへと段階的に切り替わることを特徴としており、これらは細胞の増殖、移動、拡大に関連している。細胞間の連結性や固定性が回復し、組織化された多細胞集合体、ネットワーク、組織が形成されると、(糖鎖)溶解性代謝から酸化的リン酸化への逆のシフトが起こる[80-83]。
このグループに属するAD感受性因子の例としては、DSG2 (Desmoglein-2), ANK-1 (Ankyrin-1), NEDD9 (Neural Precursor cell expressed Developmentally Downregulated 9), CASS4 (Cas scaffolding protein family member 4), PTK2B (Protein-tyrosine kinase 2-β / Focal adhesion kinase 2), CD2AP (CD2-associated protein), FERMT2(フェルミチンファミリーホモログ2)APP(アミロイド前駆体タンパク質)PSEN1(プレセニリン-1)ADAM10(a disintegrin and metalloproteinase 10)EPHA1(エフーリンタイプA受容体1)TREM1,TREM2,CD33,HLA-DRB1/HLA-DRB5(主要組織適合性複合体クラスII、DRβ1/5)(機能説明は付録および表1を参照)などがある。
注目すべきは、このグループのタンパク質の多くが上皮細胞、内皮細胞、免疫細胞で豊富に発現し、重要な機能を持っていることである。いくつかのタンパク質(DSG2,CD2AP、EPHA-1など)は、伝染性バリアーの制御に関与している。
慢性的な炎症と、組織に依存しない個別の細胞表現型と(糖鎖)溶解代謝への移行は、癌の特徴である。おそらく偶然ではないと思うが、このグループに含まれる多くのAD感受性因子(例えば、NEDD9,CASS4,PTK2B)は、がんのシグナル伝達タンパク質である[84]。例えば、NEDD9(a.k.a. CASS2)は、複数の癌において、EMTの正の調節因子であり、転移マーカーである[85]。
遺伝的ADリスク因子の第3のグループは、細胞や組織の増殖、維持、修復、さらには解毒や抗酸化防御に重要な代謝経路に機能するタンパク質から構成されている。例えば、
- MTHFR(メチレンテトラヒドロフォレート還元酵素)MTR(5-メチルテトラヒドロフォレート-ホモシステインメチルトランスフェラーゼ、別名:メチオニン合成酵素)MTRR(5-メチルテトラヒドロフォレート-ホモシステインメチルトランスフェラーゼ還元酵素、別名:メチオニン合成酵素還元酵素)などの一酸化炭素代謝の主要な酵素。メチオニン合成酵素還元酵素)CBS(シスタチオニンβ合成酵素)
- 脂質の輸送と代謝に関わるタンパク質(ApoE、ApoJ、ABCA7,SORL1)
- 反応性のカテコール化合物やアミン化合物を異化するCOMT(カテコール-O-メチル基転移酵素)やMAO-A(モノアミン酸化酵素A)などの解毒酵素がある。これらのタンパク質についての簡単な説明は、付録と表1に記載されている。
以上のように、アルツハイマー病の遺伝的危険因子は、アルツハイマー病が単独で、あるいは大部分が脳の病気であることを示唆するものではない。むしろ、アルツハイマー病の遺伝は、自然免疫反応、細胞と細胞、細胞とマトリックスの結合やコミュニケーション、ハウスキーピング代謝、すなわち、中枢神経系であれ、周辺部であれ、多細胞の組織構造や組織の恒常性を維持するために不可欠なプロセスやシステムを中心に据えていると考えられる。さらに、遺伝学的には、ADリスクは、自然免疫反応性や細胞結合の柔軟性の向上と関連していると考えられている。これらの特性は、多様で変化に富んだ急性傷害を伴う不安定な環境で生活する若年者にとって有利なものである。しかし、自然免疫反応の亢進や細胞結合の柔軟性は、慢性的な組織ストレスや不恒常性、解決しない炎症、加齢などの条件下では有害となり、誇張された組織損傷、細胞ネットワークの漸進的な切断、免疫調節不全、神経変性疾患を含む多様な慢性複合疾患に伴う低レベルの炎症などを引き起こす可能性がある[17, 86]。AD関連多型によって優先的に影響を受ける細胞タイプおよびシステムに関しては、自然免疫が明らかなリーダーとして浮上し、これに上皮細胞、内皮細胞、神経細胞、およびそれらの組織化された集合体である上皮・内皮バリアーや神経ネットワークが僅差で続いている。
全体として、ADの血漿中バイオマーカーと遺伝学的研究は、互いに顕著な一致を見せており、ADの病因・病態・生物学において、慢性的な組織傷害・不恒常性、自然免疫反応、炎症が中心的な役割を果たしていることを示唆している。しかし、慢性的な組織のストレスや不調を引き起こす要因や状態は、周辺部であれ中枢神経系であれ、多様である可能性があるため、集団平均的なデータは、個々の患者の認知機能低下を引き起こす遺伝子-環境相互作用やメカニズムの多様性を覆い隠してしまう可能性があり、診断と治療の両方において個別のアプローチが必要となる。
実際、初期のアルツハイマー病患者の代謝プロファイリングを個人ベースで行うことで、患者をいくつかのサブタイプに分類することができ、サブタイプに合わせた治療法に反応することができる[54, 55, 64]。同様に、ADの遺伝子プロファイルを1人ごとに分析したところ、個々の遺伝的素因は、ランダムな組み合わせではなく、特定の組み合わせで生じる傾向があることが示唆された(未発表)。後者の点は重要かもしれない。というのも、AD関連遺伝子多型の多くは一般的なものであり、APOE4やTREM2のような少数の例外を除いて、典型的なオッズ比は1.1から 1.5の間で、ADリスクへの寄与はわずかなものである。しかし、同じ経路や機能的に相互に関連するプロセスに影響を及ぼす複数の多型が相乗的に作用すると、個人の構成要素に「弱点」が生じ、疾患リスクが何倍にも増加する。ある人の遺伝子の「弱点」が、環境因子や感染症、病気などによって慢性的に侵されている場合、その人にとっては大きな違いであっても、同じ環境を共有していても、関連性のない多型を持つ他の人にとってはほとんど関係ないことがある。
視点の転換:臓器からシステムへ
従来のADの発症モデルは、βアミロイド症に始まり、神経炎症、タウオパシーを経て発症するというものであった。しかし、βアミロイドーシスを標的とした複数の薬剤候補は、一様に臨床試験で効果を得ることができず、中にはβアミロイド負荷の減少が確認されたものの、有害な結果をもたらしたものもあった。ミクログリア活性化の阻害剤を用いて神経炎症を標的にしても、成功しなかった[6-9]。これらの予想外の結果を説明する1つの可能性として、βアミロイド症と神経炎症は、様々な慢性的な脳の障害に対する脳組織の解決されない保護反応の結果であり、その原因は中枢および末梢の様々なものが考えられる。
実際、アルツハイマー病のアミロイド前駆体タンパク質(APP)遺伝子の発現は、急性期反応や炎症性サイトカインによって制御されており、APPとその代謝物であるAβのレベルは、化学物質や外傷、感染症、揮発性毒素や大気汚染への暴露後に急速に増加する[12, 87, 88]。これらの観察結果は、近年発見されたAβの保護特性(強力な抗菌・抗ウイルス活性、病原体や金属の捕捉・隔離、抗酸化・神経保護活性など)と合わせて、Aβが自然免疫エフェクターである可能性を示唆しており、一方、Aβの生成は様々な脳ストレスに対する正常な生理的反応であると考えられる[11, 55, 89-92]。このような観点から、自然免疫反応と脳内でのAβ生成は両刃の剣のように捉えられる。正常な脳生理学やポジティブなストレスの状況下では有益であるが、中枢神経系の苦痛や炎症が解消されない状況下では、自然免疫反応やそのエフェクターは有害となりうる。実際、アミロイドカスケード仮説の著者は、「アルツハイマー病には多くの原因があるかもしれない」と認識しながらも、「APPの代謝異常とβアミロイドの沈着が、病気のプロセスにおける主要な出来事である」と仮定している[2]。しかし、慢性的な中枢神経系ストレスや神経炎症の主な原因を特定せずに、防御反応のエフェクターや下流の結果を標的にすることは、逆効果または効果のない治療戦略となる可能性がある。
慢性的な中枢神経系の苦痛や炎症の原因は、脳にある場合もあれば、そうでない場合もある。なぜなら、消化管の炎症、微生物の異常、感染症、食事や吸入毒性、慢性疾患の影響を受けた組織の炎症など、さまざまな末梢のストレスや免疫の課題が、神経、免疫、体液の経路を介して中枢神経系のストレスや神経炎症を遠隔的に誘発したり、促進したり、助長したりすることが、研究の証拠として蓄積されているからである[12, 35-38, 93]。逆に、視床下部-下垂体-副腎(HPA)軸や自律神経系(ANS)を介した脳の出力の変化は、末梢の代謝 [21]、呼吸器系や消化器系の機能 [94]、腸管バリアの伝染性 [95]、腸内細菌叢の構成 [96]、病原体の病原性 [97]、および末梢組織における免疫反応や炎症 [98, 99]に影響を及ぼす。中枢神経系がシステム・コネクトミクスの中心的なネットワークに位置する結果として、慢性的な末梢の免疫の課題、毒性、炎症は中枢神経系に伝達され、ストレス、不均衡、炎症を引き起こしたり、助長したりする。逆に、脳における慢性的なストレス、神経炎症、病変、不適応な変化、神経変性は、特にそれが恒常性の制御を担う重要な中枢神経系回路を標的としている場合、末梢における恒常性の乱れや炎症を引き起こしたり、助長したりする可能性があり、それがさらに脳のストレス、炎症、障害へとフィードバックされる可能性がある。このように、ADとその多様な併存疾患との関連性を直線的な因果関係の論理で解釈しようとすると、「鶏と卵」のような状況が生じることがある。
脳は孤立した器官ではなく、生体を構成する細胞、組織、生理学的システムが相互に連携した複雑でダイナミックなネットワークの不可欠な部分であるため、このような状況が生じることは驚くべきことではない。脳は神経系の中枢であり、ほぼすべての組織や器官から入力を受け、出力を送り、それらの機能や恒常性を動的に調整している。脳と神経系は、外的・内的ストレスの主要なセンサー、インテグレーター、プロセッサー、エフェクターであり、その結果、主要な標的となる。
さらに,神経科学と免疫学の接点における画期的な発見により,神経系と免疫系は,中枢神経系と末梢神経系の両方で機能的・構造的に絡み合っており,本質的に,恒常性を脅かす,あるいは脅かすと思われる刺激を感知し,統合し,評価し,対応するグローバルなセンチネルシステムとして機能していることが明らかになった[100]。神経細胞と免疫細胞の間の長距離神経伝達と双方向の神経免疫コミュニケーションは、中枢と末梢の自然免疫を連結し、末梢と中枢の炎症と障害の間の相互関係の潜在的なメディエーターとして登場する[34, 98, 99, 101]。
重要なことは、過度に急性または長期にわたるストレスの影響を受けると、神経免疫センチネルシステムの神経細胞および/または免疫細胞の構成要素が、中枢神経系および/または末梢において長期にわたる機能的および/または構造的変化を引き起こす可能性があるということである。これにより、神経原性および/または免疫原性の過敏症や炎症が発生し、末梢および中枢の異常や炎症が相互に強化される循環ループが発生する可能性がある。例えば、呼吸器系アレルゲンに繰り返し暴露されると、感覚気道神経経路に持続的な機能変化が生じ、末梢の求心性気道神経の神経可塑性変化や、脳幹核の神経細胞やグリアの感作およびグリオシスが生じる。これらの後天的な変化が、喘息の特徴である気道の過敏性を引き起こすと考えられている[102]。同様の神経免疫学的変化が「咳過敏症症候群」の原因として提案されている[103]。化学物質の暴露によって引き起こされる神経原性の炎症は,多発性化学物質過敏症症候群や慢性炎症反応症候群に関与していると考えられている[100, 104].
自然免疫の面では、微生物や無菌状態での免疫チャレンジは、おそらくエピジェネティックや代謝のリプログラミングを介して、自然免疫細胞の長期的な機能変化(「訓練された免疫」)につながり、その結果、その後の刺激に対する免疫反応が増強されたり抑制されたりすることになる[105, 106]。蓄積された証拠は、末梢および中枢の自然免疫記憶とそれらのクロストークが、ADの病因に関与していることを示している[107]。例えば、ADの動物モデルを用いた実験では、末梢の炎症刺激が脳内で長期の自然免疫記憶を誘発し、それが後年の神経病理に影響を与えることが示されている[108]。訓練された免疫の中枢神経系における変化は、ミクログリアのプライミングであり、最近、脳の老化や、AD、PD、MS、外傷性脳損傷などの中枢神経系疾患に関連する炎症性中枢神経系環境の主要な原因として浮上している[35, 109, 110]。プライミングの過程では、刺激を受けた細胞が活性化して増殖し、反応性が高まった状態に移行することで、その後の炎症刺激に対する炎症反応が誇張されて起こる。プライミングは、ミクログリア、マクロファージ、マスト細胞、メモリーT細胞、ナチュラルキラー細胞など、多くの長寿命の免疫細胞で、中枢神経系や末梢で起こる一般的な現象である。
生体の恒常性とは、相反する力の動的な陰陽バランスによって維持される最小のエネルギー散逸の状態である。力のバランスが崩れると、ホメオスタシスが阻害され、ストレスが生じる。ストレス反応は、局所、地域、および全身のエネルギーと資源を動員して再配分することで、最も効率的にストレスに対処し、速やかにシステムをバランスのとれた最小エネルギー散逸のホメオスタシス状態に戻すために活性化される [56, 94, 111]。
急性ストレスとは異なり、慢性ストレスは、生体システムを不均衡で散逸的な活性化状態に長期間にわたって放置する。その結果、活性化された細胞、組織、およびシステムは、時間の経過とともに代謝欠損を生じ、蓄積していく。これらの代謝欠損は、ネットワークレベルでのエネルギーおよびリソースの容易な再分配により、最初は局所的および全身的な蓄えを利用して補われる [56]。しかし、ストレスが解消されない状況では、慢性的に活性化している細胞、組織、システムは、遅かれ早かれ疲弊段階に入る。これにより、ネットワークの不均衡やストレスがさらに拡大し、システムネットワーク構造全体に波及して、他のドメインやシステム全体に影響を及ぼす可能性がある。システムネットワークは、機能的・構造的な相互関係を再構築することにより、ネットワークのストレスや不均衡を補い、最小化しようとするが、誤って構成されたタンパク質のように、局所的または全体的に慢性的な散逸的な不均衡状態に陥る可能性がある。
アルツハイマー病患者は、ストレス応答、免疫応答、抗酸化防御、ハウスキーピング代謝、ニューロンの機能とサポートに関わるネットワーク領域において、多様で複数の不定愁訴や疲弊の兆候を示す。例えば、
- ステロイドホルモンの減少
- 甲状腺機能の変化
- 副腎疲労の兆候
- 向神経性サポートの減少(例:BDNF、GDNF、NGF BDNF、GDNF、NGF、イリシンなど)の減少 [112, 113]
- インスリン抵抗性、脂質およびグルコース代謝の変化
- ホモシステインレベルの上昇
- 負の窒素バランス
- 必須微量栄養素、ビタミン、酵素補因子の全身レベルの低下
などがある。
- ビタミンB群(B6,B9(葉酸)B12)
- ビタミンA
- ビタミンE
- ビタミンC
- ビタミンD(25-ヒドロキシコレカルシフェロール)
- 亜鉛
- S-アデノシルメチオニン(SAM)
- ドコサヘキサエン酸(DHA)などの必須微量栄養素、
- ビタミン、酵素補酵素
の全身レベルが低下している[64, 114-116]。
アルツハイマー病患者の末梢単球は、貪食能力の低下を示すが、これは、ex vivoおよび患者の両方で、目標とする代謝の補充によって回復することができる[117, 118]。
- アセチルコリン
- コルチゾール
- 血管作動性腸ペプチド(VIP)
- メラノサイト刺激ホルモン(α-MSH)
- エストロゲン
- ノルエピネフーリン
などの自然免疫反応の主要な神経内分泌阻害物質の血漿レベルは、典型的にアルツハイマー病患者で変化しており、免疫反応の神経制御が慢性的に亢進しているか、より頻繁に疲弊していることを示唆している[54, 64, 119]。
疫学調査では、ADおよび認知機能低下の多様な危険因子が、末梢に起因することが明らかになっている。これらには、
- 血管疾患
- 糖尿病
- 慢性感染症
- 全身性炎症
- 肥満
- 中年期の慢性閉塞性肺疾患および喘息
- 慢性歯周炎
- 中年期の関節リウマチ
- 頭部外傷
- 身体活動の低下
が含まれる[12, 13, 120-122]。さらに、脳ストレスや認知機能低下の主な要因としては、
- インスリン抵抗性
- 慢性高血糖
- 閉塞性睡眠時無呼吸症候群
- 食生活の過敏性
- 消化管の伝染性亢進
- 微生物の異常、金属、化学物質
- 大気汚染
- 揮発性有機化合物
- 生物毒などの環境毒素への暴露
などが考えられる[12, 116, 123, 124]。認知機能低下の原因となりうるこれらの多様な要因の大部分は、慢性的な組織の損傷や不整脈、自然免疫の慢性的または反復的な刺激、低悪性度の炎症、恒常性制御の障害などが主なテーマとなっている。上述したように、アルツハイマー病の遺伝的危険因子は基本的に同じテーマで構成されており、アルツハイマー病患者の生化学的および臨床的プロファイルにも明確に反映されている。
以上のことから、脳のシステム的背景は、βアミロイド症のメカニズムとその結果に研究者の注意が集中することによって、従来のADパラダイムが示唆するよりも重要であることが明らかである。脳のシステム的背景は個々に異なっているが、ヒトの生体を構成するシステムネットワークの位相的構成は普遍的である。ネットワークの中心に位置することから、脳は、ストレス、毒性、およびシステムネットワークを介して伝播する摂動の優先的な標的となる。慢性的なストレス、毒性、炎症の入り口と性質、そしてそれらが優先的に中枢神経系にアクセスするルートに応じて、異なる中枢神経系のハブと回路が標的となり、異なる神経疾患と臨床表現型を生み出す可能性がある。ネットワーク上の重要な位置と機能により、中枢神経系のハブやネットワーク中心性の高い神経システム(例えば、ストレスシステム)は、多くの異なる中枢神経系疾患で影響を受ける可能性がある。それゆえ、多様でありながら重なり合う神経疾患や、ある疾患の中で多様でありながら重なり合う臨床表現型が存在する。それゆえに、AD、PD、MSとして認識される共通の、しかし異質な臨床病理学的エンドポイントに収束する病因と進化の軌跡の潜在的な異質性がある。
最後に、私たちは、アルツハイマー病のシステムネットワークの観点から、多くの多様なAD関連現象がどのように理解されるかを説明することを試みた。このフレームワークはすべてを網羅することを意図したものではなく、ADやその他の神経疾患の原因となるプロセスについての考え方や理解を整理するための方法として提示したものである。このフレームワークは、アミロイドカスケード仮説や、ADの潜在的原因として多様な外的・内的要因(感染症、有害金属、化学物質への曝露、アンモニア、コリン作動性の低下など)を挙げているほとんどの代替的なAD仮説と互換性がある。明らかに、引用された研究は、上述のテーマやアイデアを取り上げ始めたに過ぎず、より体系的なシステムスケールの研究が必要である。多くの場合、提示された視点は、現在主流の文献とは異なる期待や提言をもたらす。しかし、ここで紹介する考え方は、ADの診断、予防、治療に関してより実用的な価値を持つ可能性が高く、また、ADやその他の複雑な神経疾患の発症や進行を促す実際の要因やプロセスをよりよく説明するものであることを提案したいと考えている。
臨床的証拠と影響
アルツハイマー病の効果的な治療法は不足しており、従来のADモデルの様々な側面を標的とした単剤治療薬の複数の臨床試験は、一貫して納得のいくものではなかった。これに代わるものとして、著者の一人(DEB)は最近、早期のADを治療するためのシステムレベルのプログラム的アプローチを紹介し、認知機能の低下を持続的に阻止したり逆転させたりするなど、ケーススタディで有望な結果を示した[116, 125]。我々は、単一の原因と単一の直線的なメカニズムを仮定するのではなく、個々の患者における認知機能低下の多くの潜在的要因を体系的に評価し、それらを包括的にシステム全体で対処することを選択した。各患者は、潜在的な要因の組み合わせとその重みが異なるため、治療へのアプローチはターゲットを絞った個別化されたものとなる[55, 64]。
具体的には,生化学的検査,遺伝子解析,脳機能イメージング,脳容積分析,神経心理学的評価,医療記録や生活史の評価などのマルチモーダルな診断ツールを用いて,個々の患者の認知機能低下やネットワークの不均衡の主な潜在的要因を特定する。この評価に基づいて、特定された要因や不均衡に対処するために、マルチモーダルな個別の治療プログラムがデザインされ、適用される。このプログラムには複数の治療法が含まれ、薬理学的、栄養学的、および生活習慣への介入、目標とする食事の補充、ホルモンの最適化、プロバイオティクス、断食、身体運動、睡眠の最適化、ストレス管理、瞑想、および脳のトレーニングなどが含まれる [116, 125]。複数の治療法は,治療効果を最大化するために,システムネットワークの複数の領域と階層レベルに相乗的に影響を与えることを目的としている。主な焦点は、神経細胞やその他の重要なネットワーク機能の代謝支援および最適化である。治療へのアプローチは、患者をいくつかのADサブタイプに分類し、サブタイプに合わせた治療レジメンを適用することで合理化される[64]。
原理的な証明として、最近の報告では、プログラム的なアプローチで治療を受けた100人の早期アルツハイマー病患者について、認知機能の改善が認められ、多くのケースでは電気生理学や画像診断の改善も認められている[55]。この成功例は、国内の複数の施設で、複数の異なる医師によって得られたものであり、このアプローチは再現性があり、拡張性があり、多くの医師が実践可能であると考えられる。最も重要なことは、プロトコルを中止しない限り、改善が一般的に持続することであり、病態生理学的プロセスの根本原因に影響を与えていることを示唆している。一般的に、認知機能低下の初期段階にある患者さんは、病気が進行した患者さんよりも容易に、かつ完全に反応するため、認知機能低下の早期診断と予防が圧倒的に重要であることを示している。
確かに、成功した事例の数や、システム規模の多面的なアプローチによって得られた前例のない成果は、失敗が起こることによって抑制されなければならない。反応しない人や反応しない人がいることや、認知機能の低下を阻止し逆転させるためにプロトコルを遵守しなければならないことは、プロトコルの有効性、効力、特異性の点で改善の余地があることを示唆している。とはいえ、アルツハイマー病に対するシステムネットワークの視点を強く支持するケーススタディでは、システム的なマルチモーダルアプローチが成功していることが明らかになっている。一方で、今回の分析は、システムレベルのプログラム的アプローチを検証し、そのさらなる発展のための新たな道筋を示唆している。
例えば、自然免疫と炎症がアルツハイマー病の病態において中心的かつ両義的な役割を果たしていることを考慮すると、個々の免疫学的プロファイルに基づいて患者を層別化し、免疫の機能障害や不均衡を個別に対処することで、現行のプロトコルの効果を大幅に高めることができるかもしれない。この観点から、医薬品、栄養補助食品、電気医療機器(迷走神経刺激など)を用いた差動的な免疫調節は、現在の治療の武器に加える価値があるかもしれない。
末梢のストレス、毒性、炎症の入り口と性質、そしてそれらが個々の患者の中枢神経系に優先的にアクセスする経路を明らかにすることで、鑑別診断が大幅に改善され、その結果、個々の治療法の精度と効果が向上する可能性がある。
数十年に及ぶ前駆期に、罹患した細胞、システム、ネットワーク領域が獲得する長期的な不適応変化、特に中枢と末梢のストレス反応と炎症をつなぐ主要な管路である神経免疫系とその免疫・神経構成要素については、十分な注意が払われてこなかったかもしれない。ADを無条件に回復・治癒させるためには、個々の患者において、誤って設定された細胞、システム、ネットワーク領域を系統的に特定し、標的とする再構成、再配線、再プログラミングを行い、局所および全身の恒常性制御を回復させることが必要となる可能性がある。ここでは、免疫調節[126]、神経調節[127]、幹細胞療法[128]などの新たな治療法を検討する価値があると思われる。
認知機能低下の主な原因を特定して治療することは、依然として最優先事項である。この点に関して、認知機能低下の一般的な要因は、見えないところに隠れていたり、逆に見えないところにあったりして、あまり評価されていない可能性がある。前者の例としては、大気汚染、化学物質への曝露、有毒カビ、その他の形態の慢性的な環境毒性があり、これらは、広汎で、陰湿で、容赦なく、非常に多様で、多性質である [12, 124, 129]。後者の例としては,蓄積された毒素や,潜伏・再活性化しているウイルス・細菌・真菌の感染,細胞内感染,多菌性バイオフィルムなどの慢性的な密室感染が挙げられる[89, 130, 131]。
結論
早期アルツハイマー病患者のマルチモーダルな臨床プロファイルと、多様な専門領域で蓄積された研究知識を照合すると、散発性アルツハイマー病は、均質な中枢神経系疾患ではなく、慢性的なネットワークのストレスと不調和によって引き起こされる、不均質なシステムレベルのネットワーク障害である可能性が示唆される。中枢神経系とその重要な構造および回路は、主にシステム・コネクトミクスにおける中心的なネットワークの位置と機能により、慢性的な全身性ストレス、毒性、および炎症の優先的な標的となる可能性があるという仮説が立てられている。慢性的なネットワークストレスと不調和は、多様な内因性および外因性の要因とそれらの相互作用によって引き起こされる可能性があるため、ADには複数の病因と進化の過程があり、それらはアルツハイマー病という共通の臨床病理学的エンドポイントに収束する可能性がある。
中枢神経系のストレス、神経炎症、神経変性を引き起こす可能性のある複数の因子とメカニズムが、共通でありながら異質な臨床病理学的エンドポイントに収束する複数の進化の軌跡とともに、ADの気の遠くなるような複雑さと顕著な異質性 [132-134]、統計的な関連性を超えられない分野、環境および修正可能なリスク因子に関する継続的な不確実性、およびその他の継続的な論争を説明するのに役立つかもしれない [135]。
システムネットワークADの観点からは、単一のネットワーク領域(分子、細胞タイプ、器官、システム)や単一のメカニズム(βアミロイド症、神経炎症、タウオパシー、コリン作動性シグナル伝達など)を対象とした疾患モデルや単剤療法は、アルツハイマー病全体の治療には役立たない可能性が高いと予測される。さらに、患者様ごとに疾患の原因、病因、進化の過程、エンドポイントの設定が異なるため、特定の単剤療法に対する反応が一様であるとは考えられない。一方、システムネットワークの観点からは、慢性的な中枢神経系の苦痛とネットワークの不調和の主要な要因を、複数のネットワークレベルで同時にかつ相乗的に、個別化されたマルチモーダルな治療プログラムで対処することが、本症全体の治療において単剤療法よりも有意に効果的である可能性が示唆されている。実際,原理実証として,このようなアプローチの実用的なプロトタイプが作成され[116, 125],早期アルツハイマー病患者の認知機能低下を持続的に阻止・逆転させるケーススタディで検証されている[55]。
アルツハイマー病に対する統合的,全身的,精密医療的アプローチの有望な結果は,明らかに機能していない部分だけに焦点を当てるのではなく,個々の生体を全体として評価し,対処することが,他の複雑な慢性多因子疾患にアプローチするための有望な戦略であることを示唆しており,さらなる調査と開発が求められている。
付録
この付録では、AD感受性因子の簡単な機能的説明を示している。これらの因子は、3つの重複する機能カテゴリーに条件付きで割り当てられている。記載されている因子とその説明は、網羅的なものではなく、代表的なものであることを意図している。
自然免疫反応と炎症反応
このグループに属するAD感受性因子の例としては、NLRP1(NACHT, LRR and PYD domains-containing protein 1)TLR4(toll-like receptor 4)CD33(Siglec-3)(骨髄系細胞表面の受容体)TREM2(triggering receptor expressed on myeloid cells 2)TREM1,MS4A6AおよびMS4A4AE(membrane-spanning proteins expressed on myeloid cells)などが挙げられる。CR1(補体受容体1)INPP5D(SHIP-1)(ホスファチジルイノシトール(PtdIns)ホスファターゼ)SORL1(ソルティリン関連受容体L)ABCA7(ATP結合カセットトランスポーター)PICALM(ホスファチジルイノシトール結合クラスリンアセンブリータンパク質)BIN1(ブリッジングインテグレータータンパク質1)RIN3(Ras and Rab interactor 3)などがある。
NLRP1
NLRP1は、細胞内の病原体や損傷・危険に関連する分子パターン(PAMPsとDAMPs、それぞれに対応)の主要なセンサーである。NLRP1フラマソームのセンサーコンポーネントであるNLRP1は、組織全体に広く発現しており、免疫細胞(好中球、単球/マクロファージ、樹状細胞、Bリンパ球およびTリンパ球)に豊富に発現し、消化管、呼吸器、子宮内膜および子宮頸管、胆嚢、前立腺、乳房を覆う上皮細胞に強く発現している[136]。NLRP1の遺伝子変異は、ADや多くの慢性的な末梢の炎症性疾患や自己免疫疾患と関連している[136, 137]。代謝性疾患や神経変性疾患の発症や進行に、インフラマソーム経路が関与していることを示す新たな証拠がある[138, 139]。フラマソームの活性化を介して炎症反応を引き起こす因子は、病原体関連と無菌の2つのクラスに分けられる。第一のクラスには、微生物の毒素、代謝物、病原性因子などが含まれる。無菌性の炎症を促進する因子には、多様な結晶や粒子状の物質や種があり、シリカ、アスベスト、アルミニウム塩などの外因性物質や、コレステロールや尿酸塩の結晶、Aβ、変異型SOD1,プリオンなどの内因性の種が例示される[140-146]。
TLR4
TLR4は,多様な危険関連細胞外リガンドに対する主要なパターン認識受容体であり,リポ多糖(LPS),いくつかのウイルスおよび細菌成分,酸化低密度リポタンパク質(oxLDLs),飽和脂肪酸,Aβ,フィブロネクチン,フェツインA,β-デフェンシン,熱ショックタンパク質などの多様な内因性リガンドが含まれる[147]。TLR4は,組織特異的な免疫反応の主要な開始因子である単球,マクロファージ,樹状細胞などの骨髄系細胞に主に発現している。TLR4がリガンドと結合すると,NF-κBシグナル伝達経路が活性化され,炎症性サイトカインやケモカインなどが産生され,炎症反応が引き起こされる[147]。TLR4は、組織の損傷や炎症の状態で発現し、脂質によって誘発されるインスリン抵抗性の発症に重要な役割を果たしている可能性がある[148]。TLR4の多型は、感染症や、扁桃腺炎、潰瘍性大腸炎、クローン病、加齢黄斑変性症、アルツハイマー病などのリスクの増加と関連している[149-151]。
CD33
CD33はシアル酸結合免疫グロブリン様レクチンファミリーの正会員であり、細胞間の相互作用やエンドサイトーシスに関与している。CD33関連シグレックは主に自然免疫細胞に発現し、細胞表面のシアル酸を認識して細胞の反応性を調節する「自己会合型分子パターン」として機能する。ほとんどのシグレックは、他の細胞上のシアル酸を含むリガンドと結合すると、ITIMを含む細胞質ドメインを介したシグナル伝達と、INPP5D/SHIP-1ホスファターゼなどの抑制性タンパク質のリクルートにより、免疫細胞の活性化と炎症性メディエーターの産生を抑制する。さらに、AD関連のCD33変異(rs3865444)を有する末梢単球は、食作用の能力が低下している[73, 152]。
TREM2
TREM2は、組織特異的なマクロファージ、樹状細胞、ミクログリアにおいて免疫応答を開始する細胞表面の受容体である。TREM2はまた、貪食および炎症活動の抑制を制御することが示されている[72, 153]。中枢神経系以外では、TREM2は、慢性閉塞性肺疾患(COPD)腸の損傷、および感染症において重要な役割を果たしている可能性がある[154]。
CR1
CR1は、赤血球、単球、好中球、白血球、糸球体ポドサイトの表面に発現している補体受容体であるが、脳細胞には発現していない[13, 155]。CR1は、免疫付着受容体として機能し、C1q、C3b、C4bなどの補体因子によってオプソニン化された細胞、破片、病原体の認識と貪食を媒介する[155]。
INPP5D (SHIP-1)
INPP5D (SHIP-1) は、B細胞の抗原受容体シグナル、骨髄細胞の増殖/生存および化学走性、マスト細胞の脱顆粒、ストレスシグナルの負の制御因子として作用する。INPP5Dはまた、好中球の移動の重要な制御因子でもある[83]。
RIN3
RIN3は,Rasのエフェクターであり,Rab5指向性のグアニンヌクレオチド交換因子で,エンドサイトーシス,シナプス機能,免疫応答に機能する。RIN3はヒトのマスト細胞で高発現し、濃縮されている。RIN3は,感染症や傷害部位へのマスト細胞の移動を阻害する因子として機能している可能性がある[71, 156]。
SORL1
SORL1は、多機能なエンドサイト、輸送、選別のための受容体である。SORL1は、リポタンパク質やプロテアーゼの取り込みを媒介し、APPの輸送や選別に関与している。SORL1は、脳、特に小脳に多く発現しており、他の組織では低~中程度の発現量である[74, 157]。
ABCA7,PICALM,BIN1
ABCA7,PICALM,およびBIN1は,エンドサイトーシスにおける機能を有している[72, 73]。
細胞-細胞および細胞-マトリクス間の接着およびコミュニケーション
このグループに属するAD感受性因子の例としては、DSG2(Desmoglein-2)ANK-1(Ankyrin-1)NEDD9(Neural Precursor cell expressed Developmentally Downregulated 9)CASS4(Cas scaffolding protein family member 4)PTK2B(Protein-tyrosine kinase 2-beta / Focal adhesion kinase 2)などがある。CD2AP(CD2-associated protein)FERMT2(fermitin family homolog 2)EPHA1(Ephrin type-A receptor 1)APP(amyloid precursor protein)ADAM10(a disintegrin and metalloproteinase 10)PSEN1(Presenilin-1)TREM1,TREM2,CD33,HLA-DRB1/HLA-DRB5(Major histocompatibility complex class II, DR beta 1/5)などがある。
DSG2(デスモグレイン2)
デスモソームのカドヘリンであるDSG2(デスモグレイン2)は、細胞間の接合部に不可欠な成分である。DSG2は、プラークタンパク質と中間フィラメントを結びつけることで、機能的な細胞間接着を媒介している。DSG2は、上皮細胞や心筋細胞に多く発現している。DSG2は、呼吸器感染症を引き起こすアデノウイルスの血清型が使用する主要な高親和性受容体である。上皮細胞では,アデノウイルスがDSG2に結合すると,上皮から間葉系への移行を思わせる事象が引き起こされ,細胞間接合部が一時的に開くことになる[158]。DSG2はまた,多能性幹細胞におけるβ-カテニンを介したEMTシグナルを制御している[159]。
ANK-1
ANK-1は、細胞膜や小胞体内の特殊なコンパートメントや興奮しやすい膜ドメインに向けて、積分膜タンパク質や接着分子のスペクトリン-アクチン膜細胞骨格への付着を媒介する。アンキリンは、細胞を組織に統合する上で重要な役割を果たしており、EMTにおいても機能している[160, 161]。
NEDD9 (a.k.a. CASS2)
NEDD9 (a.k.a. CASS2) は、Cas (Crk-associated substrate) scaffolding protein ファミリーのメンバーである。NEDD9は、細胞接着に関連するチロシンキナーゼベースのシグナル伝達において中心的な調整役を果たすドッキングタンパク質である。NEDD9は、EMTの正の制御因子として機能し、複数の癌において転移マーカーとなっている[85, 162]。
CASS4
CASS4は、足場となるCasタンパク質ファミリーのもう一つのメンバーである。CASS4は、肺と脾臓に豊富に発現しており、白血球で最も高い発現を示する。CASS4は、フォーカルアドヒージョンの完全性とフォーカルアドヒージョンキナーゼの活性を制御することで、細胞接着、細胞移動、運動に役割を果たしている[163, 164]。
PTK2B(別名FAK2,フォーカルアドヒージョンキナーゼ2)
PTK2B(別名FAK2,フォーカルアドヒージョンキナーゼ2)は,アクチン細胞骨格の再編成,細胞の分極,細胞の移動,接着,拡がりなどを制御する非受容体のプロテインチロシンキナーゼである。PTK2Bは、マクロファージの分極と炎症部位への移動に必要である。PTK2Bは、EMTにおいても機能している[165]。
CD2AP
CD2APは、細胞表面の受容体を細胞骨格に結合させる足場分子である。CD2APはユビキタスに発現しており、脳では低レベル、腎臓や上皮・内皮細胞では豊富に発現している[166]。CD2APは、上皮の接合部の形成とEMTにおいて機能している([167, 168])。CD2APは、接着接合部の制御を介して、血液脳関門やその他の組織関門の完全性と伝染性の維持に重要な役割を果たしている[169, 170]。
FERMT2 (a.k.a. kindlin-2 and Mig-2)
FERMT2 (a.k.a. kindlin-2 and Mig-2)は、進化的に保存されたフォーカルアドヒージョンタンパク質のフェルミチン(kindlin)ファミリーのメンバーである。フェルミチンの最もよく知られた機能は、インテグリンの活性化、双方向のインテグリンシグナルと細胞接着の制御である[171]。FERMT2は広範に発現しており、心筋細胞、内皮細胞、線維芽細胞に見られる。FERMT2は、内皮細胞で高発現しており、血管新生および血管の恒常性に必要である。FERMT2は、細胞と細胞の間の接着結合に機能し、創傷治癒や組織修復に役割を果たしている。FERMT2は、癌で過剰発現し、EMTと浸潤を促進する。変性腎疾患の一つである腎臓の尿細管線維症では,FERMT2は尿細管上皮の進行性EMTを促進する[172]。
受容体チロシンキナーゼ EPHA1
受容体チロシンキナーゼであるEPHA1は,膜に結合したエフーリンAファミリーリガンドを隣接する細胞に結合させ,隣接する細胞間で接触依存的な双方向のシグナル伝達を開始する。活性化されると、EPHA1は細胞外マトリックスへの細胞の接着を誘導し、細胞の広がりや運動を抑制する。EPHA1は、血管新生に関与し、細胞の増殖を制御している。EPH/エプリンを介した双方向のシグナル伝達は、発生過程で組織を形成し、成熟組織の生理と恒常性を支える、接触依存性の細胞間コミュニケーションの主要な形態として最近登場した[173, 174]。EPH受容体とエフーリンは、組織の損傷や炎症部位で発現が上昇し、内皮、血液脳、腸管バリアーの伝染性やEMTの制御にEPH/エフーリンシグナルが関与しているという新たな証拠がある。EPH/ephrinシグナルの調節不全は、様々な慢性炎症疾患に関与している[175-177]。
APP
APPは、細胞表面の受容体で、軸索誘導、神経細胞の接着、シナプス形成に重要な機能を持っている。APPは、ヘパリンやコラーゲンI、IVなどの細胞外マトリックスの成分と結合することで、神経突起の伸長を制御している。神経細胞のシナプスでは、APPは、シナプス形成(シナプス出芽)とシナプス破壊(シナプス出芽)のシグナル伝達のバランスを調節している可能性がある[178]。APPと、E-カドヘリンやN-カドヘリンのような古典的なカドヘリンは、C末端のタンパク質分解断片の放出を介して、同様の方法で細胞膜から核へとシグナルを送り、進化的に保存されたYAPやTAZ転写因子のような下流のエフェクターを共有し、EMTを制御している[83, 179]。
ADAM10
ADAM10は、幅広い特異性を持つ膜メタロプロテアーゼであり、膜貫通タンパク質の細胞外ドメインを切断し、脱落させる[180]。ADAM10の基質のリストには、脳の病理、炎症、および癌に関与する多様な分子が含まれている[181]。例えば、Notch、APP、L-セレクチン、L1接着分子、N-およびE-カドヘリン、TNF-αおよびIL-6受容体、Klotho、VEGFおよびEGFなどである。神経細胞では、ADAM10は、APPのタンパク質分解処理に重要なαセクレターゼ活性を提供する。ADAM10は、E-カドヘリンを処理することによって、上皮細胞-細胞間の接着と移動を制御しており、EMTにおける機能を持っている可能性がある[182, 183]。ADAM10はまた、EPH/ephrin複合体のコンテクストの中でefrinsを切断し、それによって細胞-細胞間の接着とコミュニケーションを制御する[184]。
プレセニリン-1 (PSEN1)
プレセニリン-1 (PSEN1) は、膜内タンパク質の膜内切断を触媒するγ-セクレターゼ複合体の重要な構成要素である。プレセニリン-1の基質は多岐にわたり、その多くは細胞の運命、接着、移動、神経突起の伸長、シナプス形成の制御に関与するタイプIの膜貫通タンパク質である。例えば、Notch、APP、p75NTR、Desmoglein-2,N-およびE-カドヘリン、SORL1,LRP1,IL1およびIL-6受容体、HLA、Klotho、VEGF、IGFR、インスリン受容体、エフーリンおよびEPH受容体などが挙げられる[185]。細胞接着において、プレセニリン-1はカドヘリンと結合し、細胞-細胞間の接着の安定化、ダイナミックなターンオーバー、維持、および溶解に大きな役割を果たしている。
HLA-DRB1/HLA-DRB5遺伝子座
HLA-DRB1/HLA-DRB5遺伝子座は、免疫に重要な複数のタンパク質をコードする6番染色体上の高度に多型な領域である主要組織適合性複合体(MHC)に属している。MHCの多型は、感染症、自己免疫、がん、そしてAD、PD、多発性硬化症(MS)などの神経障害と関連している[73, 186]。古典的には,MHCクラスII分子は,樹状細胞やマクロファージなどの専門的な抗原提示細胞(APC)によって,外因性抗原をCD4+ Tヘルパー細胞に提示するために使用される[187]。MCH-II を発現するミクログリアの顕著な増加は,アルツハイマー病を含む多くの神経疾患で証明されている [188, 189].MHCII+ミクログリアとCD4+T細胞は,慢性的な神経変性の間に蓄積され,相互に病態を形成する[190].
しかし、最近の研究では、APCが他の細胞タイプにも処理済みまたは未処理の抗原を提示できることが明らかになった。例えば、血管周囲の樹状細胞は、血液由来の抗原を捕獲し、MCH-II抗原複合体を含むエクソソームの放出を介して肥満細胞に伝達し、アナフィラキシーを誘発する[191]。消化管では、樹状細胞がプリオンや潜在的に他の抗原を腸の腹側から高度に神経支配された腸リンパ組織に捕獲して運び、そこでプリオンは、エクソソームやトンネル状のナノチューブが可能な導管として提案されているものの、未知のメカニズムで免疫細胞から神経細胞に移される[192, 193]。さらに,MHCクラスII分子は,消化管や呼吸器を覆う上皮細胞の表面に豊富に発現しており,おそらく,トランスサイトーシスされた抗原を組織に常駐する免疫細胞に非専門的に提示するためのものと思われる.MHC-IIの発現とトランスサイトーシスは,炎症状態,炎症性抗原への曝露,あるいはある種の微生物産物への反応でアップレギュレートされる[194].
細胞代謝および解毒
AD感受性因子のこのグループは、細胞や組織の増殖、維持、修復、および解毒や抗酸化防御に重要な代謝経路に機能するタンパク質で構成されている。例えば、i) MTHFR(メチレンテトラヒドロフォレート還元酵素)MTR(5-メチルテトラヒドロフォレート-ホモシステインメチルトランスフェラーゼ、別名:メチオニン合成酵素)MTRR(5-メチルテトラヒドロフォレート-ホモシステインメチルトランスフェラーゼ還元酵素、別名:メチオニン合成酵素還元酵素)などの一価の炭素代謝に関わる主要な酵素。MTRR(5-メチルテトラヒドロフォレート-ホモシステインメチルトランスフェラーゼリダクターゼ、別名メチオニン合成酵素リダクターゼ)CBS(シスタチオニンβ合成酵素)ii)脂質の輸送と代謝に関わるタンパク質(ApoE、ApoJ、ABCA7,SORL1)iii)反応性のカテコール化合物やアミン化合物を異化するCOMT(カテコール-O-メチルトランスフェラーゼ)やMAO-A(モノアミンオキシダーゼA)などの解毒酵素などがある。
葉酸依存性一炭素代謝(OCM)
葉酸依存性一炭素代謝(OCM)は、細胞の基礎代謝の中心であり、タンパク質、脂質、核酸、神経伝達物質などの生合成に関わる多様な代謝経路や反応を支えている。OCMは、組織や細胞の修復、細胞の増殖、DNAの修復、解毒、抗酸化物質の防御などに不可欠である。
一炭素代謝は,ヘム,リン酸ピリドキサール,ビタミンB群などの補酵素を必要とし,含硫アミノ酸の中間体であるホモシステインを介して,葉酸サイクル(葉酸の同化),メチオニンサイクル(メチオニンの保存と主要なメチルドナーであるS-アデノシルメチオニン(SAM)の生成),トランススルファー経路(グルタチオン,システイン,硫酸の生成)を連動させている [195]。
OCM酵素の多型は、ADをはじめとする神経疾患や精神疾患を含む様々な慢性複合疾患と関連している。ADと血漿中の葉酸の減少、血漿中のホモシステインの上昇、SAMの代謝障害、およびOCM酵素の多型との関連はよく知られている[196-198]。
我々の観察によると、酵素活性の変化や酵素補因子(例えば、葉酸、ビタミンB群)の低下など、先天的および後天的な一炭素代謝(OCM)の複数の欠損が、アルツハイマー病患者に例外的に多く見られ、しばしば血漿ホモシステインレベルの上昇と関連している。メタボリックなサプリメントを摂取することで、OCMの欠乏を是正し、ホモシステインレベルを低下させることができ、これらが治療的に対処可能な要因であることが示唆されている[64, 125, 199]。ADにおけるOCMの多型とビタミンB群の状態の役割を評価したメタアナリシス研究は、これらの臨床的観察と一致している[200]。
ApoE, ApoJ, ABCA7, SORL1
ApoE, ApoJ, ABCA7, SORL1の最もよく知られた機能は、脂質代謝と、異なる細胞、細胞タイプ、および組織の間での脂質とコレステロールの輸送と再分配である。慢性疾患,毒性,感染症,炎症などによる慢性的な細胞・組織の不調は,細胞や組織における脂質,コレステロール,親油性の種の過剰な産生・蓄積と関連している[201-203]。最近の研究では、過剰な脂質の輸送と再分配は、HDL様リポタンパク質粒子によって行われることが示唆されている。注目すべきは、慢性的な炎症状態では、HDL様粒子の組成が大幅に変化し、炎症を促進する特性を示すことであり、逆コレステロール輸送を媒介する正常な抗炎症性HDL粒子とは対照的である[204-207]。
アポリポタンパクEイプシロン4対立遺伝子(ApoE4)
アポリポタンパクEイプシロン4対立遺伝子(ApoE4)は、散発性アルツハイマー病の唯一の最も重要な遺伝的危険因子である。ApoE4遺伝子が1コピーであれば、AD発症のリスクは2倍以上になり、2コピーであれば、最も一般的なApoE3対立遺伝子と比較して、12倍に増加する。アポリポ蛋白質Eは、神経細胞の成長と修復、神経再生、脂質輸送、免疫反応など、様々な生物学的機能やプロセスに関与する高度に多機能な蛋白質である。ApoEは、長寿、動脈硬化性心血管病、進化、炎症、発達などに関与しているとされている[70, 208-210]。最もよく知られているApoEの機能は,中枢神経系と末梢神経系の両方での脂質代謝と輸送である。ApoEは,肝臓,脳,マクロファージに高発現しており,コレステロールや脂質の動員と再分配を仲介している[70]。ApoEとApoJ(別名:クラスターリン(CLU))は、脳内でのコレステロールや脂質の輸送と再分配を管理する主要なアポリポタンパク質である[211, 212]。ApoEとApoJは、組織の損傷部位で分泌される主要なストレス因子でもあり、流出したコレステロール、脂質、親油性物質、変性したタンパク質を細胞外環境から除去する。細胞外のApoEは、損傷した末梢神経や再生した末梢神経の部位で、全可溶性タンパク質の5%までを占めることがある[70]。ApoEと、一般的な細胞ストレス因子であるApoJは、脳からβアミロイドを除去するための主要なシャペロンの一つである[135, 213, 214]。複数の研究が、ApoE4と自然免疫反応の亢進、中枢神経系および全身の感染症における転帰の悪さを関連付けている[215-220]。最近の研究では、ApoE4が、シナプス機能、プログラムされた細胞死、微小管の分解、栄養補給、老化、インスリン抵抗性に関連する複数の遺伝子の発現を制御する転写因子として作用する可能性が示された[210]。
COMT(catechol-O-methyltransferase)
COMT(catechol-O-methyltransferase)は,内因性および異生物性のカテコール化合物をメチル化し,分解およびクリアランスの対象とする。COMTの基質には、エピネフーリン、ノルエピネフーリン、カテコールエストロゲン(E2など)薬物(レボドパなど)が含まれる。COMTは、組織内のエストロゲンレベルを調節し、前頭前野のドーパミンレベルの調節に中心的な役割を果たしている。
MAO-A(モノアミン酸化酵素A)
MAO-A(モノアミン酸化酵素A)は、セロトニン、メラトニン、ドーパミン、エピネフーリン、ノルエピネフーリンなどのモノアミンの酸化的脱アミノ化を触媒し、反応性のアルデヒド、アンモニア、過酸化水素を生成する。MAO-A活性の過剰および不全は、AD、攻撃性、反社会的行動、パニック障害、双極性障害、大うつ病など、広範囲の神経疾患および精神疾患と関連していると言われている。MAO-A阻害剤は、うつ病やPDの治療に用いられる。
MAO-AとCOMTは、神経伝達物質やカテコールエストロゲンを異化する酵素としてよく知られている。しかし、これらの酵素は、中枢神経系以外の多くの組織にも豊富に発現しており、内因性および外因性の多様なアミンおよびカテコール化合物に作用する汎用の解毒酵素である。モノアミン酸化酵素とCOMTが中枢神経系外の内因性化合物や異性化合物の代謝に果たす役割は、これまであまり認識されていなかったのかもしれない[221]。
謝辞
Jessie B. and W.T. Robinson Charitable Lead A. Trustからのご支援に感謝いたする。また、Phyllis and James Easton、David Mitchell、Joshua Bermanにもご協力いただいた。
ApoE4遺伝子保有者によく見られる末梢疾患に関する情報を惜しみなく提供してくださったJulie Gregory氏とApoE4.Infoフォーラム(https://www.apoe4.info/wp)のメンバーに感謝する。Deirdre Moynihan氏には、原稿提出の支援をいただいた。
原稿の改善に役立つ批判的なコメントや提案をいただいた査読者の方々に感謝いたする。
投稿者
著者の貢献 A.K.とD.E.B.は原案を考案した。A.K.は研究を考案して実行し、結果を解釈して原稿を書いた。D.E.B.は臨床データを提供し、議論や助言を通じて重要な意見を提供した。D.E.B.は本プロジェクトを監督した。D.E.B.はプロジェクトを監督し,両著者は原稿を読み,承認した。
利害の衝突
AKは申告すべき利益相反はない。DEBはApollo Healthのコンサルタントを務めている。
資金調達
本研究は、Jessie B. and W.T. Robinson Charitable Lead A. Trust、およびPhyllis and James Easton、David Mitchell、Joshua Bermanからの寄付によって支えられている。
*早期アルツハイマー病患者とは、主観的認知機能障害(SCI)軽度認知機能障害(MCI)日常生活動作のほとんどを保持している中等度アルツハイマー病患者を含むと運用上定義されており、「Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease」(Alzheimers Dement. 2011 May; 7(3): 1,000,000,000,000)に記載されている臨床基準に準拠している。2011 May; 7(3): 263-292)を参考にしている。また、可能な限り、脳画像(アミロイドPET、FDG-PET、MRI)による機能的・構造的ADバイオマーカーの評価、脳脊髄液のアミロイド・タウ(ATI)認知機能評価(MoCA、MMSE)を行い、AD診断の裏付けを行った。