Contents
アルツハイマー病とガンの関連研究
概要
アルツハイマー病と癌の逆相関
複数の疫学的証拠からは、がん患者では神経変性疾患を発症する頻度が低く、神経変性疾患患者ではその逆のことが生じている。
この一見異常な対照的関係のメカニズムは明確には解明されていないが、少なくとも部分的には生物学的な理由が存在し、神経細胞の細胞周期の異なる機能が進化的トレードオフによって最適化されていることによって説明ができる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6519136/
50%のがんリスクの低下
100万人以上の参加者に関する縦断的な研究では、アルツハイマー病のある条件下では癌のリスクは50%減少する。反対にがん患者ではアルツハイマー病リスクが35%減少する。(血管性認知症とは関連しない)
www.ncbi.nlm.nih.gov/pubmed/23843468/
www.ncbi.nlm.nih.gov/pubmed/20032288/
ガンによっても異なるガンリスク
アルツハイマー病患者では脳腫瘍の一般的なタイプである膠芽腫の発症リスクは高いが、肺がんの発症リスクは低い。
www.ncbi.nlm.nih.gov/pubmed/28667284/
前立腺患者のアルツハイマー病リスクはわずかに増加
www.ncbi.nlm.nih.gov/pubmed/28711346/
アルツハイマー病と有意に逆相関したがん、卵巣がん、前立腺がん、直腸がん、乳がん、子宮がん、白血病
www.ncbi.nlm.nih.gov/pmc/articles/PMC5083750/
パーキンソン病
パーキンソン病患者では、悪性黒色腫のリスクが増加する。
www.ncbi.nlm.nih.gov/pubmed/21207412/
パーキンソン病のリスク遺伝子PARK2は、グリア芽腫、結腸癌、肺癌において発現する。グリア芽腫ではパーキンソン病リスクが増加するが、結腸がん、肺がんではリスク低下を示す。
translationalneurodegeneration.biomedcentral.com/articles/10.1186/s40035-015-0043-z
がん治療によっても変化するリスク
化学療法で治療された乳がん生存者は、健常な対照と比較して白質組織と結合性が低いことを示唆する。
www.ncbi.nlm.nih.gov/pubmed/26004016/
癌の化学療法受けた人では、受けなかった人よりもアルツハイマー病リスクが低い。
www.ncbi.nlm.nih.gov/pubmed/28711346/
癌化学療法は神経毒性作用を示すが、動物研究では神経変性を軽減する。
www.ncbi.nlm.nih.gov/pubmed/25710132/
アルツハイマー病とガンの共通するリスク遺伝子
アルツハイマー病とガンに関連する遺伝子の重複を表す図。
アルツハイマー病に関連する456個の遺伝子とガンに関連する3006個の遺伝子のうち、286個重複しており、アルツハイマー病関連遺伝子の60%がガン関連遺伝子と関係をもつ。

www.ncbi.nlm.nih.gov/pmc/articles/PMC6519136/figure/F5/
アルツハイマー病とガンの重複遺伝子 TOP15
- 自然免疫 46個
- 細胞増殖 34個
- 解毒・抗酸化 33個
- 脂質/リポタンパク質代謝 28個
- その他 27個
- 細胞周期、細胞生存 24個
- 神経伝達物質代謝 17個
- エネルギー代謝 14個
- 細胞シグナル伝達 13個
- その他の代謝 11個
- 輸送体 9個
- DNA代謝と修復 9個
- 転写因子 9個
- 細胞外マトリックスの破壊 7個
- 凝固 5個

www.ncbi.nlm.nih.gov/pmc/articles/PMC6519136/figure/F6/
ApoE4ガン患者の化学療法後の認知機能低下
ApoE4遺伝子を有する長期生存のガン患者(乳がん、リンパ腫)への化学療法による治療は、ApoE4陰性の化学療法を行ったガン患者と比べて長期的に視覚記憶、空間能力などの認知機能テストのスコアが低下する傾向にある。
www.ncbi.nlm.nih.gov/pubmed/12923801/
ApoE2のガンリスク
アルツハイマー病のリスクを低下させるApoE2対立遺伝子は、一部のガンリスクと攻撃性を高める可能性がある。
www.ncbi.nlm.nih.gov/pubmed/23934233/
癌とアルツハイマー病 逆相関を示す生化学的経路
www.ncbi.nlm.nih.gov/pmc/articles/PMC5120447/
p53
p53遺伝子は、細胞周期調節の中心的役割を果たす細胞内でDNA修復や細胞増殖停止、アポトーシスなどの細胞増殖サイクルの抑制を制御する機能をもつ。p53の活性化遺伝子の変化をもたらすことで細胞周期の停止とアポトーシスを引き起こす。
ゲノムの安定性を維持するために、p53は損傷した細胞のアポトーシスを誘導するかどうかを決定する。
p53はG1 / S細胞周期チェックポイントの活性化に重要な役割を果たす。
www.ncbi.nlm.nih.gov/pubmed/26205489/
ガンと神経変性疾患の分岐にあるp53
www.ncbi.nlm.nih.gov/pubmed/22387179/
アルツハイマー病とガンの逆相関
www.ncbi.nlm.nih.gov/pubmed/19519301/

ガンの守護者p53
ほとんどの悪性腫瘍ではp53はダウンレギュレートされていることが示されている。
ゾウはガン発症率がヒトよりも低いことが知られており、p53をコードする遺伝子もヒトの19倍多くもっていることがわかっている。
www.afpbb.com/articles/-/3062664
www.nature.com/news/how-elephants-avoid-cancer-1.18534
アルツハイマー病で高発現するp53
アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患ではp53はアップレギュレートされている。
www.ncbi.nlm.nih.gov/pubmed/17399897/
p53の阻害が神経変性疾患治療の標的となる可能性。
www.ncbi.nlm.nih.gov/pubmed/22042001/
アミロイドβオリゴマーは、p53
www.sciencedirect.com/science/article/pii/S0301008217301880
p53はタウのリン酸化を誘導する。
www.sciencedirect.com/science/article/abs/pii/S0304394007002911

www.sciencedirect.com/science/article/pii/S092544391630165X
p53を抑制する
- マグノリア
- バイカリン
- アスタキサンチン
- プテロスチルベン
- レスベラトロール
- カプサイシン

p53を増加させる
飢餓ストレス
亜鉛 p53の活性化と安定化
www.ncbi.nlm.nih.gov/pubmed/11416144/
朝鮮人参(ジンセノサイド)
www.ncbi.nlm.nih.gov/pubmed/24622841/
オリーブリーフ抽出物
チャーガ
クルクミン
シラジット
グレディシア・シネンシスのとげ抽出物
www.ncbi.nlm.nih.gov/pubmed/20564491/
GSK-3β
molecularneurodegeneration.biomedcentral.com/articles/10.1186/1750-1326-5-7
PIN1
CDK阻害剤
p21 WAF1
www.ncbi.nlm.nih.gov/pubmed/17726367/
p53の安定化と活性化に影響するタンパク質
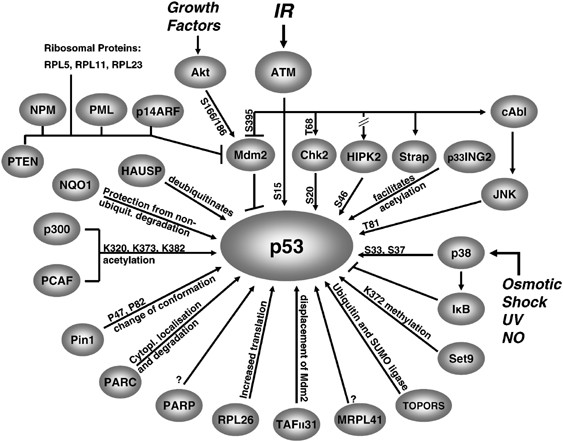
www.nature.com/articles/4401925
PIN1
PIN1は分子タイマーとして機能すると仮定されている多機能性遺伝子。
多くのがんでPIN1はアップレギュレートしているが、アルツハイマー病ではダウンレギュレートされている。
www.ncbi.nlm.nih.gov/pubmed/17876319/
www.ncbi.nlm.nih.gov/pubmed/20735350/
WNT
WNTシグナル伝達経路は、発達から成人期の間に広範な細胞機能を調節するシグナル伝達経路。細胞増殖、発達中の細胞運命の決定、アポトーシス、細胞移動、細胞極性、幹細胞の維持に関わり、WNT経路の不適切な活性化は腫瘍を形成する要因となる。
アルツハイマー病においては、アミロイドβの神経毒性がWNTシグナルのダウンレギュレートを引き起こし、アルツハイマー病の病因に重要な役割を果たす。
ユビキチンプロテアソームシステム UPS
UPSのアップレギュレーションは一般的に癌で観察されており、ボルテゾミブなどのプロテアソーム阻害剤は抗がん剤として10年間利用されてきた。
一方でプロテアソーム機能を強化する薬物は神経保護作用があることから、神経変性疾患の治療薬として研究開発されている。
www.ncbi.nlm.nih.gov/pubmed/28552582/
p53の安定化と活性化の制御の主要なメカニズムは、プロテアソームによる分解前のMDM2との相互作用とユビキチン化に依存する。
www.ncbi.nlm.nih.gov/pubmed/15838523
プロテアソーム活性化剤
- オリーブオイル
- レスベラトロール
RCAN1
カルシニューリン1のレギュレーター(RCAN1)発現の増加は、アルツハイマー病の病因を促進する一方、多くの種類のがんの成長と進行を抑制する。
異常なRCAN1発現はアルツハイマー病と癌の両方で検出される。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5787488/
RCAN1の作用
- アルツハイマー病の神経細胞アポトーシスを促進
- さまざまな種類の癌で細胞アポトーシスを促進
- 血管新生を抑制
- 細胞の増殖と移動を阻害
HSP・HSF-1
熱ショックタンパク質(HSP)は、熱ショック転写因子(HSF-1)によって調節sれており、多くの癌細胞で豊富に発現している。
その合成は神経細胞では年齢とともに低下する、がんでは、HSP72は肺がんの乳がんの進行と腫瘍の発生、成長、転移に関連する。
ステロイドホルモン
エストロゲンは乳がん腫瘍増殖のよく知られた誘導因子であり、アンドロゲンは前立腺がんの病因において同様の役割を果たすことが知られている。エストロゲン、テストステロンを阻害する治療方法はこれらの疾患の主要な治療方法となっている。
しかし、これらの抗エストロゲン特性は脳へはネガティブな効果を及ぼす可能性がある。
www.ncbi.nlm.nih.gov/pubmed/27432418/
同様に、アンドロゲン阻害療法は前立腺がんを大幅に改善するが、視覚運動能力にネガティブな効果をもたらし、アルツハイマー病発症リスクを高める可能性がある。
www.ncbi.nlm.nih.gov/pubmed/26644522/
成長因子・ニューロトロフィン
NGF
NGFは、肺、甲状腺髄様癌、前立腺癌、乳房癌、膵癌などの癌の腫瘍の成長と進行の調節に関与する。神経栄養因子はグルタミン酸と相互作用することで、成人の神経可塑性と発達の調節にも関与する。
www.ncbi.nlm.nih.gov/pubmed/20569463/
BDNF
アルツハイマー病では、BDNFおよび他のニューロトロフィンのダウンレギュレーションが示されている。アルツハイマー病と診断された人々の脳組織ではより低いレベルのBDNFが見いだされている。
www.ncbi.nlm.nih.gov/pubmed/15899246/
BDNFは抗アポトーシスであり、高いBDNFレベルは癌の進行に役割を果たすことが知られている。
BDNFの発現は結腸癌などの癌でも発生し、細胞レベルで癌細胞の挙動を変化させ、結腸がん細胞のアポトーシスも減少させる。
www.ncbi.nlm.nih.gov/pubmed/24255678/
TGF-β
正常細胞では、TGF-βはG1期で細胞周期を停止させて増殖を停止させ、細胞の分化またはアポトーシスへの誘導を誘導する。
多くの癌細胞ではTGF-βが変異しており、その正常な機能が損なわれている。TGF-βの変異は、免疫抑制と血管新生を引き起こすことにより癌をより攻撃的にし、周囲の間質細胞、免疫細胞、内皮細胞および平滑筋細胞にも影響を与える。
www.ncbi.nlm.nih.gov/pubmed/10793168/
アルツハイマー病患者の脳脊髄液、血中TGF-βレベルは増加している。
TGF-βは、エフェクターT細胞をサプレッサーT細胞に変換し、炎症反応を停止させる。
www.ncbi.nlm.nih.gov/pubmed/20692646/
サイクリックAMP(cAMP)
サイクリックAMP(cAMP)は、腫瘍の進行に役割を果たすことが知られている。cAMP制御遺伝子の異常な活性化とcAMP経路の調節解除は、一部の癌の成長に関連している。
www.ncbi.nlm.nih.gov/pubmed/14973073/
サイクリックAMPはニューロンにとっては非常に強力な生存シグナルであり、神経細胞の生存率を高める。脳由来神経栄養因子(BDNF)、毛様体神経栄養因子(CNTF)、線維芽細胞成長因子(FGF)、グリア由来神経栄養因子(GDNF)、肝細胞成長因子(HGF)を含むペプチド栄養因子の長期生存が、cAMPの上昇との組み合わせによって促進する。
www.ncbi.nlm.nih.gov/pubmed/9736656/
上皮成長因子(EGF)
多形性膠芽腫、肺がん、肛門がんなどのいくつかのがんは、上皮成長因子受容体(EGFR)の過剰発現に関連する。上皮由来のがんでは、EGFRの過剰発現が病因に重要な役割を果たしている。
一方で、神経幹細胞および前駆細胞のEGFはマイトジェン(分裂促進物質)として海馬の神経新生および認知機能の改善に関与する。
www.ncbi.nlm.nih.gov/pubmed/20158379/
EGFRはアルツハイマー病神経炎性プラークの中心核には存在しない。
www.ncbi.nlm.nih.gov/pubmed/3049945/
Bcl-2
BCL-2の過剰発現は多くのタイプの癌で起こっており、化学療法および放射線の抵抗性に関連付けられている。Bcl–2レベルの増加は癌細胞のアポトーシスする傾向が低下し、癌細胞の生存を促進する。
対照的にアルツハイマー病ではBcl-2のダウンレギュレーションが示されている。
www.ncbi.nlm.nih.gov/pubmed/8922409/
Bcl-2の過剰発現は、ベータアミロイド誘発による細胞死に対して保護効果を提供することが示されている。
www.ncbi.nlm.nih.gov/pubmed/15099705/
IGF-1
IGF軸は細胞死を抑制し、細胞増殖を促進する。また、神経損傷、ミエリン形成、シナプス形成、樹状分岐および神経保護を含む神経発達にも関与する。
アルツハイマー病リスクはIGF-1の血清レベルの低下と関連しており、IGF-1レベルの上昇は脳容積の増加と認知症および脳卒中のリスクの低下と関連している。高いIGF-1レベルは神経変性から保護される可能性がある。
www.ncbi.nlm.nih.gov/pubmed/24706014/

癌では高いIGF-1レベルが存在し、IGF-1の先天的な欠損はがんの発症を防ぐことが知られている。
www.ncbi.nlm.nih.gov/pubmed/22682634/
TDP-43/CDK6
TDP-43の異常はゲノムの不安定性とアポトーシスの増加を引き起こす。これはアルツハイマー病の発生にも関与する。またはIGFの欠乏はこの経路による損傷を増強する。
www.ncbi.nlm.nih.gov/pubmed/24659241/
TDP43はCDK6を調節するが、CDK6はがんではアップレギュレートされ、アルツハイマー病ではダウンレギュレートされる。
www.ncbi.nlm.nih.gov/pubmed/18305152/
炭酸脱水酵素・カルノシン
アルツハイマー病脳では、炭酸脱水酵素の活性が低下する。炭酸脱水酵素活性化剤を投与すると、動物の学習の改善を示す。
www.ncbi.nlm.nih.gov/pubmed/17522447/
炭酸脱水酵素はカルノシンによって活性化されるが、がんでは炭酸脱水酵素が増加する
www.ncbi.nlm.nih.gov/pubmed/18336315/
テロメア
がんではテロメラーゼ活性が増加し、がん細胞のテロメアが伸長する。
癌とアルツハイマー病の共通する病態
酸化ストレス、DNA損傷、炎症、代謝調節不全、異常な細胞周期の活性化は、癌とアルツハイマー病の両方の疾患で重複しており中心的な役割を果たす。
www.ncbi.nlm.nih.gov/pubmed/25113739/
www.ncbi.nlm.nih.gov/pubmed/27998721/
ゲノム不安定性
がん
人間のDNAは、放射線、フリーラジカルなどの突然変異を引き起こす物質に対して脆弱である。人体の細胞は、何十億回も細胞分裂を受け、その間にDNAが複製されますが、そのたびに突然変異のイベントが発生するリスクが生じる。
突然変異のほとんどは無害であり、大部分はDNA修復システムによって修正される。ただし、DNA損傷は時間とともに発生し蓄積していく。
www.ncbi.nlm.nih.gov/pubmed/22353384/
ヒトゲノムの修復後の正常な突然変異率は1分裂10億塩基あたり約1突然変異。
ゲノム不安定性は、ほとんどすべてのヒトのがんの特徴であり、腫瘍形成に必要なすべての突然変異を獲得するのに突然変異率は正常細胞よりも高くなる。
アルツハイマー病
DNA損傷および細胞DNA修復能力の変化は、アルツハイマー病を含む加齢性神経変性疾患と関係している。近年ではDNA損傷が神経機能障害とリンクする新しいメカニズムが特定されている。
DNA修復能力の喪失は、血管因子の変化、グルタミン酸シグナル伝達、核DNA、ミトコンドリアDNA損傷および修復経路を含む複数の経路を通じてアルツハイマー病を悪化させる可能性がある。
www.ncbi.nlm.nih.gov/pubmed/27105872
BRCA1
BRCA1は乳癌および卵巣癌に関与する腫瘍抑制遺伝子、DNA修復に関わる。
アミロイドβの蓄積によっても神経細胞のBRCA1は枯渇することにより、アルツハイマー病の一因となる可能性がある。
www.nature.com/articles/ncomms9897

www.ncbi.nlm.nih.gov/pmc/articles/PMC4346871/
リコピン
リコピンによる治療は、MCF-7細胞のリン酸化BRCA1を増加させる
www.ncbi.nlm.nih.gov/pubmed/15951253/
アセチルコリンエステラーゼの増加を伴う抗酸化系におけるマンガニズムによる神経変性障害は、リコピン治療によって防ぐことが可能である可能性がある。
www.ncbi.nlm.nih.gov/pubmed/22192907/
アブラナ科野菜(I3C)・ゲニステイン
インドール-3-カルビノール、ゲニステインは、MCF-7およびT47D乳癌細胞でBRCA1の遺伝子発現を誘導することが示されている。
www.ncbi.nlm.nih.gov/pubmed/16434996/
大豆エストロゲン?
大豆植物性エストロゲン、ゲニステイン、ダイゼインはBRCA1、GSTP1、EPHB2プロモーターのメチル化の減少を誘発する。大豆植物性エストロゲンは、前立腺癌に対して保護効果がある可能性がある。
www.ncbi.nlm.nih.gov/pubmed/22126297/
エピジェネティクス変化
DNAメチル化標的
APP、PSEN1、PSEN2などのADリスク遺伝子の低メチル化は、学習と記憶に影響を与えることが示されている。
鉛によって誘導される学習能力の低下がS-アデノシル-L-メチオニン(SAM)によって大幅に改善される可能性。
食事中のB12、葉酸、その他のメチオニン源のレベルを上げると、メチオニンの生物学的利用能が高まり、APPおよびPSEN1の発現上昇が逆転する可能性がある。
アザシチジンやデシタビンなどのDNMT阻害剤
www.frontiersin.org/articles/10.3389/fgene.2018.00579/full
ヒストン修飾標的
多くの研究がヒストン修飾が加齢とがんの両方と関連付けられている。
バルプロ酸(VPA)、4-フェニル酪酸ナトリウム(4-PBA)、ボリノスタット(SAHA)、トリコスタチンA(TSA)およびニコチンアミドを含むヒストンデアセチラーゼ阻害剤
これらは、アルツハイマー病マウスモデルで良好な結果をもたらすことが示されている。
非コードRNA標的
miRNAレギュレーター PDE4阻害剤
タンパク質ホメオスタシスの喪失
プロテオームの恒常性であるプロテオスタシスは、シャペロンを介した折りたたみ、プロテアソームの分解、およびオートファジーで構成されている。これらの代謝回転の以上は、ミスフォールディングタンパク質毒性、ポリペプチド凝集体の蓄積と沈着を引き起こし、アルツハイマー病やパーキンソン病などの神経変性疾患の原因となる。
- 分子シャペロン
- プロテアソーム
- オートファジーリソソーム
ERストレス
ERストレスと関連するがん発症 IRE1αの活性の阻害。
UPRイニシエーターPERKを不活性化することにより、さまざまな腫瘍の悪性形質も抑制。
www.ncbi.nlm.nih.gov/pubmed/28187289
www.ncbi.nlm.nih.gov/pmc/articles/PMC6156496/
PERK阻害剤は、アルツハイマー病の重症度を緩和させる。
www.ncbi.nlm.nih.gov/pubmed/26450683
栄養素シグナル伝達の機能不全
- インスリン様成長因子(IGF-1)
- 糖尿病
- mTOR、AMPK経路の障害
ミトコンドリア機能障害
細胞老化
- テロメアの短縮
- がん遺伝子の活性化
- DNA損傷応答(DDR)経路
- 腫瘍抑制因子p16 INK4aの活性化
www.ncbi.nlm.nih.gov/pmc/articles/PMC5614326/
細胞間コミュニケーションの変化
www.ncbi.nlm.nih.gov/pmc/articles/PMC3977891/

