Contents
Adverse effects of statin therapy: perception vs. the evidence – focus on glucose homeostasis, cognitive, renal and hepatic function, haemorrhagic stroke and cataract
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC6047411/
オンライン2018年4月27日掲載
François Mach,1 Kausik K Ray,2 Olov Wiklund,3,4 Alberto Corsini,5 Alberico L Catapano,5 Eric Bruckert,6 Guy De Backer,7 Robert A Hegele,8 G Kees Hovingh,9 Terry A Jacobson,10 Ronald M Krauss,11 Ulrich Laufs,12 Lawrence A Leiter,13 Winfried März,14,15 Børge G Nordestgaard,16,17, 18 Frederick J Raal,19 Michael Roden,20,21 Raul D Santos,22,23 Evan A Stein,24 Erik S Stroes,9 Paul D Thompson,25 Lale Tokgözoğlu,26 Georgirene D Vladutiu,27 Baris Gencer,1 Jane K Stock,28 Henry N Ginsberg,29 M John Chapman,30 and European Atherosclerosis Society Consensus Panel.
要旨
目的
スタチンの長期投与が、グルコースのホメオスタシス、認知機能、腎機能、肝機能、出血性脳卒中や白内障のリスクに悪影響を及ぼす可能性を示すエビデンスを客観的に評価する。
方法と結果
2000年から 2017年までの文献検索を行った。パネルはデータを批判的に評価し、報告された副作用の分類についてコンセンサスで合意した。無作為化比較試験(RCT)および遺伝学的研究によると,スタチン治療は,一般的に臨床検査値(糖化ヘモグロビン≧6.5)で定義される新規糖尿病のリスクをわずかに増加させる(患者1,000人年あたり約1人)が,このリスクはメタボリックシンドロームまたは糖尿病予備力において有意に高い。スタチンの投与は、低密度リポ蛋白コレステロール値が極めて低い場合でも認知機能に悪影響を及ぼさず、臨床的に有意な腎機能の低下や白内障の発症とも関連していない。スタチンを服用している患者の0.5~2%に一過性の肝酵素の上昇が見られるが、臨床的には問題ない。スタチンによる特異的な肝障害は非常に稀であり、因果関係を証明することは困難である。脳血管疾患のない人における出血性脳卒中のリスク増加を裏付けるエビデンスはない。脳卒中の既往がある人を対象としたStroke Prevention by Aggressive Reduction of Cholesterol Levels研究では、わずかなリスク増加が示唆されたが、RCT、コホート研究、症例対照研究の実質的なエビデンスベースでは確認されていない。
結論
長期的なスタチン治療は、上記のような臨床的に関連する副作用のリスクが低く、驚くほど安全である。スタチンによる筋肉症状については、以前のコンセンサス・ステートメントで議論されている。重要なことは、スタチン治療の確立された心血管系の利点は、副作用のリスクをはるかに上回るということである。
キーワード スタチン, 副作用, グルコースホメオスタシス, メタボリックシンドローム, 認知機能, 腎機能, 肝機能, 出血性脳卒中, 白内障
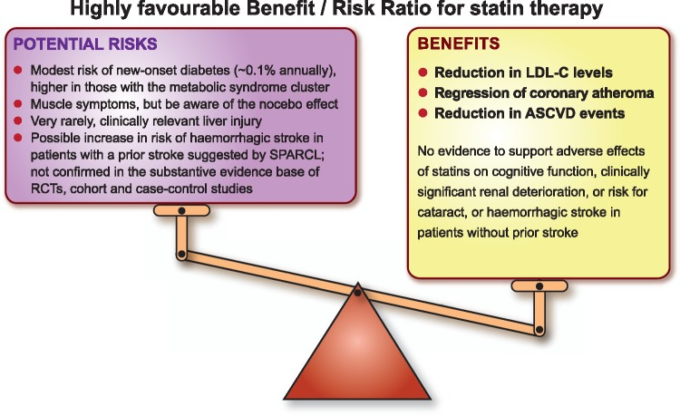
はじめに
スタチン系薬剤(3-hydroxy-3-methylglutaryl coenzyme A reductase (HMG-CoA) inhibitor)は、欧州の心血管疾患(心血管疾患)予防・脂質管理ガイドラインにおいて、高コレステロール血症および複合型高脂血症の第一選択薬として推奨されている1,2。これらの薬剤が、動脈硬化性心血管疾患の病態生理の原因因子である低比重リポ蛋白質コレステロール(LDL-C)を低下させ、(2型糖尿病の有無にかかわらず)心血管系イベントの初回および再発を予防する効果があることは議論の余地がない2-4。
大規模な無作為化比較試験(RCT)により、この治療法のベネフィット/リスク比が明確に確立されている4,5。スタチンを含むポリピルが修正可能な危険因子に及ぼす影響を評価する試験がいくつか行われていることから6,スタチンの使用はより幅広い層に拡大していくものと思われる。そのため、長期にわたるスタチン治療で起こりうる意図しない影響に関するエビデンスを批判的に評価し、その発生率を正確に評価するとともに、患者、一般市民、一部の医療従事者の間でしばしば誇張された副作用の認識を正しい方向に導くことが必要である。
RCTから得られたデータは、スタチン治療の安全性に関する信頼性の高い情報を提供しているが、この情報は、組み入れ基準を満たし、比較的短い期間(通常5年未満)治療を受けた特定の患者集団に関するものである。頻繁に起こるわけではない治療の副作用は、非常に多くの患者で長期に渡って行われた後に初めて現れる可能性がある。例えば、新たに発症した糖尿病のリスクに関しては、単一の研究では矛盾していたが、7,8 メタアナリシスや大規模データベースでは、特にメタボリックシンドロームの危険因子群を持つ、すでに糖尿病予備力である可能性のある感受性の高い人において、明確な証拠が示されている9。
さまざまなスタチンの薬理作用(表11)がスタチンの副作用の問題と関連するかどうかはまだ不明である10。実際、スタチンの代謝は異なる。例えば、シトクロムP450(CYP)系の活性の遺伝的な違いは、スタチンと他の薬剤との相互作用に影響を与え、膜輸送体の遺伝的な違いは、残留循環濃度、ひいては末梢組織への曝露の主要な決定因子である初回の肝内取り込みを変化させる可能性がある11。以上のような問題から、スタチン治療に伴う潜在的なリスク、特にグルコースホメオスタシス、認知機能、腎機能、肝機能、出血性脳卒中や白内障のリスクについて、認識と現実を区別するために、スタチンに起因する副作用を客観的に評価することが非常に重要である。本評価書は、患者、臨床医、その他の幅広い医療従事者だけでなく、公衆衛生政策立案者にも重要なエビデンスに基づく情報を提供するものである。
表1 スタチン系薬剤の比較薬理学
| 親油性の増加
|
|||||||
|---|---|---|---|---|---|---|---|
| ロバスタチン | シンバスタチン | アトルバスタチン | ピタバスタチン | フルバスタチン | ロスバスタチン | プラバスタチン | |
| IC 50 HMG-CoAレダクターゼ(nM) | 2–4 | 1–2(活性代謝物) | 1.16 | 0.1 | 3〜10 | 0.16 | 4 |
| 経口吸収(%) | 30 | 60〜85 | 30 | 80 | 98 | 50 | 35 |
| バイオアベイラビリティ(%) | 5 | <5 | 12 | 60 | 30 | 20 | 18 |
| タンパク質結合(%) | > 98 | > 95 | > 98 | 96 | > 98 | 90 | 50 |
| 半減期(h) | 2–5 | 2–5 | 7〜20 | 10〜13 | 1–3 | 20 | 1–3 |
| CYP450による代謝 | 3A4(?2C8) | 3A4(2C8、2D6) | 3A4(2C8) | (2C9) | 2C9 | 2C9(2C19) | (3A4) |
| セルラートランスポーター | OATP1B1 | (MRP2) | OATP1B1 | OATP1B1(MRP2) | OATP1B1 | OATP1B1 | OATP1B1(MRP2) |
| 1日量(mg) | 10〜40 | 10〜40 | 10〜80 | 1〜4 | 80(遅延処方) | 5〜40 | 10〜40 |
Sirtori.10から引用している。
括弧内の数字はマイナーな代謝経路やトランスポーターを示す。
CYP450:シトクロムP450,IC50:50%阻害濃度、HMG-CoA:3-ヒドロキシ-3-メチルグルタリルコエンザイムA、MRP2:多剤耐性関連タンパク質2,OATP1B1:有機アニオン輸送ポリペプチド1B1。
スタチン関連の筋肉症状
スタチン関連筋症状(SAMS、別のコンセンサス・ステートメントの焦点)12は、臨床現場で遭遇する主な副作用であり(図図11)アドヒアランス、ひいては臨床転帰に影響を与えます(囲み記事11)13,14。12,15,16 Anglo-Scandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA)研究グループは、プラセボ対照盲検試験とその非盲検延長試験において、筋肉関連症状を含むスタチン治療による4種類の有害事象の発生率を比較することで、この問題に取り組んだ。彼らは、RCTと比較して観察研究でSAMSの発生率が高いのは、ノセボ効果によるものではないかと結論づけている17が、他の研究者は、筋肉関連イベントの全体的な発生率が、盲検段階での2.03%から、被験者がスタチンを投与されていることを認識したときには1.26%に減少したことを指摘している。臨床家へのメッセージは、筋肉の症状の原因を詳しく調べずに、早急にスタチン治療のせいだと決めつけることには注意が必要だということだろう。
BOX1 臨床家のためのSAMSに関するキーポイント
- SAMSとは?大腿部、臀部、ふくらはぎ、背中の筋肉に現れる、通常は対称的で近位の筋肉痛、脱力感、疼痛。通常、顕著なクレアチンキナーゼ(CK)の上昇は認められない。
- SAMSはいつ発症する?早期(スタチン投与開始後4~6週間以内)スタチン増量後、または相互作用薬の投与開始時に発症する傾向がある。
- SAMSのリスクがあるのはどのような人ですか?超高齢者(80歳以上)特に女性、肥満度の低い方、アジア系の方、筋疾患の既往歴がある方、併用している疾患(急性感染症、腎・肝機能障害、糖尿病、HIVなど)がある方、相互作用する薬剤を併用している方。
- EASコンセンサスパネルはSAMSをどのように定義したか?筋肉の症状の性質、スタチンの開始、中止、およびスタチンの再投与に対する反応との時間的関連性による。
- SAMSの管理を決定するものは何か?CK値の上昇の大きさと、患者の心血管リスクである。
図1 スタチン治療で報告された主な種類の副作用の相対的な有病率の概要
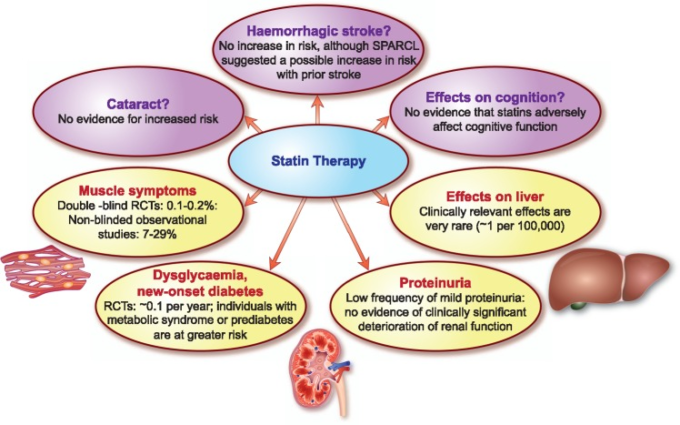
RCTは無作為化比較試験、SPARCLはStroke Prevention by Aggressive Reduction in Cholesterol Levelsの略。
検索方法
Medline,Current Contents,PubMed,および関連文献を用いて,「statin safety」,「statin adverse effects」,「statin AND cognitive function」,「statin AND plasma glucose」,「statin AND diabetes」の用語で検索した。スタチンと腎機能」、「スタチンと肝機能」、「スタチンと脳卒中」、「スタチンと末梢神経障害」、「スタチンと心血管疾患」、「スタチンとアテローム性動脈硬化症」、「スタチンとアテローム血栓症。」本レビューは、M.J.C.およびH.N.G.が組織し、議長を務めるEASコンセンサスパネルの会議での議論に基づいており、検索結果およびレビューのドラフトが批判的かつ包括的に評価された。本レビューの内容は,パネルの専門家メンバーの熟考された意見と洞察力の総意によるものである。
グルコースホメオスタシスへの影響
スタチン治療は、空腹時血糖値のわずかな上昇と関連することが知られている2。ベースラインで糖尿病を持たない91,140人の被験者を対象とした13のRCTのメタ解析では、スタチン治療によってDMの発症が約9%増加した。これは、1年間の曝露で1000人当たり1件の糖尿病が追加されたことに相当する(スタチン投与12.23件、対照投与11.25件)が、5件の心血管疾患初回イベントを予防したことになる。また、5つのRCTに登録された安定した冠動脈疾患または最近の急性冠症候群を有する約4万人の患者を対象とした別のメタ分析では、高強度のスタチン治療により、糖尿病の発症リスクは12%増加したものの、心血管疾患イベントのリスクは16%減少し、絶対値では糖尿病1例増加につき心血管疾患イベント3.5件が予防されることが示された18。本解析では、「糖尿病症例」を血清糖化ヘモグロビン(HbA1c)が6.5以上と定義した。これは、生活の質に直ちに影響を与えない検査所見であり、したがって、脳卒中や心筋梗塞による死亡などの転帰と比較すべきではない。
スタチン治療によるDM発症リスクは、メタボリックシンドロームの構成要素が増えるほど高くなることが、「Justification for the Use of Statins in Prevention」の事後解析で示されている。JUPITER(Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin)TNT(Treating to New Targets)IDEAL(Incremental Decrease in End Points Through Aggressive Lipid Lowering)SPARCL(Stroke Prevention by Aggressive Reduction of Cholesterol Levels)の各試験の事後解析でも示されているように、特にスタチン治療開始時の空腹時血糖値が最も高い人では、この効果は男性よりも女性の方が大幅に高いと考えられる。 8,19 -21 メタボリックシンドロームの特徴を有するが糖尿病の診断を受けていない45〜73歳の男性8749人(スタチン投与者2142人)を対象としたMETSIM(Metabolic Syndrome in Men)コホートでは、5.9年間の追跡調査において、スタチンの強力な投与が糖尿病の発症を46%(スタチン投与者11.2%、非投与者5.8%、P<0.001)増加させ、1年間の曝露で1000人当たり10人の新規症例を発生させた22。これらの患者は、年齢が高く、肥満で、運動量が少なく、高密度リポタンパク質コレステロール(HDL-C)の値が低く、トリグリセリド、空腹時血糖値、HbA1cの値が高かった22。これらの知見を踏まえた上で、スタチンを服用していない耐糖能異常が確認された被験者のDMへの転換率は、Diabetes Prevention Programでは被験者1,000人当たり1年間で110人、J-PREDICT試験では日本人被験者1,000人当たり1年間で200人であった(Odawara M, Late Breaking Studies, American Diabetes Association Congress, 2013)。
さらに、スタチン投与中に糖尿病を発症した患者では、大血管障害だけでなく、糖尿病に関連する微小血管障害の合併症の発生率も低いことが観察データで示されている25。これらのデータは、スタチンを投与された糖尿病患者において、LDL-Cの単位減少あたりの相対リスク(RR)の減少は同程度であるが、絶対的なベネフィットはより大きいという知見と一致している4,26。
スタチンの糖尿病リスクに対する効果がオンターゲット(HMG-CoA還元酵素の阻害)かオフターゲットかを判断することは、スタチンの糖代謝に対する効果が薬剤効果か薬剤群効果かを理解するのに役立つ。メカニズム的には、スタチンはインスリン抵抗性を増加させることで血糖値を上昇させる可能性があり、それはおそらく、循環遊離脂肪酸の変化、27 β細胞の機能低下、または別のメカニズム、あるいはこれらの組み合わせによって媒介されると考えられる(図図図22)28。この全体的な疑問は、スタチンの標的であるHMGCR遺伝子の共通遺伝子変異(rS17238484およびrS12916)と、体重、肥満度(BMI)ウエスト周囲径、血漿インスリンおよび血糖値、DMリスクとの関連が評価された、約200,000人を対象としたメンデルシアン無作為化試験によって明らかにされた29。29-34 BMI30および血漿インスリン31に関するゲノムワイド関連解析の他のメタアナリシスでは、同じ変異株(または適切なプロキシ)とこれらの形質との方向性の一致した関連が示されたが、両変異株の空腹時インスリンとの関連は、BMIで調整した後、統計的に有意ではなかった。METSIMコホートの長期追跡調査では、スタチン治療によるDMリスクの増加は、インスリン感受性とインスリン分泌の低下に起因することが示された21。しかし、最近の報告では、腸内細菌叢とメタボロームプロファイルがこれらの代謝特性と関連し、これらの特性に対するスタチン治療の効果と関連していることが明らかになった32,33。
表2 糖尿病リスクに対するスタチンの効果がon-target actionであることを示す証拠のまとめ
| 引用の年 | 研究の説明 | 結果 | 結論 |
|---|---|---|---|
| 2010 30 | BMIの遺伝的変異のゲノムワイド関連解析(GWAS)(n = 249 796) |
|
糖尿病リスクに対するスタチンの効果は、体重/ BMIに対する目標通りの効果によって少なくとも部分的に説明されます |
| 2012 31 | インスリンの遺伝的変異のGWAS(n = 133 010) |
|
|
| 2015 29 | メンデルランダム化試験(nは共通の〜200 000科目)HMGCRの遺伝子変異体 | HMGCR遺伝子変異体rs17238484Gの 各対立遺伝子は、
他のHMGCRバリアント(rs12916)は、これらの調査結果との一致を示しました |
|
| 2015 29 | 20件のRCTのメタアナリシス(n = 129 170) |
|
|
| 2016 32 | より低いLDL-Cレベルに関連するHMCGRおよびPCSK9遺伝子の変異の遺伝的リスクスコアを使用したメンデルランダム化研究(n = 112 722) |
|
糖尿病リスクに対するスタチンの効果は、ベータ細胞機能に対するLDLの効果によって媒介される可能性があります |
| 2016 33 | または周辺のLDL低下対立遺伝子の遺伝的関連研究のメタアナリシスNPC1L1、HMGCR、PCSK9、ABCG5 / G8、LDLR T2DMと50 775人と270の269の制御に関与します |
|
|
| 2017 34 | より低いLDL-Cレベルに関連するPCSK9変異体のメンデルランダム化研究(n => 550 000) |
|
BMI(体格指数)CI(信頼区間)LDL-C(低比重リポ蛋白質コレステロール)RCT(無作為化比較試験)2型糖尿病(2型糖尿病)。
図2 肝外組織および膵臓のβ細胞におけるスタチンの糖尿病発症効果を促進する因子とその候補となるメカニズム
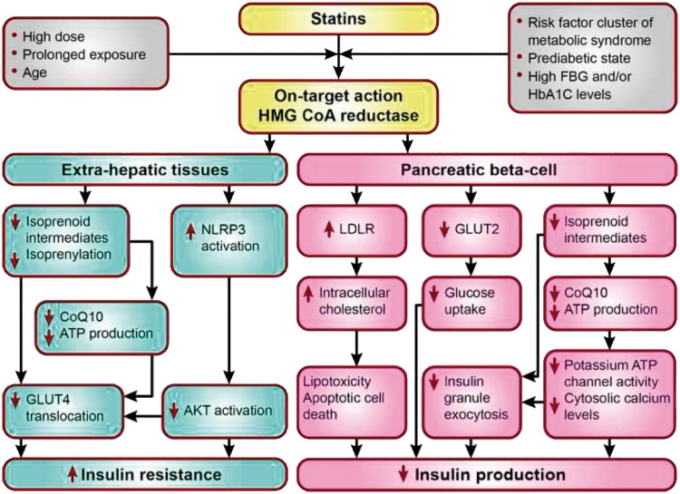
AKT(αセリン-スレオニン-プロテインキナーゼ)ATP(アデノシン三リン酸)CoQ10(コエンザイムQ10,別名ユビキノン)FBG(空腹時血糖)GLUT(グルコーストランスポーター)。HbA1c、糖化ヘモグロビン、HMG CoA還元酵素、3-ヒドロキシ-3-メチルグルタリルコエンザイムA還元酵素、LDLR、低密度リポタンパク質受容体、NLRP3,NOD様受容体ファミリー、ピリンドメイン含有3。
あるいは、このグルコースホメオスタシスへの影響は、LDLを介したスタチンのクラス効果である可能性もある。他のLDL低下薬ターゲットであるPCSK934,35とNPC1L1,36の遺伝子変異の保有によるLDL-Cレベル低下に生涯さらされることを評価した3つの大規模な遺伝学的研究では、耐糖能異常のある人に限ってDMのリスクが増加することが示された。PCSK9(proprotein convertase subtilisin/kexin type 9)阻害剤37,38やエゼチミブ39を追加投与してLDL-C値が非常に低くなっても、このような予測されたリスク上昇は今のところ観察されていないが、効果を観察するためには、特に糖尿病発症のリスクが高い人での長期間の薬剤投与が必要であろう。また、家族性高コレステロール血症の原因となるLDLR遺伝子変異を有する人では、糖尿病の発症率が低下することが確認されていることも注目されている40。一方、家族性高コレステロール血症の原因となるAPOB遺伝子変異は、糖尿病との関連は認められなかった41。コレステリルエステル転送タンパク質阻害剤であるアナセトラピブを対象としたREVEAL(Randomized EValuation of the Effects of Anacetrapib Through Lipid-modification)試験では、約10万人年のバックグラウンドのスタチン治療に加えて、LDL-Cが17%減少したにもかかわらず、糖尿病のリスクが低下したことが明らかになっている42。
このように、スタチンはグルコースのホメオスタシスに影響を与え、糖尿病の発症リスクを小さくすることが示唆されている。しかし、スタチン治療の前後に、糖尿病診断のゴールドスタンダードである糖負荷試験を行っていない研究が多いため、注意が必要である。プラバスタチンとピタバスタチンは、DM患者とそうでない患者の血糖値に対する影響は中立であると認識されており、規制当局の表示にも反映されている46,47。
テイクホームメッセージ
- RCTと遺伝子研究から得られた一致したエビデンスによると、スタチン治療は、新規DMのリスクを1年間の投与で1000人あたり約1例とわずかに増加させるが、同時に5つの新規心血管疾患イベントを予防する。
- メタボリックシンドロームや糖尿病予備力の人は、この副作用のリスクが有意に高いが、スタチンを投与せずに糖尿病に移行するケースも多いという。
- ほとんどの研究では、「糖尿病」の診断は、症状を伴わないHbA1c 6.5以上という検査所見に基づいていた。このHbA1cに基づく糖尿病への移行が、長期的な罹患率や死亡率に及ぼす影響については、長期的な追跡調査が必要である。
- スタチンの心血管疾患イベント予防効果は、特にHbA1cが上昇している人の血糖値上昇による潜在的なリスクをはるかに上回るものであることを、患者は安心して受け止めるべきです」と述べている。
認知機能
スタチン治療が認知機能に影響を及ぼす可能性があるかどうかは、特に、糖尿病やインスリン抵抗性に伴う脂質異常症のパンデミックや、認知症の有病率に影響を及ぼす人口動態の変化を考えると、重要な問題である。疫学研究では、コレステロール値の高さとアルツハイマー病のリスクの増加との関連が報告されており48,49,スタチン治療による血管機能の改善は、認知症を引き起こすいくつかの病態との関連で有益であるとの指摘もある50。一方で、スタチン治療によるコレステロール値の低下は、認知機能に悪影響を及ぼす可能性も示唆されている51。しかし、脳血液関門や、脳が内因性のコレステロール合成に関してほぼ自給自足であることを考えると、スタチンが脳に直接影響を与えるという見方は単純である52。
この問題に関するデータの質が様々であることも問題である。ほとんどの臨床試験では、記憶障害などの神経症状に関する患者の自己申告に頼っており、認知機能に関する厳格な客観的検査は取り入れられていない。さらに、試験対象者は認知機能低下のリスクが低く、試験期間も認知機能への影響を観察するのに十分ではなかった可能性がある。さらに、長期的には身体機能の低下に関連することが知られている中年期に存在する要因が、認知機能にも同様に影響を与えるかどうかは見過ごされがちである61-64。
表3 スタチン系薬剤の認知機能への影響を評価したエビデンスのまとめ
| 引用の年 | 研究の説明 | 結果 | 結論 |
|---|---|---|---|
| 2013 53 | 8つの前向きコホート研究のメタアナリシス(n = 57 020および2851の認知症症例) |
|
スタチンの使用は、認知症のリスクの低下と関連していた |
| 2013年54 、55 | RCTとコホート、ケースコントロール研究、横断研究、およびFDAの製造販売後マーケティングデータベースの系統的レビュー | スタチン使用者の間には、次のものがありました。
|
公表されたデータは、認知に対するスタチンの悪影響を示唆していません |
| 2014 56 | 4件のRCTのコクランレビュー(認知症の可能性または可能性のあるn = 1154) |
|
スタチン療法は認知症患者の認知機能の低下を遅らせません |
| 2015 57 | 25件のRCTのメタアナリシス(n = 46 836); 23件のRCTには認知テストが含まれていました(n = 29 012) |
|
スタチン療法は認知障害とは関連していません |
| 2017年39 、58 | IMPROVE-IT(n = 15 281)39フーリエ(n = 25 982)58 |
|
非常に低いLDL-Cレベルは認知機能に悪影響を与えません |
| 2017 59 | エビングハウス; FOURIER研究の前向きネストコホート研究(n = 1204)。認知機能は、ケンブリッジ神経心理学テスト自動バッテリーを使用して前向きに評価されました |
|
低LDL-Cレベルは、19か月にわたって前向きに評価されたように、認知機能への悪影響とは関連していませんでした。 |
| 2017 60 | メンデルランダム化研究:
|
|
PCSK9阻害剤およびスタチン治療を模倣するPCSK9およびHMGCR変異体による低LDL-Cレベルは、アルツハイマー病、血管性認知症、認知症、またはパーキンソン病のリスクに因果関係はありませんでした。 |
CI(信頼区間)EBBINGHAUS(心血管リスクの高い被験者におけるPCSK9結合抗体のcoGnitive HeAlthへの影響の評価)FDA(米国食品医薬品局)FOURIER(リスクの高い被験者におけるPCSK9阻害による更なる心血管アウトカム研究)IMPROVE-IT(急性冠症候群の被験者におけるアウトカムの検討)。Vytorin (Ezetimibe/Simvastatin) vs Simvastatin; LDL-C, 低密度リポ蛋白コレステロール; RCT, 無作為化比較試験。
公表された文献のレビューにおいて、米国食品医薬品局(FDA)は、スタチンが認知症、軽度認知障害、または認知能力の低下の発生率を増加させるという証拠はないと結論づけた54。これにもかかわらず、スタチンの表示は、記憶喪失や混乱などの認知機能の副作用を含むように修正されたが、FDAはスタチンの心血管への有益性がこれらの可能性のある影響を上回ることを強調した54。Heart Protection Studyでは、最終フォローアップ時にTelephone Interview for Cognitive Statusを用いて認知機能を評価したが、認知機能が低下していると分類された患者の割合は、全体でもベースラインの年齢サブグループでも、シンバスタチン群とプラセボ群の間で差がなかった65。さらに、Pravastatin in elderly individuals at risk of vascular disease (PROSPER)試験では、4つの神経心理学的パフォーマンステストを用いて、試験期間中の6つの異なる時点で認知機能を評価したが、平均42ヶ月の追跡期間において、プラバスタチン群とプラセボ群の間で認知機能の低下に差はなかった66。
その後の解析でも、この問題が取り上げられている。25のRCT(23のRCTは認知機能テストを実施)で46,000人以上の患者を対象としたメタアナリシスでは、認知機能が正常な人でもアルツハイマー病患者でも、スタチンの認知機能に対する有意な悪影響は認められなかった57。さらに、1154名のアルツハイマー型認知症患者を対象とした4つの臨床試験を対象としたコクラン・レビューでは、アルツハイマー病評価尺度(Alzheimer’s Disease Assessment Scale-cognitive subscale)および最小精神状態検査(Minimal Mental State Examination)において、スタチンを投与した患者とプラセボを投与した患者の間に有意な差がないことが示されている56。一過性全健忘症は、症例報告でスタチン使用と関連しているとされているが67,これまでのエビデンスを総合しても、因果関係を裏付ける証拠はない。
もう一つの疑問は、スタチンとエゼチミブまたはPCSK9阻害剤の併用により達成される非常に低いLDL-Cレベルが、認知機能に悪影響を及ぼすリスクがあるかどうかである。急性冠症候群を有する被験者のアウトカムを検討する]の事前指定された分析結果
Vytorin (Ezetimibe/Simvastatin) vs. Simvastatin]試験を実施した。39 evolocumabを最長4年間投与したOpen-Label Study of Long-term Evaluation Against LDL-C (OSLER)試験のデータや、alirocumabを最長2年間投与した試験のプール解析結果は、さらなる支持を示している68,69。リスクの高い被験者を対象としたPCSK9阻害による心血管アウトカム研究(FOURIER)試験では、evolocumabと中等度または高強度のスタチン治療を併用することで、非常に低いLDL-C値(0.5mmol/Lまたは20mg/dL未満)を達成した場合でも、プラセボ(スタチン単独)と比較して、神経認知系の有害事象の増加は認められなかった58。
Evaluating PCSK9 Binding antiBody Influence oN coGnitive HeAlth in high cardiovascular risk Subjects(EBBINGHAUS)」試験59では、FOURIER試験に登録された1204人の患者を対象に、平均1.8年間の追跡調査を行い、LDL-C濃度が非常に低い場合の認知機能への影響を評価した。本試験では、Cambridge Neuropsychological Test Automated Battery(CANTAB、http://www.cambridgecognition.com)を使用した。CANTABは、エピソード記憶、ワーキングメモリ、実行機能、精神運動速度、注意力など、さまざまな領域の認知機能を評価するために特別に設計されたコンピュータ評価ツールである。この評価ツールは、言語や文化の違いによる影響を受けないため、多国籍の大規模な臨床研究にも適している。FOURIER試験では、一部の患者で中等度から高度のスタチン治療にevolocumabを追加することで、非常に低いLDL-C値(LDL-C値が最も低いサブグループの四分位範囲0.28〜0.44mmol/L(11〜17mg/dL))を達成した場合でも、試験期間中に認知機能の変化は見られなかった。実際、著者らが報告しているように、各群で見られた経時的な変化は、認知症に先行する軽度認知障害の患者で見られる変化よりも一桁小さいものであった70。
最後に、デンマークの一般集団であるCopenhagen General Population StudyとCopenhagen City Heart Studyの111 194人を対象としたメンデルスラー無作為化試験では、PCSK9とHMGCRの変異株に関連した低LDL-Cレベルは、アルツハイマー病、血管性認知症、あらゆる認知症、パーキンソン病のリスクに因果関係はなかった(表表33)。 60 International Genomics of Alzheimer’s Projectによる、LDL-C低下に関連するPCSK9,HMGCR、その他の変異株のアルツハイマー病リスクに関するサマリーレベルのデータも同じ結論を支持している60。
テイクホームメッセージ
- スタチン治療は、認知機能に悪影響を及ぼさない。
- スタチンとエゼチミブまたはPCSK9阻害剤の併用により達成された非常に低いLDL-Cレベルでは、認知機能に悪影響を及ぼすシグナルは見られなかった。
- PCSK9阻害剤やスタチンを模倣したPCSK9およびHMGCRの変異株による低LDL-Cレベルは、アルツハイマー病、血管性認知症、すべての認知症、パーキンソン病のリスクに因果関係を及ぼさないという結果が、メンデリアン・ランダマイゼーションによる解析で支持された。
腎機能への影響
親水性のスタチンであるプラバスタチンとロスバスタチンを除いて、スタチンは肝臓で代謝され、腎臓での排出は最小限に抑えられる。The Kidney Disease: 71 重度の腎機能障害があり、集中的にスタチン投与を受けている患者では、推定糸球体濾過量に基づいて投与量を減らすことが賢明かもしれない。
慢性腎臓病患者を対象とした研究はほとんど行われていないが、最近のメタアナリシスでは、スタチン治療が慢性腎臓病患者、特に軽度の腎臓病患者の心血管疾患リスクを減少させることが示されている。72,76-78 CKDにおいてスタチンが心血管疾患イベントを20%減少させることを考えると、79 このことから、ガイドラインでは、透析患者を除く慢性腎臓病患者にスタチン治療を推奨することになる。
軽度の蛋白尿(多くの場合、一過性)は、高用量のスタチン治療で低頻度に見られるが、腎機能の低下とは関係ない(既報80,81)。これは、HMG-CoA還元酵素の阻害およびエンドサイトーシスに関与するタンパク質のプレニル化の減少に関連した、アルブミンの尿細管再吸収の減少が原因であると考えられる82,83。しかし、潜在的な懸念は、高用量スタチン治療が急性腎疾患のリスクを増加させるかどうかである84。 -86 1997年から 2008年の間に新たにスタチン治療を受けた200万人以上のスタチン使用者(慢性腎臓病患者59,636人)を対象としたあるレトロスペクティブ分析では、高用量スタチン治療と中用量スタチン治療の開始後120日以内の急性腎障害の発生率が34%高いことが報告されているが、この傾向はスタチンの曝露期間が長くなると弱まった。84 このレトロスペクティブな分析結果は懸念を抱かせるかもしれないが、RCTのデータではリスクの増加は示されていない。さらに、慢性腎臓病患者に焦点を当てた多くのメタアナリシスでは、スタチン治療によるCKDの進行や急性腎イベントの増加は認められなかった87。実際、スタチンには腎保護作用があり、CKDの進行を遅らせる可能性が示唆されているが、88-94,他の研究ではそのような腎機能への効果は明らかになっていない75,79,95。
テイクホームメッセージ
- スタチン治療は、臨床的に有意な腎機能の悪化とは関連しない。
- 重度の腎機能障害を有する患者がスタチンの集中投与を受けている場合には、推定糸球体濾過量に基づいて投与量を減らすことが賢明であろう。
- 腎臓に対するスタチンの保護効果を否定することはできないが、さらなる研究が必要である。
肝機能への影響
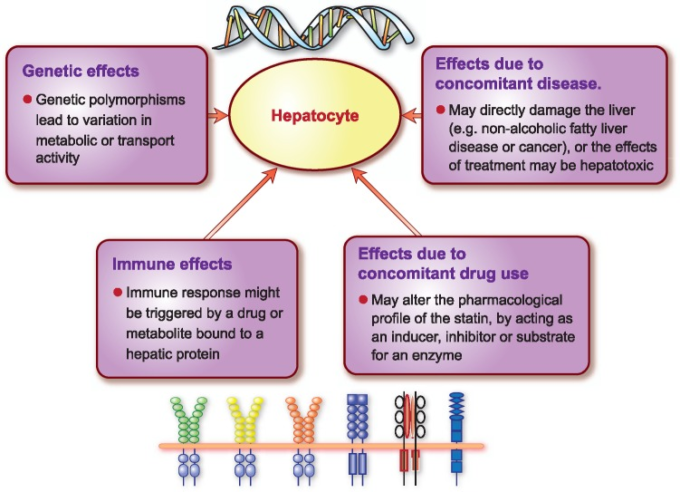
スタチンに関連した重篤な肝障害の極めて稀なケースにおけるスタチンの役割を決定することは困難である。薬剤性肝障害(DILI)は、急性肝不全の最も頻繁な原因であり、欧米諸国では肝移植が必要とされている96。DILIの最も一般的なバイオマーカーは、アラニンアミノトランスフェラーゼ(ALT)アスパラギン酸アミノトランスフェラーゼ(AST)ガンマーグルタミルトランスフェラーゼ(GGT)血清総ビリルビン、アルカリホスファターゼ(ALP)である。 97,98 肝細胞の損傷は一般的に血清 ALT または AST の上昇によって検出され、ALP の上昇は胆汁排泄管の細胞の損傷を示し、血清総ビリルビンまたは共役ビリルビンの上昇は肝臓の排泄機能の低下を示します96。ほとんどの場合、DILIは稀であり、特異的であり、予測不可能である。さらに、正確な診断を妨げる可能性のある遺伝的、後成的、環境的、臨床的要因があるため、DILIの頻度を推定することは困難である。99,100 これらの相互作用する要因に加え、スタチン系薬剤に関連する重篤な肝毒性はまれであることから、DILIにおけるスタチン系薬剤の役割を評価することは困難であるとされている。
図3 薬物代謝または輸送機構に影響を及ぼすことにより、薬物による肝障害の感受性に影響を及ぼす可能性のある要因
肝酵素の上昇
軽度の肝トランスアミナーゼの上昇は、スタチン系薬剤を服用した患者の0.5~2.0%に認められ、通常、治療開始後3ヵ月以内に発生する。1,2,101 246,000人以上の患者を対象とした135件のRCTを対象としたシステマティック・メタアナリシスでは、スタチンは対照薬またはプラセボと比較して、トランスアミナーゼ上昇のリスクが約50%高いことが報告されている。アトルバスタチン、ロバスタチン、シンバスタチンには明確な用量反応関係が認められた。これらの上昇は一過性のものであり、通常は治療を続けることで正常化します102。14,000人以上の患者を対象とした49の試験を分析した結果、アトルバスタチン10mg、アトルバスタチン80mg、プラセボを投与した患者の0.1%,0.6%,0.2%に肝トランスアミナーゼの持続的な上昇(>3×正常上限(ULN))が認められたと報告されている(表44)103。
表4 スタチン治療が肝機能に及ぼす可能性のある有害作用に関するエビデンスのまとめ
| 引用の年 | 研究の説明 | 結果 | 結論 |
|---|---|---|---|
| 2006 103 | 49件の試験の遡及的プール分析(n = 14 236); 患者はアトルバスタチン(10mgまたは80mg)またはプラセボで治療されました |
|
スタチン療法による臨床的に関連するトランスアミナーゼの上昇はまれです。より高い用量は、トランスアミナーゼ上昇のより高いリスクと関連しています |
| 2013 102 | 135件のRCTのネットワークメタアナリシス(n = 246 955) |
|
|
| 2009 104 | スウェーデンの副作用諮問委員会(1998–2010) | トランスアミナーゼ上昇が> 5×ULNおよび/またはALP上昇が> 2×ULNの症例のみが含まれていました
|
スタチンによる肝障害は非常にまれです |
| 2016 105 | 英国の一般診療データベース(1997-2006) | シンバスタチンまたはアトルバスタチンの最初の処方があり、肝疾患、アルコール関連の診断、または肝機能障害の既往のない患者の評価データ。中等度から重度の肝毒性は、ビリルビン>60μmol/ L、トランスアミナーゼ> 200 U / LまたはALP> 1200 U / Lとして定義されました。
|
|
| 2011 97 | FDA有害薬物イベント報告システムデータベース |
|
ALPはアルカリホスファターゼ、LTはアラニンアミノトランスフェラーゼ、CIは信頼区間、FDAは米国食品医薬品局、RCTは無作為化比較試験、ULNは正常範囲の上限値。
さらに、Joint Task Forceのガイドラインでも強調されているように、スタチン治療の心血管への効果は、潜在的な安全性の問題を上回ると考えられる1,2,108。実際、12万人以上の慢性肝疾患患者を対象とした最新のメタアナリシスでは、スタチンの使用は、肝機能低下および死亡のリスクを低下させ、門脈圧亢進を抑制する可能性があることが示されている109。ただし、B型肝炎ウイルスに感染している患者には、AST、ALT、GGT、総ビリルビンおよびALPの血清レベルが正常化するまで、スタチンを処方すべきではない110。
薬剤性肝障害
スタチン系薬剤に関連した特発性肝障害はまれであるが、重篤な場合もある。薬剤関連の有害事象に関するこれまでの研究では、スタチンがDILI全体の1~3%に関与している可能性が示唆されている。英国の General Practice Research Database (1997-2006) を用いたリアルワールド環境では、105 中等度から重度の肝毒性(ビリルビン>60 μmol/L、AST または ALT>200 U/L、ALP>1200 U/L)が、アトルバスタチン投与群では 0.09%(71/76 411)シンバスタチン投与群では 0.06%(101/164 407)に報告された(アトルバスタチンのハザード比 1.9,95% CI 1.4-2.6,P < 0.001)。105 Swedish Adverse Drug Reactions Advisory Committee (1998-2010)のデータによると、スタチン治療により10万人あたり1.2人の患者がDILI(トランスアミナーゼ上昇>5×ULNおよび/またはALP>2×ULNと定義)を発症したと報告されている。また、回復後の再曝露でも同様のパターンの肝障害が生じてた。しかし、1990年代後半以降、スタチンの処方が増加しているにもかかわらず、FDA Adverse Event Reporting Systemのデータベースでは、スタチン使用による致死的または重度の肝障害の発生率の増加は確認されなかった97。肝移植の必要性(n=11)または死亡(n=37)を含む重度肝障害の報告は75件で、そのうち30件(死亡14件、肝移植7件、重度肝障害9件)がスタチン治療と関連する可能性がある、またはおそらく関連すると評価された。97 米国 National Lipid Association の Statin Liver Safety Task Force による最近のアップデートでは、スタチンによる記録的な肝毒性は依然として非常に稀な事象であると結論付けられている113。
臨床的に明らかな肝障害は、スタチン治療開始後いつでも発生するスタチンのクラスエフェクトであると考えられている114,115。自己免疫性肝炎は、スタチンによる肝障害のDILIとして最も一般的な表現型であろう。スタチンは、HMG-CoA還元酵素に対する抗体を用いて、特発性炎症性筋炎や免疫介在性壊死性筋症12を引き起こす可能性がある。同様のメカニズムで、スタチンに関連した自己免疫性肝炎が引き起こされる可能性がある。
肝酵素の上昇のモニタリング
スタチン治療中に肝酵素を定期的にモニタリングすることは、現在のエビデンスでは支持されていないため、無症状の患者には推奨されていない1,2,116。実際、定期的にモニタリングすることで、ALT、AST、GGT値が単独で上昇した患者を特定し、医師にスタチン治療の減量または中止を促すことができ、その結果、患者は心血管疾患イベントのリスクを高めることになる。しかし、肝毒性を示唆する症状(例えば、異常な疲労感や脱力感、食欲不振、腹痛、濃い色の尿、皮膚や鞏膜の黄変)が現れた場合には、肝機能を測定することが妥当である。ALT値が3×ULN以上(ビリルビン値が新たに上昇した場合はそれ以下)になった場合は、スタチンの投与を中止すべきである。肝酵素の上昇がスタチンによるものだと決めつける前に、他の潜在的な病因を考慮すべきである。
テイクホームメッセージ
- 無症状のスタチン使用者における軽度のALT上昇は、臨床的には意味がない。ステアトーシスまたは非アルコール性脂肪性肝疾患による軽度のALT上昇の患者では、スタチン治療は肝疾患を悪化させない。
- スタチン治療による臨床的に明らかな肝障害は非常に稀であり、スタチンのクラス効果であると考えられる。
- 肝酵素の定期的なモニタリングは正当化されない。
- 肝毒性を示唆する症状が現れた稀な患者では、肝酵素を測定すべきである。
出血性脳卒中
スタチン治療は、LDL-Cが1mmol/L減少するごとに虚血性脳卒中のリスクを26%(99% CI 15-35%)減少させるというRCTによる実質的なエビデンスがある117。スタチンが出血性脳卒中のリスクを増加させる可能性は、脳血管イベントの既往がある8000人以上の患者を対象としたメタアナリシスで示唆されており、出血性脳卒中イベントのリスクが高いことが示された(RR 1.73,95%CI 1.19-2.50)。 120 SPARCL試験では、アトルバスタチンは虚血性脳卒中を減少させたが(アトルバスタチン218件、プラセボ274件)出血性脳卒中は55件対33件と高率に発生した。121 8つのRCT(スタチン治療を受けた患者38 153人)のメタアナリシスでは、出血性脳卒中の絶対数は少なかったものの、到達したLDL-C値と出血性脳卒中のリスクの間に傾向が見られた122。
しかし、248391人の患者を対象としたメタアナリシスでは、RCT(RR 1.10,95%CI 0.86-1.41)コホート研究(RR 0.94,95%CI 0.81-1.10)ケーススタディのデータに基づき、脳内出血のリスクは有意に増加しないことがわかった。 123 さらに、これらの患者を対象としたメタアナリシスでは、脳内出血のリスクとLDL-C低下の大きさとの間に関連性は認められなかった124。さらに、FOURIERでは、LDL-Cの到達レベルが非常に低い場合でも、出血性脳卒中のリスクは増加しなかった58。
テイクホームメッセージ
- スタチン治療は、LDL-Cが1mmol/L減少するごとに、初回または2回目の虚血性脳卒中のリスクを15〜35%減少させる。
- SPARCL試験では、脳卒中の既往がある被験者では出血性脳卒中がわずかに増加することが示唆されているが、このようなLDL-C低下に伴うリスク増加の可能性は、RCT、コホート研究、症例対照研究などの実質的なエビデンスベースの分析では確認されていない。
- 脳血管疾患の既往がある患者では、スタチンの投与方法を変更する必要はない。
白内障
加齢に伴う水晶体の混濁(白内障)は、高齢者の視力低下の主な原因となっている。スタチンの使用がこのリスクを悪化させるかどうかは、潜在的な懸念であった。しかし、白内障の定義が統一されていないことや125,スタチンの服用状況や眼科検診の頻度の影響が考慮されていないなど、方法論上の問題がこの問題の検討を妨げてきた。
観察データや限られた前臨床研究では、白内障とスタチン使用の関連性の可能性が示唆されている126,127。スタチン使用者13262人を含む46249人の米国行政データを傾向スコアでマッチさせて分析したところ、スタチン治療により白内障のリスクがわずかに(9%)高くなることが示された128。
一方で、RCTからのエビデンスは、この問題に関して安心感を与えてくれる。8032人の患者を対象としたEXCEL(Expanded Clinical Evaluation of Lovastatin)試験では、ロバスタチン(40mgまたは20mgを1日1回または2回)またはプラセボに無作為に割り付けられ、48週間の追跡調査で眼の白濁、視力、白内障の抜去に有意な差はなかった131。同様に、無症候性大動脈弁狭窄症で糖尿病、冠動脈疾患、その他の重篤な併存疾患の既往がない患者1873人を対象としたSimvastatin and Ezetimibe in Aortic Stenosis (SEAS)試験(平均追跡期間4.3)では、シンバスタチンとエゼチミブの使用により、白内障のリスクがプラセボと比較して有意に低いことが明らかになった(ハザード比0. 133 その後、コホート試験(n=6,追跡期間は最長5年)症例対照研究(n=6,追跡期間は最長5年)RCT(n=5,追跡期間は0.9~5.4)の患者313 200人を対象としたメタ分析では、スタチンの使用と白内障の発症との間に関連性は認められなかった134。メカニズム的には、スタチンの抗酸化作用と抗炎症作用が白内障の発症を遅らせる可能性が示唆されているが135,136,さらなる研究が必要である。
テイクホームメッセージ
- スタチン治療は白内障の発症とは関係ない。
- 白内障患者であっても、心血管予防戦略の変更は必要ない。
結論
13,15 スタチンは一般的に許容できる安全性プロファイルを有しているが、2 糖代謝、認知機能、腎機能、肝機能、出血性脳卒中や白内障などへの意図しない影響があるのではないかという疑問が提起されている。そこで、本コンセンサス・パネル・ステートメントでは、これらの根強い不確実性を取り上げた。
我々は、スタチン治療は驚くほど安全であると結論づけた。スタチンの長期投与による新規DM発症のリスクはわずかであるが(1,000人あたり約1例/年)5つの新規心血管疾患イベントが回避されるという利点がある。メタボリックシンドロームや糖尿病予備力の患者は、DMのリスクが高いと言われている。しかし、Head-to-Headの研究がないため、スタチンのグルコースホメオスタシスへの影響が異なるかどうかを明確に述べることはできない。スタチンの使用は、認知機能への悪影響や臨床的に顕著な腎機能の悪化とは関連しておらず、脳卒中の既往のない人では白内障や出血性脳卒中のリスクを増加させない。ただし、SPARCLのデータでは、脳卒中の既往のある人ではスタチンが出血性脳卒中のリスクを増加させる可能性が示唆されている。スタチン治療による臨床的肝障害は非常に稀である。
最後に、臨床家は、スタチンの長期的な安全性と、臨床的に重要な副作用のリスクの低さに安心すべきであると述べた。重要なのは、心血管疾患予防と脂質管理に関する最近の欧州ガイドラインの推奨事項1,2を補強することであり、パネルは、スタチン治療の確立された心血管系への有益性がこのような副作用のリスクをはるかに上回ることを強調している(Take home figure)。
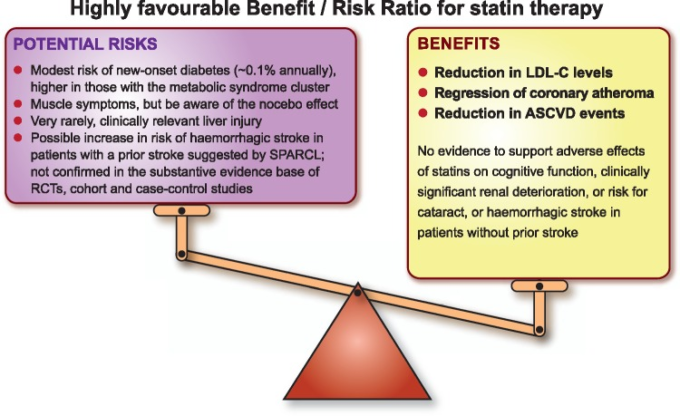
長期にわたるスタチン療法の心血管への有益性は、潜在的なリスクをはるかに上回る。AS心血管疾患(アテローム性心血管疾患)LDL-C(低比重リポ蛋白質コレステロール)RCT(無作為化比較試験)SPARCL(Stroke Prevention by Aggressive Reduction in Cholesterol Levels)。
謝辞
Prism Scientific Sarl社のAliki Buhayer氏による文献研究支援(認知機能サブセクション)に感謝する。
資金調達
パネルはロンドンとバルセロナで、M.J.C.とH.N.G.が議長を務める会議に出席し、本レビューのための文献を包括的かつ批判的に評価し、議論した。これらの会議にパネルメンバーが出席するための資金は,アムジェン,アストラゼネカ,イーライ・リリー,エスペリオン,メルク,ファイザー,サノフィ・リジェネロンから欧州動脈硬化学会に提供された無制限教育助成金によって賄われた。これらの企業は,コンセンサスパネルの会議には出席しておらず,原稿のデザインや内容には一切関与しておらず,最終的な文書に対する承認・不承認の権利も有していない。執筆グループは,F.M.,K.K.R.,O.W.,A.C.,A.L.C.および共同議長で構成された。
利害の衝突 以下の著者は,投稿作品以外の情報開示を報告している。F.M.は,アムジェン,アストラゼネカ,MSDから研究助成金を,アムジェン,アストラゼネカ,MSD,ファイザーからコンサルタントとしての謝礼を受けている。K.K.R.は、サノフィ、リジェネロン、ファイザー、アムジェン、MSDから研究助成金を、サノフィ、アムジェン、リジェネロン、リリー、ザ・メディシンズ・カンパニー、アストラゼネカ、ファイザー、興和、アイオニス、エスペリオン、武田、ベーリンガーインゲルハイムから、講演、諮問委員会、運営委員会メンバーとしての謝礼を受けている。O.W.は、サノフィ、アムジェン、MSD、アストラゼネカから講演の謝礼を受けている。A.C.は、Amgen、Sanofi、Pfizer、Mediolanum Farmaceutici、MSD、Mylan、Recordati、AstraZenecaからコンサルティング料や研究助成金を受けている。A.L.C.は、アムジェン、アストラゼネカ、メルク、レジェネロン/サノフィ、シグマ・タウから所属機関への研究助成金を、アボット、エゲリオン、アムジェン、アストラゼネカ、イーライ・リリー、ジェンザイム、メルク/MSD、マイラン、ファイザー、ロタファーム、サノフィ・レジェネロンから諮問委員会、コンサルタント、スピーカー・ビューローとしての謝礼を受けている。E.B.は、Aegerion社およびAmgen社から研究助成金を受けており、Aegerion社、MSD社、Sanofi社、Amgen社、Unilever社、Chiesa社、Lilly社、Genfit社、AstraZeneca社、Rottapharm-MEDA社、IONIS社、Akcae社、Institut Benjamin Delessert社から諮問委員会、コンサルタント、講演会のための謝礼を受けている。R.A.H.は、アムジェン、ファイザー、サノフィから研究助成を受けている。R.A.H.は、アムジェン、ファイザー、サノフィから研究助成金を、Aegerion、Akcea/IONIS、Boston Heart Diagnostics、Eli Lilly、サノフィ、Valeantからアドバイザリーボード、コンサルタント、スピーカービューローとしての謝礼を受けている。K.G.H.は、アムジェン社、ジェンザイム社、メルク社、ファイザー社、ロシュ社、サノフィ・リジェネロン社から、諮問委員会、コンサルタント、スピーカー・ビューローとしての謝礼を受けている。T.A.J.は、AstraZeneca社、Merck社、Sanofi-Aventis/Regeneron社から研究助成金を受けている。R.K.は、ISIS、Ligand Pharmaceuticals、Madrigal Pharmaceuticals、MedChefs、Merck、Metabolex、Quest Diagnostics、Sanofi-Aventis/Regeneronから研究助成金を受けている。U.L.は、Amgen、MSD、Sanofi、Lilly、Pfizerから、諮問委員会、コンサルタント、スピーカー・ビューローとしての謝礼を受けている。L.A.L.は、Amgen社、Eli Lilly社、Merck社、Pfizer社、Regeneron/Sanofi社、The Medicines Company社から研究助成金を、Amgen社、Eli Lilly社、Esperion社、Kowa社、Merck社、Regeneron/Sanofi社、The Medicines Company社、Aegerion社から諮問委員会、コンサルタント、スピーカー・ビューローとしての謝礼を受けている。W.M.はSiemens Diagnostics社、Aegerion社、Amgen社、AstraZeneca社、BASF社、Berlin Chemie社、Danone Research社、Pfizer社、Numares AG社から助成金および個人的な報酬を、Hoffmann LaRoche社、MSD社、Sanofi社、Synageva社から個人的な報酬を、Abbott Diagnostics社から助成金を、Synlab Holding Deutschland GmbH社からその他の報酬を受け取っている。B.G.N.は,AstraZeneca社,Merck社,Sanofi社,Regeneron社,IONIS社,Dezima社,Amgen社,およびKowa社から,講演および/またはコンサルタント料を受け取っている。F.J.R.は、南アフリカのヨハネスブルグにあるウィットウォーターズランド大学から研究助成金を、ヘテロ接合型およびホモ接合型家族性高コレステロール血症の被験者を対象としたevolocumabおよびalirocumabの臨床試験を実施するための費用を、ファイザー、アムジェン、サノフィ/リジェネロンから諮問委員会、コンサルタント、講演会のための謝礼および非資金援助を受けている。M.R.は、ベーリンガーインゲルハイム、ノバルティス、アストラゼネカ、ニュートリシア・ダノンから研究助成金を受けており、ノボ、サノフィ、メルク、ポクセル、リリーから諮問委員会、コンサルタント、スピーカービューローとして謝礼を受けている。R.D.S.は、AstraZeneca社、Biolab社、BristolMyersSquibb社、Amgen社、Aegerion社、Genzyme社、Boehringer-Ingelheim社、ISIS社、Nestle社、Novo-Nordisk社、Sanofi/Regeneron社、Pfizer社、Merck社、Unilever社、Novartis社から、諮問委員会、コンサルタント、および/またはスピーカー・ビューローとしての謝礼を受けている。E.A.S.は、PCSK9阻害剤の開発に関連して、アムジェン、リジェネロン、サノフィ、ロシュ/ジェネンテックから、またスタチン製剤に関連して、アストラゼネカから、ささやかなコンサルタントとしての謝礼を受けている。E.S.S.は、Amgen、Merck、IONIS、Chiesa、Sanofi/Regeneron、Atheraから所属機関への研究助成金を受けている。L.T.は、アボット社、アクテリオン社、アムジェン社、アストラゼネカ社、バイエル社、メルク社、マイラン社、ノバルティス社、ファイザー社、レコーダティ社、サノフィ・レジェネロン社、セルヴィエ社から研究助成金、および/または諮問委員会、コンサルタント、講演会のための謝礼を受けている。J.K.S.は、Aegerion社からコンサルタントとしての謝礼を受けている。H.N.G.は、サノフィ・リジェネロン、アムジェン、メルクから諮問委員会、コンサルタント、スピーカー・ビューローのための助成金および謝礼を、ファイザー、アストラゼネカ、ブリストルマイヤーズスクイブから諮問委員会、コンサルタント、スピーカー・ビューローのための謝礼を受けている。M.J.C.は、MSD社、興和社、ファイザー社、ランドックス社から研究助成金を、アムジェン社、興和社、メルク社、サノフィ社、セルヴィエ社、リジェネロン社、ユニリーバ社からコンサルタント/講演の謝礼を受けている。G. D.B.、B.G.、P.D.T.、G.D.V.は、利益相反を報告していない。
