Contents
- 要旨
- 1.背景
- 2.進化的背景-ヒトゲノムのトランスポーザブルエレメント
- 3.過去の分析結果の概要
- 3.1.ハムスター腫瘍および形質転換細胞におけるアデノウイルス12型ゲノムの推移
- 3.2.頓挫した感染ハムスター細胞におけるAd12 DNAの統合を研究するためのモデルシステム
- 3.3.アデノウイルスの生産性感染したヒトの細胞では何が起こるのか?
- 3.4.統合型Ad12 DNAがde novo CpGメチル化される。- Ad12DNAメチル化レベルとウイルス遺伝子の遺伝活性の間に逆相関がある
- 3.5.プロモーターのメチル化はプロモーターのサイレンシングにつながる
- 3.6.外来DNAの統合が細胞ゲノムにもたらす結果
- 3.7.アデノウイルスベクターDNAの組込み
- 3.8.SARS-CoV-2 RNAが逆転写してゲノムに組み込まれた?
- 3.9.アストラゼネカ社製SARS-CoV-2ワクチンChAdOx1に使用されているチンパンジーアデノウイルスベクターに関するコメント
- 4.結論
- 競合する利害関係の宣言
- 謝辞
pubmed.ncbi.nlm.nih.gov/34087261
Adenoviral Vector DNA- and SARS-CoV-2 mRNA-Based Covid-19 Vaccines: Possible Integration into the Human Genome – Are Adenoviral Genes Expressed in Vector-based Vaccines?
2021年6月1日オンライン公開
PMCID: PMC8168329
PMID:34087261
要旨
SARS-CoV-2を引き起こすCOVID-19に対する積極的なワクチン接種プログラムは、この恐ろしいパンデミックと戦うための大きなチャンスである。現在行われているワクチンは、アデノウイルスDNAベクターやSARS-CoV-2のmRNAに依存しており、DNAに逆転写されることはまれである。
ある社会では、外来DNAがヒトに注入されることによる短期的あるいは長期的な副作用の可能性に対して、人々は敏感になっている。私の研究室では、哺乳類(ヒト)の細胞や生物における外来DNAの運命について、長年にわたって研究してきた。このレビューでは、得られた結果の概要を紹介する。
この概要は、数百万年前のヒト以前のゲノムへのレトロトランスポゾンの挿入という進化的な文脈の中で語られている。さらに、アデノウイルスベクターベースのDNA、食物由来のDNAの運命、SARS-CoV-2 RNA/DNAの長期残留に関する研究についても説明する予定である。
ウイルスDNA分子とアデノウイルスベクターDNAの実際の統合は、おそらく偶然の出来事であり、その頻度やエピジェネティックな影響は確実に評価することはできない。
このレビューでは、アデノウイルスベースのベクターに残存するアデノウイルス遺伝子発現の問題や、ワクチンの副作用における役割についても触れている。最終的には、ワクチンに関連した外来DNAのゲノム挿入や、ベクターに運ばれたアデノウイルス遺伝子発現の未知のレベルの起こりうるリスクと、COVID-19の危険からの保護とを比較検討することになるであろう。
生命を脅かす病気に対するワクチン接種を支持する判断は、慎重であるように思われる。生物学の複雑さを一般の人々に伝えることは、ワクチン接種について個人的な決断を迫られたときに、信頼できる指針となるであろう。
キーワード
アデノウイルスDNAの哺乳類ゲノムへの組み込み、アデノウイルスベクターDNAのヒトゲノムへの組み込み、ベクターDNAにおけるアデノウイルス遺伝子の発現、アデノウイルスベクターDNAおよびRNAベースのSARS-CoV-2ワクチン、外来DNA組み込みのエピジェネティックな結果、SARS-CoV-2 RNAのDNAへのレトロトリクシス
1.背景
現在承認されているSARS-Coronavirus-2に対するワクチンのいくつか(AstraZeneca/Oxford University、Johnson & JohnsonのJanssen COVID-19 Vaccine、Sputnik V)は、SARS-COV-2スパイクプロテインの遺伝情報のキャリアとして、アデノウイルスDNAベクターに基づいている。BioNTech/ファイザー社やモデルナ社が製造するワクチンには、このタンパク質を合成するためのメッセンジャーRNA(mRNA)が含まれている。ワクチンを注射すると、このmRNAが直接ワクチン接種者のウイルスのスパイクプロテインの合成を誘発する。したがって、哺乳類(ヒト)の細胞や生物における外来(アデノウイルスやSARS-CoV-2の逆転写)DNAの運命に対する人々の関心は、深刻かつ広範囲になっている。人々の懸念は、時折個人的な出会いの中で、「ワクチンは私の遺伝子に入るのだろうか」というような表現で語られてきた。このような問題に対して、一般市民は科学的な情報の全容を知る権利があるという考え方に、筆者は賛同する。今回紹介する外来DNAの組み込みとその結果に関する過去の実験結果は、一般の人々の関心事であるこれらの問題についての有益な最新情報を提供するものである。この概要では、哺乳類細胞における外来DNAの運命、宿主ゲノムへの統合の可能性、トランスゲノム細胞への潜在的な影響について説明する(Doerfler, 2000,Doerfler et al., 2018)。依然として拡大している世界的なSARS-CoV-2パンデミックに直面して、この情報は、生命を脅かすCOVID-19(新型コロナウイルス感染症)に対するアデノウイルスDNAベクターベースまたはmRNAワクチンの利点に対して、バランスを取らなければならない。ヒトのアデノウイルスがヒトの腫瘍形成に因果的に関与しているという証拠はないが、特にベクターベースのワクチンについては、この可能性も断定的に排除することはできない。
さらに、Ad12誘導ハムスター腫瘍では、腫瘍細胞におけるAd12ゲノムの持続は、Ad12誘導腫瘍の形質転換状態の維持に必要ない(Kuhlmann et al., 1982)。後述するように、エピジェネティックな因子がアデノウイルスの腫瘍形成に大きな役割を果たす可能性があり、その効果が支配的であるためには、トランスゲノムが長期間持続することは必須ではない(Doerfler et al., 2018、Heller et al., 1995).
アデノウイルスベクターDNAまたは逆転写SARS-CoV-2メッセンジャーRNAの統合が、ベクター導入細胞の機能性と生存に及ぼす長期にわたる後遺症の可能性は、個々のケースにおいて確実に予測することができない。しかし、COVID-19のパンデミックの現段階では、私たちの活動は、適切なワクチンと将来の治療手段でパンデミックと戦うことに集中しなければならないだろう。
2.進化的背景-ヒトゲノムのトランスポーザブルエレメント
3×109ヌクレオチドペアのヒトゲノムのほぼ50%がトランスポーザブルエレメント、8%が内在性レトロウイルスゲノムを構成している。この遺伝的事実の重要性は、分子遺伝学の研究において積極的に反映されることはなかった。どうやら、現在のヒトゲノムの大部分は、進化の過程で、外来DNAやRNAレトロウイルスゲノムから再転写されたDNAの統合によって、徐々に挿入されてきたようだ。最近の解析では、繰り返し要素はヒトゲノムの66%から69%に相当することが明らかになった(De Koning et al 2011)。
外来DNA配列は、エピジェネティックなメカニズム、すなわち外来DNAのメチル化やヒストンメチル化戦略の変化により、頻繁に不活性化されるようになった。このような古代の統合イベントは、6,000万年から7,000万年前まで遡ると推定されており、もしかしたらもっと古いかもしれない。その存在とその範囲は、外来DNAのゲノムへの挿入が、進化の初期に出現した初歩的なメカニズムによって促進され、進化の推進に大きな役割を果たした可能性が高いという考えを裏付けるものである。
今日でも、これらの古代の統合体の選択された部分は転写されることができ、その発現レベルの程度については個体間差がある。さらに、内在性レトロウイルスエレメントに存在する制御エレメントやDNA-タンパク質相互作用の認識部位は、その機能が十分に理解されていない。ヒトの生物にとってのその重要性は推測するしかない。内在性レトロウイルス配列の一部は、SARS-CoV-2を含むウイルス感染だけでなく、ヒトの腫瘍や自己免疫疾患でも過剰発現することがある。また、加齢に伴い内因性レトロウイルスが制御されなくなるという証拠もある。ジャンクDNAとして過小評価されがちなこれらの配列の生物学に関する概説が最近発表された(Geis and Goff, 2020)。
3.過去の分析結果の概要
アデノウイルスベクターの研究は、アデノウイルスDNAが受容細胞のゲノムに「統合」されないので安全であるという根拠のない主張が前提になっている。この解釈には確かな根拠がない。それゆえ、私たちの研究および他の研究者の研究の以下の概要は、この考え方に異議を唱えている(Doerfler et al., 1984)。過去の遺伝子治療法(Samanathan et al, 2020)および現在アデノウイルスベクターベースのSARS-CoV-2ワクチンで遭遇した問題は、アデノウイルスベクターシステムが内包する欠点を徹底的に再評価する必要があるだろう。もちろん、無傷のアデノウイルスDNAと一部欠損したベクターDNAの運命は、同じ細胞内統合組換え機構にかかるとはいえ、異なる点もある。また、ワクチン接種で投与されるアデノウイルスベクターDNAの量(約2.5μ)は、遺伝子治療で投与される量に比べれば少ない。アデノウイルスベクターDNAは主に肝臓の細胞に到達すると考えられており(Stephen et al, 2010)、おそらく免疫系の細胞にも到達すると思われる。
3.1.ハムスター腫瘍および形質転換細胞におけるアデノウイルス12型ゲノムの推移
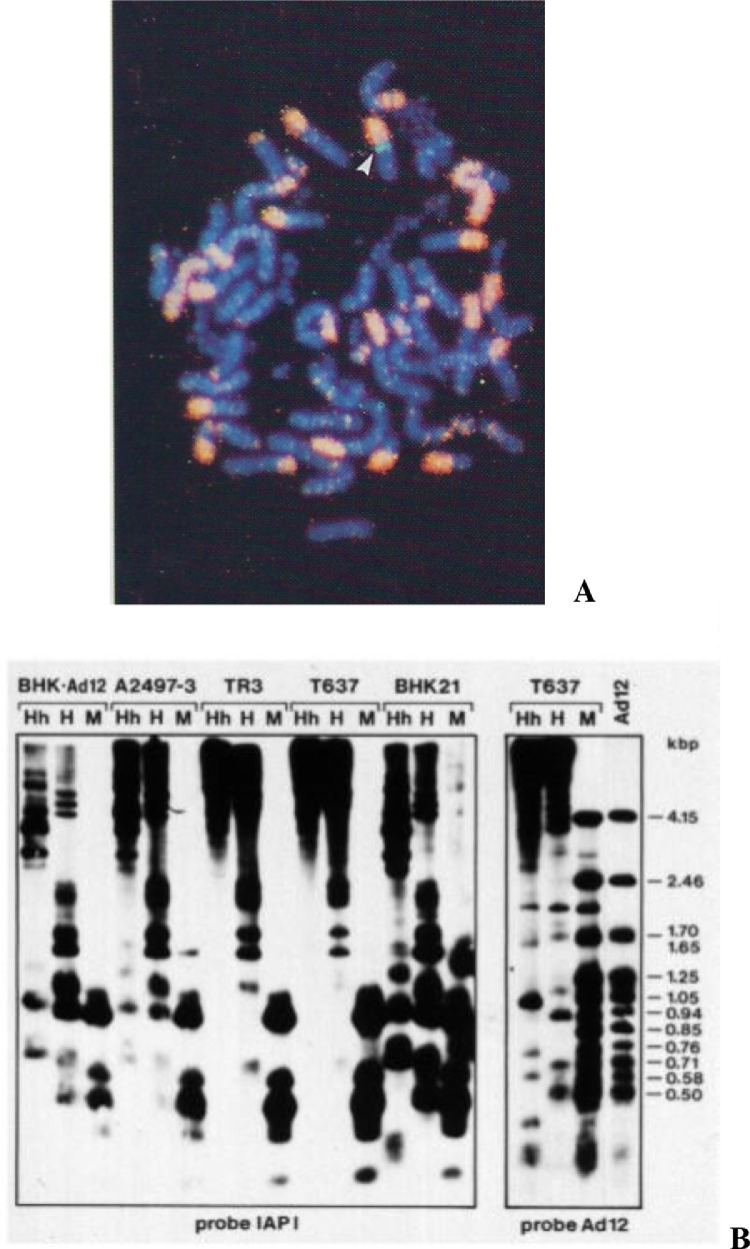
- ヒトアデノウイルス12型(Ad12)は、ウイルス接種した新生児シリアンハムスター(Mesocricetus auratus)の70〜90%に原始神経外胚葉性新生物を誘導する(Trentin et al. 1962;Hohlweg et al. 2003)。Ad12誘導ハムスター腫瘍細胞株T637のAd12 DNAは、異種組換えにより10〜12コピーで組み込まれ、ランダムに選ばれた1つのゲノム部位に頻繁に組み込まれた(図1A、緑、白矢印)。しかし、ヒトのアデノウイルスのいずれもがヒトの腫瘍形成に関与していることを示す証拠はない。
図1 ハムスターゲノムへの外来DNAの挿入により、IAPレトロトランスポゾン配列の約900コピーにおける細胞内DNAメチル化プロファイルが変化する。変化したメチル化パターンは、トランスゲノムが失われた後も維持される。
[A】Ad12を導入したハムスターのT637細胞核のin situハイブリダイゼーションでは、染色体に統合されたAd12 DNA(Ad12DNAプローブ、緑、白矢印)が約10~12コピー可視化される;IAPプローブ(ピンク)~ハムスター染色体の短腕に頻繁に存在するIntracisternal A Particleレトロトランスポゾンゲノム900コピー;細胞内のDAPI染色(青)である。
[B】(右から左へ)Ad12(ヒトアデノウイルス12型);T637(Ad12を導入したBHK21ハムスター細胞);BHK21(ベビーハムスター腎臓細胞株);T637.TR3(T637細胞株の復帰株で、もともと10〜12個あった統合ウイルスゲノムコピーをすべて失ったもの(PCRで確認);A2497-3はT637細胞とは別のAd12形質転換ハムスター細胞株;BHK°Ad12、Ad12に頓感染したBHK21ハムスター細胞(Doorfler,1969,Hochstein et al.,2008).32P標識DNAハイブリダイゼーションプローブは、エレクトロフェログラムの下部に、Ad12またはIAP(右から左へ)と指定した。
異なるDNAサンプルにおけるCpG DNAのメチル化レベルは、メチル化感受性(HpaII、HhaI)またはメチル化非感受性制限エンドヌクレアーゼ(MspI)による切断の違いによって評価された:MspIは5´-CCGG-3´および5´-CmCGG-3配列を切断し(メチル化感受性)、HpaIIおよびHhaI(メチル化感受性)は5´-CmCGG-3´サイトを切断しない。その結果、Ad12トランスジェニック細胞株T637とA-2497-3では、CpGメチル化配列が明らかに増加し、HpaIIとHhaIで切断されていないIAP DNAが大量に存在することが明らかになった(ディスプレイの上部)。T637細胞由来の復帰細胞株TR3も、Ad12トランスゲノムの全コピーを失っていたにもかかわらず、IAP DNAメチル化の増加を示している(PCR確認)。どうやら、IAPレトロトランスポゾンDNAへの導入遺伝子の挿入によるエピジェネティック効果(IAP DNAメチル化の増加)は、トランスエピジェネティック効果を惹起した導入遺伝子が失われた後も持続しているようだ。これらの図は(Heller et al., 1995)から引用した。
- 58個の独立したAd12誘導ハムスター腫瘍において、ウイルスDNAの複数コピーが、ランダムに選ばれた1つの細胞統合部位に統合されたが、これらの部位のゲノム上の位置は、クローン由来の個々の腫瘍間で異なっている。さらに2つの腫瘍では、Ad12 DNAの統合部位は、腫瘍細胞ゲノムの2つの異なる部位にそれぞれ位置した。各腫瘍において、統合されたAd12 DNAは、de novoCpG-methylatedになっていた(Hilger-Eversheim and Doerfler, 1997)。
- アデノウイルスで形質転換されたまたはAd12で誘導されたハムスター腫瘍細胞の分析において、統合体のウイルスDNAと細胞DNAの間の共有結合を確認するために、統合されたアデノウイルスDNAと隣接する細胞DNAの間の多数の接合部位の分子クローニングおよび配列決定に重きが置かれた(Deuring et al. 1981a;Stabel, Doerfler, 1982;Gahlmann et al. 1982;(Deuring and Doerfler, 1983)Doerfler et al., 1984,Schulz et al., 1987).挿入のメカニズムは、非相同組換えのそれと似ているか、同じであるように思われた。アデノウイルスDNAの末端と、挿入の隣接部位における標的細胞配列の間には、短く、しばしばパッチ状の配列相同性が存在した。いくつかの例では、統合されたウイルスDNAに隣接するレシピエント細胞DNA配列は転写的に活性であった(Schulz et al., z87)。試験的研究において、ウイルスDNAと細胞DNAの間の挿入組換えは、ハムスター核抽出物からの無細胞系において、以前に同定された挿入前の細胞DNA配列とアデノウイルスDNA末端部分を組換えパートナーとして用いて再構成された(Jessbergerら1989)。組換え産物を反応から再クローニングして分析したところ、アデノウイルスで形質転換した細胞からのものに似た特徴を示した(Tatzelt et al. 1992)。
3.2.頓挫した感染ハムスター細胞におけるAd12 DNAの統合を研究するためのモデルシステム
- 当時、Ad12-ハムスター腫瘍系は、Ad12と宿主細胞の相互作用を調べるための強力なモデルとして認識されていた。Ad12はハムスター細胞に異常感染し、ウイルスDNAの複製が完全にブロックされ、細胞の核に到達するウイルスゲノムの数が少ない(Doerfler, 1969;Zock and Doerfler, 1990,1995; Hochstein et al., 2008])。したがって、ウイルスDNA複製と後期遺伝子発現のこのブロックのために、Ad12はハムスター細胞で複製することができず、ウイルスDNAの統合と腫瘍形成のための必須前提条件を満たした。一連のモデル実験[Doerfler, 1968, 1970]において、5-ブロモデオキシウリジン(5-BU)であらかじめ標識した細胞DNAを持つハムスター細胞に、3H-チミジン-DNA標識したAd12ウイルスを大量に接種した。アルカリ性(pH >13)のCsCl平衡浮力密度勾配遠心分離により、軽いAd12 DNAと5-BU標識の重い細胞性DNAを物理的に分離することができた。感染後約12時間から、3H-チミジン-DNA標識Ad12は、Ad12 DNAの軽い密度の位置から重い細胞性DNAの位置にシフトし始め、感染後の時間と共に徐々にそうなった。密度シフトしたDNAのAd12真偽は、DNA-DNAハイブリダイゼーションにより確認した。さらに、Ad12に感染したハムスター細胞のDNAを超音波処理すると、3H-チミジンタグAd12と5-BU重細胞性ハムスターDNAの間のアルカリ安定性(pH13)の結合が破壊された。その後、3H標識Ad12 DNAはウイルス密度の高い位置またはその近くに移動し、3H標識Ad12 DNAと5-Bu-heavy cellular DNAの結合が解除されたことが示された。これらの結果は、Ad12と哺乳類細胞DNAの間の組換え統合を記録した最初のものであった(Doerfler、1968、1970)。
3.3.アデノウイルスの生産性感染したヒトの細胞では何が起こるのか?
- アデノウイルス2型(Ad2)またはAd12を用いたヒト細胞の感染について検討した。ヒトのアデノウイルスDNAは、生産的に感染したヒト細胞においても、細胞DNAと再結合することができるという証拠がある。アデノウイルスと細胞性DNAの間の推定組換え体である、沈降が速くpH13以上のアルカリ安定なウイルスDNAは、最初に本物のAd12 DNAと、次にヒト細胞性DNAとハイブリダイゼーションする連続DNA-DNAハイブリダイゼーション実験によって証明された(Shic et al. 1976).
- さらに、Ad12に感染したヒト細胞では、塩基配列解析により、Ad12 DNAの左端2,081塩基と細胞DNAのかなりの回文との間に自然に生じる対称的な組換え(SYREC)が発見されている。ハイブリッド分子の末端Ad12 DNA断片にアデノウイルスのパッケージングシグナルが存在するため、ウイルス粒子への封入が容易であった。この発見は、生産的に感染したヒト細胞においてもAd12と細胞DNAとの間の組換え体の形成を明確に裏付けるものであった(Deuring et al., 1981b, Deuring and Doerfler1983)。SYREC Ad12 DNA-細胞回文DNA分子の構造は、高いペイロードを持つガットレスアデノウイルスベクター分子をどのように構築しなければならないかについてのガイドとして役立った。
- 他の研究室では、in situハイブリダイゼーション実験から、慢性的に感染したヒトのアデノイド細胞にヒトアデノウイルスDNAが残存していることが証明された(Neumann et al. 1987)。さらに、潜在的にアデノウイルスに感染したヒトリンパ球細胞株では、アデノウイルスゲノムも同様に残存していた(Zhang et al.2010)。しかし、いずれの系でも、残存するウイルスゲノムの分子状態については、それ以上検討されていない。
3.4.統合型Ad12 DNAがde novo CpGメチル化される。- Ad12DNAメチル化レベルとウイルス遺伝子の遺伝活性の間に逆相関がある
- Ad12で誘導されたハムスター腫瘍細胞およびAd2またはAd12で形質転換したハムスター細胞では、統合されたウイルスDNAは特定のパターンでde novoCpGメチル化され(Sutter et al. 1978)、それは特定の方法でウイルス統合体に広がる傾向がある(Toth et al. 1989)。DNAメチル化のレベルとAd2またはAd12ゲノムの特定領域の遺伝的活性との間の逆相関の実証は、文献上最初のものであり、哺乳類細胞におけるCpG DNAメチル化の生物学的機能を解明するための私たちの研究の長期にわたる取り組みの始まりとなった(Sutter and Doerfler、1980;Vardimon et al.、Doirfler、1983)。その後、多くの真核生物において、遺伝的抑制とプロモーターCpGメチル化の特定のパターンとの間のこの逆相関は、一般的に重要であることが確認された。
3.5.プロモーターのメチル化はプロモーターのサイレンシングにつながる
- 異なる真核生物のプロモーターと指標遺伝子を用いた一連の実験において、特異的なプロモーターメチル化がこれらのプロモーターの不活性化を引き起こすことを記録した(Vardimon et al. 1982;Kruczek and Doerfler, 1983;Langner et al. 1984)。さらに、哺乳類ゲノムにおける特定のCpGメチル化パターンは、長期的な遺伝子不活性化のシグナルとして解釈できる(Doerfler, 1983;2006)。この研究についてのより詳細な説明は、このレビューの範囲を超えてしまうため、ここでは紹介しない。
3.6.外来DNAの統合が細胞ゲノムにもたらす結果
- 外来DNAを宿主ゲノムに組み込むと、宿主染色体の遺伝子が破壊され、突然変異が起こる可能性があるとの議論がしばしばなされてきた。確かにその可能性はあり、実際に報告されているケースもある。しかし、ヒトゲノムには1.1%のエクソン、24%のイントロン、75%の遺伝子間DNAが存在する(Venteret al.2001)ことを考えると、外来DNAを組み込んで機能する遺伝子にヒットする確率は約1/100となる。一方、外来DNAの挿入がもたらす結果についての解析では、統合遺伝子座に近い部位と遠い部位の両方が関与するエピジェネティック効果の役割を重視してきた(下記参照)。外来DNAの統合の後遺症のこの側面は、私たちの研究室からの以前の研究の話題だった(Heller et al, 1995;Weber et a., 2015,2016;Doerfler et al, 2018)。
- ウイルスDNAの挿入部位では、隣接する細胞DNAのCpG DNAメチル化レベルが低下していた。したがって、外来DNAの統合は、挿入部位のすぐ近くで、細胞DNAのエピジェネティックなシグナルをシスで変化させることができた(Lichtenberg et al. 1988)。
- しかし、変化はトランスでも起こりうる。10〜12コピーのウイルスDNAが1つの染色体部位にゲノム的に組み込まれたAd12形質転換ハムスター細胞[図1Aの緑、白い矢印で強調]では、細胞内の細胞質内A粒子(IAP)レトロトランスポゾンDNAの約900コピーにおけるCpGメチル化レベル[図1 Aのピンク]が、形質転換していないハムスター細胞やAd12形質転換ハムスター細胞と比較して、著しく増加した[図1 B]。1A]のCpGメチル化レベルは、形質転換していないハムスター細胞やAd12感染ハムスター細胞と比較して著しく増加した(図1B;Heller et al. 1995)。IAP配列のCpG DNAメチル化レベルの増加により、そのDNAはHpaIIやHhaIのようなメチル化感受性制限エンドヌクレアーゼによる切断に抵抗性を示し、切断産物の電気泳動分析では移動しなかった(図1B)。IAP配列は多くの染色体に分布しており、その短腕に頻繁に位置している[図1Aのピンク色のシグナル]。Ad12 DNAを導入したハムスター細胞におけるCpG DNAメチル化のトランス効果というこの発見は、ヒト細胞における外来DNA挿入の影響について事前に設計された調査を促した(下記参照)。
- 図1のBで説明した実験では、IAP CpGメチル化プロファイルに対するトランスゲノム効果は、Ad12トランスゲノムの継続的な存在に依存せず、細胞株TR3では、以前に統合されたAd12ゲノムをすべて失ったものの、持続した(図1B;Hellerら1995)ことを強調しておくことが重要である。したがって、例えばヒトの腫瘍細胞や慢性疾患を持つ人の細胞でアデノウイルスゲノムが見つからないということは、アデノウイルスDNAの統合や他の外来DNAがこれらの疾患の病因に大きな役割を果たしていないことを必ずしも意味するものではないという議論は成り立たない。トランスゲノムDNAの持続は、トランス効果(例えば、レシピエントゲノムや細胞の形質転換状態)の維持に必要な前提条件ではない。
- トランスジェノミックヒト細胞におけるエピジェネティックトランスエフェクトのさらなる研究のために、以下の一連のパイロット実験が開始された。5.6kbpの細菌プラスミドをトランスジェノミックしたヒト細胞のクローンラインにおいて、遺伝子チップマイクロアレイシステムを用いて、転写およびCpGメチル化パターンをトランスジェノミック細胞クローンとそうでないクローンの間で比較した。解析した28.869遺伝子のうち4.7%において、トランスジェノミッククローンでは転写活性が異なる形でアップレギュレートまたはダウンレギュレートされていた。ゲノムワイドプロファイリングでは、トランスジェノミッククローンと非トランスジェノミッククローンで調べた48万以上のCpGサイトのうち3791カ所でメチル化の差があることが確認された。これらのデータから、ヒトゲノムに外来DNAを挿入すると、細胞のCpG DNAメチル化および転写プロファイルが顕著に変化することが示された。実際、異なる細胞タイプが進化したようである(Weber et al. 2015;Doerfler et al. 2018)。外来DNA挿入のこれらのエピジェネティック効果は、(ヒト)ゲノム全体のエピジェネティックな安定性と機能に関わるため、非常に重要であると考えている。生物学や医学における多くの実験的アプローチは、トランスゲノム細胞や生物の研究に頼っているため、実験データの現実的な解釈において、外来DNA挿入に伴う、頻繁に疑われることのないエピジェネティック効果を考慮する必要がある。
- 前述のトランス効果は、ヒトゲノムのすべての部分に影響を与えないという点で、特異的であると思われた。ヒトゲノムの約8%を構成する内因性ヒトレトロウイルス(HERV)配列のメチル化プロファイルは、ゲノムの他の部分で明確なメチル化変化を明らかにした同じ細胞クローン(Weber et al.2015)において変化しないままであった。同じ実験プロトコルにさらされたトランスジェニック細胞とコントロール細胞におけるHERV DNAメチル化パターンはほぼ同じであった(Weberet al.)
- 環境中の外来DNAの役割に関する研究を発展させ、私たちは実験用マウスに食べさせた外来DNAの運命を探った。食物から摂取された外来DNAは、ヒトの臓器が外来DNAと最も多く、かつ定期的に遭遇するものであると考えられる。バクテリオファージM13のDNA、プラスミドでクローニングした緑色蛍光タンパク質(GFP)遺伝子、または植物特異的な核DNAにコードされたリブロース-1,5-ビスリン酸カルボキシラーゼ(Rubisco)の遺伝子を、多くの異なる実験においてマウスに経口投与した。投与されたDNAの約1%が断片化した状態でマウスの消化管を通過し、さらに少量ながら動物の脾臓と肝臓を中心とするさまざまな臓器系に辿り着くことができた。ある実験では、脾臓細胞から取り出した試験DNAが、マウスのIgEレセプター遺伝子と70%の相同性を持つ80ntのDNAセグメントとつながっていることを証明することができた(Schubbert et al. 1997).マウスの生殖細胞系列は、食物由来のDNAの侵入から保護されているようである〔(Hohlweg and Doerfler, 2001)〕。したがって、確率的に関与する哺乳類の細胞では、食物由来のDNAへの暴露がゲノムの安定性に対して継続的な挑戦である可能性が高いと思われる。ヒトにおけるこの問題については、私たちは何も情報を持っていない。
3.7.アデノウイルスベクターDNAの組込み
- ドイツ・ウルム大学のStefan Kochanekの研究室では、アデノウイルスベクターを介した遺伝子導入をきっかけに、アデノウイルスベクターのDNAが染色体に組み込まれるかどうかを調べるパイロット研究をマウスで行った[Stephen et al.2010].異なる導入遺伝子を持つ複製不全アデノウイルスベクターをマウスに静脈内注射した。トランスジーン発現肝細胞では、ベクター構造がマウスゲノムに組み込まれていることが確認された。ベクターと細胞DNAの接合部位を解析した結果、ベクター末端とマウス細胞DNAは、6.7×10-5の頻度で異種組換えにより共有結合していた。相同組換えは、100倍低い頻度で同定された(Stephen et al.)これらの結果を評価した著者らは、アデノウイルスベクターのDNAがレシピエントゲノムに組み換わる異種組み換えの頻度は、哺乳類細胞における自然突然変異の頻度に匹敵すると示唆した。もちろん、どのような要因で「自然変異」が誘発されるかは未解決の問題である。中でも、ヒトのDNAと外来のDNAとの組換えは、自然突然変異の発生に重要な役割を果たす可能性がある。最後に、アストラゼネカ社のワクチンなどで日常的に筋肉内に投与されるビリオン包装されたアデノウイルスベクターDNAの量は、多くの遺伝子治療レジメンの量よりも少ない(ワクチン1用量あたり50×109ビリオン、1用量あたり約2.5μgアデノウイルスベクターDNAに相当する)。詳細はhttps://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/963928/UKPAR_COVID_19_Vaccine_AstraZeneca_23.02.2021.pdfを参照してほしい。
3.8.SARS-CoV-2 RNAが逆転写してゲノムに組み込まれた?
COVID-19の生存者におけるSARS-CoV-2 RNAの長期間の排出とRT-PCR検査の陽性継続に関する報告に動機づけられ、ZhangらはSARS-CoV-2 RNAがDNAに逆転写され、それがホストゲノムに統合されてRNAに転写され続ける可能性について調査した(Zhang et al., 2021).塩基配列解析により、著者らはCOVID-19患者の約10〜20%のゲノムにSARS-CoV-2 DNAコピーを観察した。このSARS-CoV-2 DNAは、標的部位重複とコンセンサスLINE-1エンドヌクレアーゼ認識配列によって挟まれていた。後者の2つの特徴は、常に観察されるわけではなかった。したがって、SARS-CoV-2 DNAの統合には、LINE-1とは無関係なメカニズムも考えられる。SARS-CoV-2DNAのサブゲノム部分のみが統合されていることが強調された。このような統合は、断片化したウイルス性SARS-CoV-2 DNAを保有する者が感染性ウイルスを産生する可能性を排除する。SARS-CoV-2DNAの統合部分は、頻繁に転写されていた。著者らは、SARS-CoV-2感染によって、内因性のLINE-1レトロトランスポゾンをコードした逆転写酵素が合成される可能性があると結論付けた。これらの酵素は、DNAのレトロトランススクリプトを生成した。このDNAの断片のみがヒトゲノムに挿入され、SARS-CoV-2 RNAに転写された可能性がある。この発見は、SARS-CoV-2感染によるCOVID-19患者のゲノムの長期的な後遺症という文脈で意味を持つかもしれない。さらに、世界中で成功したと言われているRNAベースのワクチンも、この点で精査する必要がありそうだ。今回のような予期せぬ発見は、他の研究者によっても再現されなければならない。おそらく、ここで述べた発見は、他のRNAウイルス病原体に影響する同様のメカニズムに関する研究を刺激することになるだろう(Zhang et al., 2021)。
3.9.アストラゼネカ社製SARS-CoV-2ワクチンChAdOx1に使用されているチンパンジーアデノウイルスベクターに関するコメント
AstraZeneca SARS-CoV-2ワクチンChAdOx1の設計に使用されてきたチンパンジーアデノウイルスベクターの構造とウイルスバックボーンの転写に関する詳細は、最近発表された(Almuqrin et al. 2021)。このベクターでは、アデノウイルスゲノムのE1領域の非特定部分が、SARS-CoV-2スパイクプロテインのコード配列で置換された。したがって、このベクター構築物は複製不全である。ベクター構築物におけるSARS-CoV-2スパイクプロテインの発現は、真核生物の強力なプロモーターの一つであるTet応答性CMV [cytomegalovirus] プロモーター(Loewら2010)の制御下で仮定されていた。しかし、このベクターは、さらに、特に後期チンパンジーアデノウイルス遺伝子の28kbpをまだ保持している(Almuqrin et al.2021)。それらの転写活性は、おそらく構築物に残っているE1領域のセグメントの遠隔制御下にまだあるかもしれない。ベクターでコントロール感染させたヒト細胞株によって、アデノウイルスウイルスバックボーン遺伝子が異なるレベルで発現していることが判明した。チンパンジーアデノウイルスのどの遺伝子がヒトのワクチン接種者で実際に発現しているのか、またアデノウイルスの発現プロファイルがワクチン接種者の違いによってどのように異なるのかは、現在のところ不明である。これまでのところ、世界中で観察されているワクチンの副作用に対するアデノウイルスの後期遺伝子産物の因果関係は調査されておらず、否定することはできない。したがって、アデノウイルスベクターの使用により、統合やエピジェネティックな後遺症による長期的な問題が生じる可能性があることに加え(上記参照)、アデノウイルスベクターは依然としてウイルス遺伝子産物を発現しており(Almuqrin et al. 2021)、ヒトワクチン接種者に危険な副作用を誘発する役割が批判的に評価されていないことが問題である。
ヒトワクチン接種者におけるChAdOx1アデノウイルス遺伝子発現の程度と性質に関する情報は提示されていない。ChAdOx1 E1領域のトランス活性化機能がない場合、ワクチン接種者の生体内の細胞内トランスアクチベーターが後期ChAdOx1ウイルス遺伝子の発現を促進する可能性がある。これらのChAdOx1遺伝子のヒトアデノウイルス遺伝子との短い配列相同性は、ワクチン接種者の記憶免疫応答を個々に異なる強さで引き起こすのに十分であると考えられる。また、ヒトアデノウイルス感染症に罹患した幼少期に近い若年層では、記憶免疫応答が強くなる可能性がある。社会で患者や高齢者の世話をしている若い女性は、このような免疫学的過剰反応の影響を受けやすく、したがって、ワクチン接種の副反応に見舞われる頻度も高くなるかもしれない。なぜ血小板がこのような記憶性免疫反応の標的となるのか、その理由はまだ解明されていない。この文脈では、遺伝子治療応用の過程でアデノウイルス-ベクター構築物のレシピエントにも血小板減少が見られたことを思い出すことが必須となるだろう(Lopez-Gordo et al, 2017)。
アデノウイルスベクターを扱う研究者は、1999年のJesse Gelsinger事件[https://en.wikipedia.org/wiki/Jesse_Gelsinger]を知っている。当時、X連鎖性遺伝性代謝疾患である肝臓のオルニチン・トランスカルバミラーゼ欠損症を患う18歳の男性が、アデノウイルスベクターを用いた遺伝子治療体制の最初のレシピエントとなり、組み換えアデノウイルス適用後数日後に死亡した。当時、致命的な結果に関与した可能性のある要因を調査したが、明確に特定することはできなかった。この事件により、遺伝子治療におけるアデノウイルスベクターの使用は長期に渡って中止された。ごく最近、この致命的な事件に関する詳細な、明らかに継続的な調査が行われ、アデノウイルス-抗体複合体の生成がレシピエントの生体における「致死的な全身性炎症」の一因とされた(Somanathan et al.2020)。もちろん、1999年の遺伝子治療対策に採用されたヒトアデノウイルス5型(Ad5)ベクターと、2021年のSARS-CoV-2ワクチンに採用されたチンパンジーアデノウイルスベクターを直接比較することはできない。しかし、Ad5由来のベクターは、他のSARS-CoV-2ワクチンの一部である。したがって、アデノウイルスベクターをヒトに注射する際には、細心の注意を払う必要がある。願わくば、過去の大惨事が、現在のベクターで再現されないことを祈る。長い目で見て、より慎重に検討すれば、スパイクプロテインを用いた従来のワクチンの方が安全な選択であったかもしれない。
4.結論
生命は、DNAの世界で発展していた。私たちは皆、このDNAの世界で生きている。私たちは自宅の庭を掘ると、無数の微生物とそのDNAが、動物や植物の腐敗した残骸の中に埋もれている。毎年、葉っぱが落ちるのを考えてみてほしい。私たちは毎日の食事で、外来のDNAを大量に摂取している。このDNAは一瞬で一塩基に消化されることはなく、一過性に断片化され、人間の体内に入り、さまざまな器官系に分布することが可能である。DNAは非常に安定した分子である。5万年前のネアンデルタール人の骨の破片には、ネアンデルタール人のDNA断片が今日まで残っている。Svante Pääboらが調査したネアンデルタール人の発掘骨標本では、ネアンデルタール人のDNAは、分析した骨標本のDNAの約0.5%にすぎなかった(Prüfer et al. 2017)。いざというとき、外来DNAとその生存能力、そして生物由来のDNAとの組換え能力が、進化に大きな役割を果たしたのかもしれない。私たちが惑星地球でCOVID-19のパンデミックに苦しんでいる間、探査機Perseveranceは惑星火星で有機物腐敗の痕跡を掘っている。
この簡単なレビューは、COVID-19から保護するとされるワクチンにアデノウイルスベクターDNA(AstraZeneca、Johnson & Johnson、Sputnik Vなど)やSARS-CoV-2 RNA(BioNTech/Pfizer, モデルナ)が含まれていることによる潜在リスクについて独自の、よりバランスのとれた議論を促進するためにここに示された。もちろん、ベクターベースのワクチンをヒトの三角筋に注射することは、上記のような実験系で外来とヒトのDNA間の組換え現象につながるまれな偶然の出来事とは別の問題である。さらに、稀なベクター統合イベントの結果の種類も頻度も、現時点では現実的に評価することはできない。対照的に、BioNTech/Pfizerワクチンが提供するCOVID-19に対する保護の利点に関する最近発表された結果は有望である(Dagan et al., n21)。しかし、どのワクチンも、英国、南アフリカ、ブラジル、インドで発生したより危険な新型SARS-CoV-2(現在それぞれα、β、γ、δと呼ばれている)、あるいは世界中でウイルスの複製レベルが十分に制御されていないことから将来発生するかもしれない未知の変異体に対してどの程度防御できるかについてはまだわからない(Weber et al., 2021)。最後に、COVID-19の長期化した遅発性症状の発現に対するワクチン防御について、私たちは無知である。
このレビューで紹介した情報は、将来のワクチン接種者がリスクとベネフィットの評価、すなわち、アデノウイルスベクターまたはSARS-CoV-2 RNA逆転写DNAの低頻度の統合イベントと、うまくいけば高いワクチン効果および防御を比較検討するのに役立つだろう。さらに、SARS-CoV-2感染自体がウイルスRNAの逆転写物の統合と関連し得るので(Zhang et al., g21)、この一連のイベントは、あらゆるSARS-CoV-2感染で避けられないものになるかもしれない。最後に、ヒトの三角筋にベクター-ワクチンを注入した際に、アデノウイルス遺伝子産物がSARS-CoV-2スパイクプロテインとどの程度共発現するかは、まだ調査されていない。実際に発現した場合の生体への影響については、現時点では把握できていない。生命と進化は、最初から「偶然のメカニズム」に影響されている可能性が高いため、チャンスとリスクは、同時に、絶対的な制御の期待を超えて残っている。COVID-19の症例において、SARS-CoV-2のDNAがヒトゲノムに組み込まれたことを示唆するRT-PCR検査の結果が長期間にわたって陽性であったという臨床的な観察結果は、COVID-19に対するワクチン接種による効果に比べ、ワクチンによる組み込み事象に関する懸念を非現実的なものにしている。2021年の人類は、近年では前例のない規模の生物医学的危機に直面しており、COVID-19に対する現時点での最善の対策であるワクチン接種を受け入れなければならないだろう。
4.1.改訂で追加された注記
前例のないパンデミックの最中、効率的なSARS-CoV-2ワクチンの迅速な開発は、実験科学に対する安堵と賞賛に包まれた(Sahin et al., 2021)。とはいえ、何十億人もの人間にワクチンを注射した場合に起こりうる後遺症を考慮することは、医学的に理にかなっていることが証明されるだろう。アストラゼネカの組換えアデノウイルスChAdOx1-Sの1回分0.5mlには、チンパンジーアデノウイルス26(Ad26)の5×1010粒子(https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/963928/UKPAR_COVID_19_Vaccine_AstraZeneca_23.02.2021.pdf)が含まれており、組換えAd26チンパンジーDNA約2.5μgに相当するとされている。アデノウイルス粒子は、おそらくリンパ系や肝臓の細胞に取り込まれ、そのDNAは細胞の核に輸送されるだろう。このレビューでは、アデノウイルスのDNAがレシピエントゲノムに挿入された証拠とその結果について紹介した。
- (アデノウイルスベクターベースのワクチンは、アデノウイルスDNAを未知の頻度で統合し、予測不可能なエピジェネティックな影響をもたらす可能性がある。ワクチン接種後、数年経ってからエピジェネティックな影響に気づくこともあり得る。
- (アデノウイルスベクターDNAに残存するアデノウイルス遺伝子が細胞因子によってトランス活性化され、ワクチン接種後の一過性の症状として被接種者が経験する、個々に異なる免疫記憶反応につながる可能性があること。極端な免疫反応による致命的な結果は、幸いにも非常にまれな出来事である。
- (iii) SARS-CoV-2のRNAやスパイク遺伝子のような断片が、LINE-1にコードされた逆転写酵素などによって逆転写され、こうして合成されたDNAがワクチン接種者のゲノムに未知の頻度や位置で組み込まれる可能性がある。もちろん、すべてのSARS-CoV-2感染で同じことが言える。したがって、SARS-CoV-2感染に伴うSARS-CoV-2 RNA逆転写物の望ましくない統合事象のリスクは、mRNAベースのCOVID-19ワクチン接種に伴うものと同様であると考えられる。
これらの基礎生物学のメカニズムは、世界中のヒトへの大量ワクチン接種プログラムの文脈で考慮されなければならない。これらのメカニズムが、将来、医学において主要な役割を果たすかどうか、またどのように果たすかは、批判的なメタアナリシスによって追認されなければならない。現在のところ、何十億人もの人間にワクチンを接種することに代わる実行可能な方法はない。現在、人類は、巨大な実験の中で、外来DNAへの曝露に参加している。世界的なワクチン接種が完了したら、ワクチン接種後のセンチネル・プログラムを立ち上げ、ワクチン接種を受けた人たちが予期せぬ、おそらく新種の、人間の病気を悪化させるのを監視する必要がある。
競合する利害関係の宣言
著者は利益相反がないことを宣言している。
謝辞
Rudolf Jaenisch, Whitehead Institute for Biomedical Research, Cambridge, MA, USAに感謝し、彼らの原稿Zhang et al.Natl. Acad.Sci.、USA、2021、オンライン、出版前に私に利用できるようにした。W.D.の研究室での研究は、ボン・バッド・ゴデスベルクのDeutsche Forschungsgemeinschaft (SFB 74 and SFB 274)、ケルン分子医学センター (CMMC, TP13)、ケルンのThyssen Foundation (Az. 10.07.2.138 plus a. stipend to Cologne)によって支援を受けている。Naumann Az. 40.12.0.029)、ニュルンベルクのStaedtler Stiftung(WW/eh 01/15)、バンベルクのDr. Robert Pfleger Stiftung、Friedrich-Alexander University, Erlangen-Nürnbergの臨床分子ウイルス学研究所におけるW. D.のEpigenetics Groupによる継続的支援により、このような研究が行われている。最近のSARS-CoV-2変異体の解析(Weber et al.