Contents
www.sciencedirect.com/science/article/pii/S1568163720302580
ハイライト
・COVID-19の患者で加齢に伴う併存疾患を持つ患者は予後が悪い。
・腸内細菌叢の異常は、加齢や加齢に伴う疾患と関連している。
・ウイルスが介在するACE2の脱落は、RAS依存性のメカニズムにより、悪い転帰を促進する。
・ウイルスが媒介するACE2の脱落は、RASに依存しない腸内環境の異常によって不良な転帰を促進する。
・COVID-19のACE2と腸内細菌叢に基づく治療の可能性
要旨
コロナウイルス病19(COVID-19)は、新型コロナウイルスSARS-CoV-2によって引き起こされるパンデミック状態である。典型的な症状は発熱、咳、息切れで、肺炎の臨床像へと発展し、最終的には死に至る。吐き気や下痢も同様に頻繁にみられ、ウイルス感染または消化管-腸管系を介した感染を示唆している。
SARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)を受容体として用いてヒト細胞に感染し、宿主細胞の感染時に膜貫通型プロテアーゼによって切断され、その活性が低下する。ACE2は、レニン-アンジオテンシン系(RAS)の関連するプレーヤーであり、アンジオテンシンIIの有害な効果を打ち消す。
さらに、腸内ACE2はアミノ酸トランスポーターB0AT1のシャペロンとして機能している。腸管上皮におけるB0AT1/ACE2複合体が腸内細菌叢(GM)の構成と機能を調節していることが示唆されており、病原体であるウイルスに対する局所的・全身的な免疫応答に重要な影響を与えている。
特に注目すべきは、ACE2+成熟ヒト腸球におけるSARS-CoV-2の生産的感染と患者の腸内微生物叢異常が最近実証されたことである。
本レビューでは、ACE2機能の異常と、既存の加齢に伴う合併症を有するCOVID-19患者の予後不良(重症度および死亡率の上昇)とを関連づけるエビデンスを概説し、腸内微生物叢 dysbiosisの役割の可能性を論じている。記事は、これらの経路に基づいた治療の機会で締めくくられている。
1. 序論
コロナウイルス(CoV)は、コロナウイルス科(ニドビラレス目)のOrthocoronavirinae亜科(ニドビラレス目)に属する、表現型および遺伝子型的に多様なウイルスの大家族である(Banerjee et al 2019)。
鳥類および哺乳類におけるエンゾチック感染はより一般的であるが、コロナウイルスはここ数十年の間にヒトにも感染している(Schoeman and Fielding, 2019)。
この種の壁を越えた後のコロナウイルス感染の致死率は、2002年の重症急性呼吸器症候群(SARS)の発生、2012年の中東呼吸器症候群(MERS)の発生に続いて、それぞれSARS-CoVおよびMERS-CoVに端を発した(Coleman and Frieman, 2014; Zumla et al 2015)ことで実証されているように、高い。
2019年12月、中国湖北省武漢市で原因不明の肺炎の症例が初めて報告され、その後、新規コロナウイルスSARS-CoV-2が原因であることが確認された(Lai et al 2020;Zhou et al 2020b)。
呼吸器飛沫または感染者との直接接触を介したヒトからヒトへの感染の証拠が確認され、この新しいコロナウイルス感染はさらにCOVID-19(Lai et al 2020; Li et al 2020c)と命名され、2020年3月11日に世界保健機関によって進行中のコロナウイルスパンデミックとして認識された。このウイルスは、ほぼすべての国に急速に広がり、すでに何百万人もの人に感染し、何十万人もの死者を出している。COVID-19の症状は通常、ウイルス曝露から2~14日後に現れ、通常は発熱、咳、息切れ、肺炎などを含む。重症化すると、呼吸器、肝臓、消化管、神経学的合併症を示すことが多く、最終的には入院と死亡に至ることが多く、以前のSARS-CoV/MERS-CoV感染症と比較すると致死率に若干の差がある(Meo et al 2020年; Siordia、2020)。
現在、SARS-CoV-2感染のための登録された治療法またはワクチンはなく、ウイルスの複製および伝播を停止または遅らせるための新しい解決策が急務となっている。ワクチンを開発する努力とは別に、現在、別個の抗ウイルス剤、免疫調節剤または抗炎症剤の薬物再利用、ならびにSARS-CoV-2のヒト細胞への侵入のための機能的受容体であるアンジオテンシン変換酵素2(ACE2)を標的とする薬物を含む、いくつかの治療オプションが評価されている(Li et al 2020b; Sanders et al 2020; Shanmugaraj et al 2020; ZhangおよびLiu、2020)。
ACEのホモログであるACE2は、レニン-アンジオテンシン系(RAS)の負の調節因子として記載されており、Ang II受容体タイプ1(AT1R)を介したAng IIシグナル伝達によって媒介される劇症的作用を緩和する(Kuba et al 2013)。
この役割は、心血管系、腎系および肺系に関連するものを含む、RASの過剰活性化に関連する病理学的状態において極めて関連性の高いものである(Cole-Jeffrey et al 2015)。
さらに、ACE2は、中性アミノ酸輸送および腸の恒常性に関連した非RAS関連の役割も示しており、ACE2の発現または機能が損なわれた状態は、腸の不衛生を促進する可能性がある(Perlot and Penninger, 2013)。
これは、COVID-19患者で報告されている吐き気や下痢などの消化管(GI)症状と一致しており、消化管-腸系への影響を示唆している(Kotfis and Skonieczna-Zydecka, 2020)。
腸内細菌叢は、代謝作用、パソビオンに対する構造的保護(すなわち、腸管バリア組成物および透過性の保存)、ならびに宿主免疫の「教育」を含む宿主恒常性のための主要な機能を果たす(Kumar Singh et al 2019;Sekirov et al 2010)。
典型的には、腸管バリアは、内腔から血流への有害物質および微生物の転流を防止する;しかしながら、腸管ミリュウの規制緩和は、腸管バリア透過性の増加および自然免疫系を活性化し、エンドトキシン血症/炎症の状態を促進する微生物叢由来の炎症性成分の通過を含む、腸のジスビオーシスを促進する(Fernandes et al 2019)。
腸内微生物叢(腸内微生物叢)組成および多様性は、加齢を含む多くの要因によって影響を受ける。明らかに加齢に関連した腸内細菌叢の不均衡は、微生物の多様性の変化、プロバイオティクス株(例:ビフィズス菌)の低頻度、および重要な代謝機能を果たし、腸管上皮の完全性の維持に大きな役割を果たす短鎖脂肪酸(SCFA)である酪酸を産生する種の数の減少によって特徴づけられ、ここ数年で強調されている(Mangiola et al 2018)。
したがって、マウンティングエビデンスは、加齢に関連した心血管系、代謝系および腎障害における腸内環境異常のための重要な役割を概説する(Abenavoli et al 2019;Mafra et al 2019;McAleerおよびKolls、2018;Sanchez-Rodriguez et al 2020)。
興味深いことに、COVID-19感染の悪い転帰は、高齢者患者、特に心血管系、代謝系および腎障害の既往を有する患者において観察されており、その場合、疾患の重症度および死亡率はかなり高い(Du et al 2020;Li et al 2020a;Mehra et al 2020;Roncon et al 2020;Shi et al 2020;Siordia et al 2020;Team et al 2020;Wang et al 2020c;Zhou et al 2020a)。
このレビューでは、ACE2の不均衡が加齢に伴う既往症を有するCOVID-19患者における不良転帰の鍵となるプレイヤーであることを指摘するエビデンスを強調し、この相互作用における腸内細菌叢の異常が果たす可能性のある役割を取り上げている。この論文は、これらの経路の調節に基づいた治療の機会で締めくくられている。
2. ACE2の役割の三部作:統一的な視点
2.1. COVID-19を担うSARS-CoV-2受容体としてのACE2
ACE2は、805個のアミノ酸を含むユビキタスなI型膜貫通型糖タンパク質であり、既に同定されている様々な基質を持つモノカルボキシペプチダーゼ触媒活性を示する。全長ACE2は、N末端ペプチダーゼドメイン(PD)とC末端コレクトリン様ドメイン(CLD)から構成されており、単一の膜貫通らせんと細胞内尾で終わる(Guang et al 2012; Yan et al 2020)。
さらに、それは、主にTNF-α変換酵素(TACE、ADAM-17としても知られている)により、アミノ酸716と741の間で切断され、それに続く触媒活性エクトドメインの放出を受けやすい。
ACE2は、主にアンジオテンシンI(Ang I)を非ペプチド(Ang 1-9)に変換し、アンジオテンシンII(Ang II)を血管保護性ヘプタペプチド(Ang 1-7)に変換することにより、ACE活性のカウンターレギュレーターである(Patel et al 2014)。
特筆すべきことに、TACEの過剰刺激は、RASの過剰活性化で絶頂を迎える可能性があり、両方のイベントは、いくつかの心血管系炎症性疾患、すなわち心不全および冠動脈疾患において報告されている(Gooz,2010;Shenら,2018)。
最近、ACE2は、新しいSARS-CoV-2を含むSARSコロナウイルスの機能的受容体として、それらのペプチダーゼに依存しない作用に基づいて大きな関心を集めている。
SARS-CoV-2 は、コロナウイルスの名前の由来となっている冠状スパイク(S)糖タンパク質を外表面に有する一本鎖 RNA エンベロープウイルスである。S糖タンパク質は三量体として存在し、2つの機能的サブユニットを表示する:S1サブユニットは、受容体結合ドメイン(RBD)を内包し、宿主ACE2受容体への認識を担う一方で、S2サブユニットは、送信宿主細胞におけるウイルス融合を媒介する融合機械を構成する(AstutiおよびYsrafil、2020)。
ACE2スパイク相互作用は、ウイルス粒子のエンドサイトーシス、およびACE2との内部化を介したゲノム物質のその後の放出を導く。
以前に同定されたSARS-CoVと類似して、SARS-CoV-2スパイクは、不可逆的な構造変化を介して膜融合のためにタンパク質分解的に活性化される必要がある(Walls et al 2020)。
Sタンパク質のプライミング、受容体結合および細胞侵入のための宿主プロテアーゼは、カテプシンL、カテプシンB、トリプシン、因子X、フーリンおよびエラスターゼと同様に、2型膜貫通プロテアーゼセリン2(TMPRS2)を含む(Hoffman et al 2020a;Shang et al 2020a;Wuo et al 2020a)。
したがって、SARS-CoV-2が感受性細胞に侵入するためには、受容体結合およびSタンパク質のタンパク質分解処理の協調的な作用が必要であり、効果的な薬理学的調節のための基礎となるメカニズムを完全に明らかにするための多大な努力がなされてきた。特に、Sタンパク質の前活性化には、受容体を介したエンドサイトーシスとSタンパク質主導のウイルス侵入を促進するためのC末端ACE2の切断も含まれている。このように、膜貫通型ACE2による細胞保護機能の低下は、SARS-CoV-2感染の最初のイベントである。
細胞内に入ると、SARS-CoV-2は複製のメカニズムを活性化し、すなわち、複製転写酵素複合体をコードするウイルスポリタンパク質の合成によって、次いで、そのRNA依存性RNAポリメラーゼによるRNA合成が行われ、ウイルスの組み立ておよびその後の放出に必要な構造生体分子の合成に至る(Chen et al 2020b; Shang et al 2020; Wu et al 2020a)。
2.2. 心血管系、腎系、呼吸器系、GI系におけるRASカウンターバランスとしてのACE2
RAS は、血圧や電解質・液体の恒常性の調節など、局所的な作用と全身的な作用の両方を通じて、さまざまな体の器官(心臓、腎臓、肺など)やシステム(循環器系、腎系)で関連する役割を果たしている(Lambert et al 2010)。
RASは高度に制御されたシステムであり、その主な機能はプロテアーゼのカスケードに由来するいくつかの生理活性ペプチドによって達成される。簡単に説明すると、アンジオテンシノーゲンは、主に肝臓で産生および分泌され、レニン(腎臓の十二分糸球体装置によって産生される)によってAng Iで切断される。AT1Rを介したAng IIシグナル伝達が、組織上の血管収縮作用、親降圧作用、親酸化作用、親炎症作用、および親線維化作用と関連しているのに対し、AT2Rの活性化は、NO、cGMP、またはブラジキニンの参加を伴う血管拡張カスケードによって媒介される反対の作用を有する(Azushima et al)。
発見以来20年以上にわたり、ACE2は多くの面でRASのパラダイムを変えてきた。ACE2遺伝子は、心臓、腎臓、肝臓、上気道、肺、腸など多くのヒト組織に発現している。ACE2は、Ang IIのAng 1-7への変換を触媒し、その内因性オーファン受容体であるMas受容体(MasR)を活性化する生物学的に活性なペプチドであるAng 1-7への変換を促進し、Ang IIに帰属されるものとは反対の多くの効果を促進する(Kuba et al 2013;Santos et al 2013)。
したがって、経時的にACE2/Ang 1-7/MasR軸は、RASにおけるAng IIの生理学的カウンターレギュレーターとして確立された(Patel et al 2016; Zhong et al 2010)。
MasRを介したシグナル伝達とは別に、Ang 1-7は、ACE/Ang II/AT1R軸をさらに打ち消すAT1Rアンタゴニストとしても作用し得る(Gironacci et al 1999)。
この軸の役割は、加齢に伴う心臓疾患、血管疾患、腎臓疾患および呼吸器疾患などのRAS過剰活性化に関連する状態において特別に関連している(Cole-Jeffrey et al 2015;今井 et al 2010;Kuba et al 2013)。
ACE2の保護作用は、i)基質(Ang I)のAng 1-9への分解によるACE作用のダウンレギュレーション、ii)Ang IIの分解促進によるAng II-detrimental作用の低減、iii)MasRを介した、またはAT1Rとの拮抗によるAng 1-7の心保護作用の増強、の組み合わせによってもたらされると考えられている。ACE2/Ang1-7 の有益な効果は、いくつかの動物モデルで報告されており、降圧作用、心不全、虚血・再灌流傷害、心筋梗塞における心筋パフォーマンスの改善、心筋リモデリング、生存率の向上などが報告されている(Wang et al 2012; Zhong et al 2010)。
腎臓では、ACE2は近位尿細管上皮細胞のブラシ境界に発現しており、血圧や塩分・体液の恒常性調節に寄与している(Warner et al)。
ACE2は、糖尿病性腎障害を含むいくつかの腎症モデル動物において、すなわち、Ang IIレベルの低下およびその降圧および血管収縮作用によって、ほとんどの場合、腎保護効果と関連しているが(Batlle et al 2012;Wong et al 2007)、ACE2およびAng 1-7によって誘導される腎障害は、糖尿病性腎症を含む他の実験条件下では、逆説的に報告されており、さらなる解明に値する(Zimmerman and Burns、2012)。
肺では、ACE2 は、Ang II レベルの上昇に対する効果が報告されているのとは対照的に、肺高血圧や肺線維症を改善するようである(Ferreira et al 2009; Li et al 2008)。さらに、RAS活性化は、急性肺損傷および急性呼吸窮迫症候群と関連している(Marshall et al 2002)。興味深いことに、組換えACE2を投与すると、ACE2ノックアウトマウスで観察された重度の急性肺損傷を克服することができた(Imai et al)。
消化管は水分や電解質の摂取・排泄の主要な担い手の一つであるが、消化管におけるRASの役割については、ごく最近になって明らかにされたばかりである。現在、自律的調節に必要なGI管全体にすべてのRAS構成要素(ACE2を含む)が存在することの一貫した前臨床証拠が存在し、GI生理学および病態生理学への関与を支持している(Garg et al 2012;Spack et al 2019)。
実際、局所RASは、グルコース、アミノ酸、体液および電解質の吸収および分泌、血流、運動性および炎症の調節に関与しており、特に、炎症性腸疾患などのGI疾患の有望な標的となり得る(Garg et al 2012)。
全体として、SARS-CoV-2感染時のACE2枯渇によるACE2保護作用の抑制は、高齢のCOVID-19陽性患者、特に心血管疾患、代謝性疾患、腎疾患の既往を有する患者で観察される不良な転帰を維持する可能性が高い。
2.3. 腸内細菌叢に影響を与える腸内アミノ酸輸送の調節因子としてのACE2
現在、ACE2はRAS以外にも重要な役割を果たしていることが認められている。ACE2 の非触媒的でありながら機能的な役割は、分化した小腸上皮細胞や大腸クリプト細胞の腔内表面での構成的な ACE2 発現の観察から初めて仮説が立てられた (Harmer et al 2002)。
ACE2 は、腎臓で中性アミノ酸の輸送を制御する 1 型膜貫通タンパク質であるコレクトリンと相同性が高く(約 50%)、また、ACE2 の発現は、小腸上皮細胞や結腸クリプト細胞の管腔表面で発現していることが確認されている(Zhang et al)。
更なる研究により、ACE2がアミノ酸トランスポーターB°AT1の膜輸送のシャペロンとして機能し、コレクトリンが存在しない場合でも、中性アミノ酸の腸細胞への取り込みをナトリウム依存的に仲介することが確認された(Camargo et al 2009; Kowalczuk et al 2008)。
ACE2-KO動物を用いた研究では、中性アミノ酸、すなわちトリプトファン(トリプトファン)の血清レベルが低下し、小腸抗菌ペプチド(AMP)の発現が低下し、腸内微生物組成が損なわれたことが示されたが、これはトリプトファンの補給により回復した(Hashimoto et al)。
これは、ACE2を介したアミノ酸輸送と腸内微生物の生態を結びつけた最初の研究である。現在、栄養感知や トリプトファン-ニコチンアミド経路を介した mTOR の活性化が AMPs の発現とそれに続く腸内細菌叢の構成を制御していることが提案されている (Hashimoto et al 2012; Perlot and Penninger, 2013)。
また、AMPs(LL-37、デフェンシン、PR-39 など)の使用や腸内細菌叢への影響を伴ういくつかの心血管疾患に対する ACE2 の有益な効果が示唆されている(ikeda et al 2001; Kougias et al 2005; Zhao et al 2012)。
トリプトファン輸送の変化と腸内マイクロバイオータの組成および多様性との関連は、クワシオルコールに関連する栄養失調の前臨床研究および臨床研究の両方でも支持されてきた。実際に、マラウイの農村地域の子供たちは、低タンパク質食のため、成人期にはマイクロバイオータ遺伝子の多様性を発達させることができなかった(Smith et al 2013)。
さらに、彼らの糞便をgnotobioticマウスに移植したところ、栄養失調と腸疾患との関連が確認され、これは、タンパク質またはトリプトファンを含まない飼料を与えたマウスを用いた研究によって補強され、腸内細菌叢異常症と大腸炎を発症した(Hashimoto et al 2012)。
3. 免疫、感染症、心血管疾患をつなぐ腸内細菌叢の役割
3.1. 腸内細菌叢、宿主免疫系、コロナウイルス感染症
ウイルスが宿主に侵入した後、通常、ウイルスは最初に宿主の自然免疫系内の抗原提示細胞(APC)によって認識される。宿主細胞の異なるコンパートメントに位置するいくつかのパターン認識受容体(PRR)は、ウイルスの構造成分および/または中間生成物(例えば、核酸、糖タンパク質、dsRNA)を認識し、総称して病原体関連分子パターン(PAMPs)と呼ばれ、それによって免疫系細胞エフェクターの産生を誘発する(Astuti and Ysrafil, 2020)。
トール様受容体(TLR)、ヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体および/または細胞質RIG様受容体(RLR)は、自然免疫細胞(例えば、形質細胞様樹状細胞)において発現されるPRRのいくつかの例であり、これらは、定型的なI型インターフェロン(I型IFN)応答のような自然抗ウイルスエフェクタープログラムのための主要なウイルスセンサーとして機能する。下流のシグナル伝達カスケードは、宿主マクロファージによるウイルス抗原の貪食を促進し、感染に対する適応免疫応答の発達の編成において主要な役割を果たす(Levy et al 2011;Yi et al 2020)。
実際、APCによって生成されるサイトカイン微小環境は、Th1型適応免疫を調節する。例えば、APCによるCD8+ T細胞のプライミングと活性化は、別個のエフェクター分子(例えば、グランザイムB、ペルフォリン)を介してウイルス感染細胞のアブログを達成する。さらに、CD4+ T細胞は、他の免疫細胞(例えば、マクロファージ)のサイトカイン媒介のTh1偏光細胞プログラムを呼び起こし、ウイルス特異的抗体産生に向けた体液性免疫応答を調節する。要するに、自然免疫細胞とリンパ球の間の複雑な協調が、全身のウイルス感染を制御できるバランスのとれた免疫応答を達成するために必要とされる(Winkler and Thackray, 2019)。
CoVsの感染が宿主免疫応答をどのように調節するかのメカニズムは、類似の形質に従うように見える(Prompetchara et al 2020)。
これまでの研究、特にSARS-CoVおよびMERS-CoV感染に関する研究では、免疫系の過剰反応およびそれに続く「サイトカインストーム」が示されており、悪化した全身性炎症反応およびTNF-α、IL-1β、IL-2、IL-6、IFNα、IFNβ、IFNγ、およびMCP-1の大量放出が特徴である(Channappanavar and Perlman,2017)。
これらの所見は、COVID-19重症例において観察された高レベルのプロ炎症性サイトカイン(例えば、IL-1、IL-2、IL-7、G-脳脊髄液、IP-10、MCP-1、MIP-1AおよびTNF-α)と一致している(Huang et al 2020)。
したがって、いわゆる「サイトカインストーム」は、SASR-CoVおよびMERS-CoV感染症で見られるように、世界的にCOVID-19の劣悪な転帰および死亡率に寄与する可能性が非常に高い。印象的なことに、これらの状態は、主に、免疫産生および炎症の自己増殖ループを表示する慢性的な併存疾患を有する高齢者患者において、多臓器不全によって引き起こされることが多い(Franceschi et al 2017;Fulop et al 2017)。
加齢に関連した心血管疾患、代謝性疾患、および腎疾患は、この助けにならないシナリオに適合する(セクション3を参照)。簡潔に言えば、加齢の結果としての免疫系の適応的変化(immunosenescence)は、しばしば、高濃度の急性期反応物質および炎症性サイトカインが特徴の低悪性度炎症(flammaging)のシナリオに類似している(Fulop et al 2016、2017)。
しかし、ある環境下では、外部要因に対する免疫応答の規制緩和は、特に、感染した病原体に対処している高齢者の場合には、特に関連性を持つようになるかもしれない(Shaw et al 2013)。
注目すべきことに、高齢者において生じる免疫産生と炎症との間のこの相互に維持された状態は、腸内微生物叢の変化によって強く調節される(Amsterdam and Ostrov, 2018; Biagi et al 2012, 2013; Shaw et al 2013)。
宿主免疫系と腸内細菌叢との間の相互作用の理解における大きな進歩は、過去10年間に達成された(BelkaidおよびHand、2014)。
常在菌叢(消化管、口腔、呼吸器、泌尿器、および真皮)が、最適な抗ウイルス免疫応答のための哺乳類免疫エフェクターを組み立てる上で中心的な役割を果たしていることは、現在、十分に確立されている(Chiu et al 2017)。
増え続ける証拠は、微生物関連分子パターン(MAMP)と総称される腸内細菌叢由来のリガンドが、自然免疫および適応性宿主免疫から生じるプロおよび抗炎症応答のバランスのとれた調整に向けてPRRを関与させることができることを強調している(Chu and Mazmanian, 2013)。
このように、病原性または常在微生物由来のシグナルに対する差動免疫学的反応を有する相互に連結された免疫プログラムは、リガンド(PAMPsまたはMAMPs)、細胞型および/または関与する受容体に基づいて、PRRRを発現する細胞を介して生じる(Kawashima et al 2018)。
基礎となる分子経路はまだ十分に確立されていないが、全身性ウイルス感染の間、腸内細菌叢が局所免疫成分および遠位免疫成分を形成する明確なメカニズムが存在する。ウイルス抗原がエンドソームおよび細胞質PRRによって認識される一方で、常在性腸内細菌叢は、ウイルス制御のための中心的な構成要素である遠位の非消化管部位における恒常的なI型IFN依存性免疫応答を設定するのに役立つ(Ma et al 2018; Takeuchi and Akira, 2010)。
第二の重要なトピックは、NF-kBおよび炎症性サイトカイン(例えば、TNF-α、IL-6、IL-1β、およびlL-18)のプロ炎症性サイトカイン(例えば、TNF-α、IL-6、IL-1β、およびlL-18)の炎症性サイトカイン依存性放出を調節する腸内細菌叢の能力に依存しており、これは、ウイルス複製を包囲する免疫不全細胞(例えば、単球、顆粒球、樹状細胞)の遠位リクルートのために重要である(ChenおよびIchinohe、2015)。
適応免疫応答と腸内細菌叢との間の緊密な連携も着実に強調されている。例えば、遠位非消化管部位における二次リンパ組織の発達や、TおよびB細胞(ウイルス特異的エフェクターCD4+およびCD8+ T細胞を含む)の分化・成熟は、腸内細菌叢によって広範囲に形成されている(Chen and Ichinohe, 2015)。
さらに、腸内微生物由来の代謝物は、全身性ウイルス感染の転帰を調節する可能性が非常に高い。それによると、ヒトと関連する腸内細菌Clostridium orbiscendensによって産生される微生物由来の代謝物-デスアミノチロシン-は、おそらくタイプIFN依存性抗ウイルス免疫応答の旺盛なプライミングおよび増幅に起因して、致死的なインフルエンザウイルス感染からマウスを保護することができた(Steed et al 2017)。
同様に、異なる呼吸器ウイルス感染時の宿主免疫の微調整に対する腸(および肺)常在微生物の影響もまた、よく知られている(Grayson et al 2018;Kanmani et al 2017;Wang et al 2013)。
特筆すべきことに、腸内マイクロバイオータ組成物および機能における加齢に関連した変化は、局所(腸)免疫および遠位免疫を深く損なう。例えば、インフラマソーム(腸内マイクロバイオータによって密接に制御されるメカニズム)の全身的なプライミングが加齢とともに増加することが知られている(Fernandes et al 2019)。
したがって、「セカンドヒット」(例えば、ウイルス感染)による完全なインフラマソーム活性化の閾値は、血管や腎臓の患者で報告されていることと類似して、加齢とともに容易に到達するかもしれない(Song et al 2016; Wu et al 2015)。
高齢者患者はしばしば無言の「炎症」状態と免疫性表現型を持っていることを考慮すると、加齢に関連した腸内環境異常は、SARS-CoV-2感染症の場合のように、新たな課題に直面したときに、不均衡な免疫応答と過剰反応性の炎症性表現型を追加的にサポートする可能性がある。SARSおよびMERSの以前のアウトブレイクを見ると、SARS-CoVおよびMERS-CoVが宿主免疫をどのように回避するかのメカニズムは、正統的なI型IFN抗ウイルス応答の阻害に大きく依存している(Prompetchara et al 2020)。
過剰な炎症性表現型(「サイトカインストーム」)に対する不均衡な免疫応答は、肺および重要な器官系に有害な結果をもたらし、高齢のCOVID-19患者を含むCoVs感染症における劣悪な転帰と相関しているようである。したがって、最近強調されたように、年齢に関連したメカニズムが呼吸器SARS-CoV-2感染症をどのように調節するかの深い理解に向けられた新しいバイオマーカーは、COVID-19パンデミックにおいて長期的な利益をもたらす可能性がある(Fuellen et al 2020)。
SARS-CoV-2は、Betacoronavirus属のメンバーとして、潜在的にSARS-CoVおよびMERS-CoVといくつかの免疫回避機構および宿主免疫学的プライミングを共有している。このように、健康な腸内細菌叢は、コロナウイルスのようなウイルス感染症を阻止するための宿主免疫システムのための重要な視点である可能性がある。注目すべきは、腸内微生物叢 dysbiosisが入院したCOVID-19患者で観察され、プロバイオティクス細菌(例えば、ラクトバチルスやビフィズス菌)のレベルの低下に伴う腸内細菌叢の多様性の不均衡によって特徴づけられたことである(Xu et al)。 2020)、
日和見病原菌(例えば、ストレプトコッカス、ロートシア、アクチノミセス)の相対的な豊富さの増加、および有益な共生菌の相対的な豊富さの減少(Gu et al)。 注目すべきことに、腸内微生物叢組成のこれらのシフトは呼吸器症状が消失した後も持続し、COVID-19の重症度と相関していた(Zuo et al 2020)。
全体として、これらの新たな観察は、COVID-19の管理に新たな忠実な洞察をもたらす可能性のあるSARS-CoV-2感染時の腸内細菌叢と哺乳類宿主免疫関係を中心とした研究への道を開くものである(He et al 2020)。
3.2. 腸内細菌叢異常症と心血管疾患、代謝性疾患、腎疾患
前臨床研究および臨床研究から得られたエビデンスの蓄積は、腸内細菌叢の生物学的異常が加齢に関連した心血管疾患、代謝性疾患および腎疾患に関与していることを強く示唆している(McIntyre et al 2011;Miele et al 2015)。
いくつかの研究は、肥満または2型糖尿病を有する患者において、Firmicutes対Bacterioidetes比(dysbiosisのマーカー)の多様性、回復力、および障害された有病率の低下を示した(Burcelin, 2016; Lazar et al 2019)。
簡単に言えば、高カロリー食などの腸内細菌叢の障害を促進する状態は、i)タイトジャンクション密度の低下による腸管バリアの完全性の調節の緩和、およびそれに続くii)細菌断片[すなわち、リポ多糖類(LPS)およびペプチドグリカン(PG)]の腸管腔から血流への転座を引き起こし、低悪性度炎症状態とも呼ばれるエンドトックス血症につながる(Blandino et al 2016; Gomes et al 2019)。(2016; Gomes et al 2017; McIntyre et al 2011)。
)これらのMAMPは、TLRsシグナル伝達、すなわちTLR4を介して、プロ炎症性および免疫応答を引き起こし、それにより、グルコースおよびインスリン代謝および/またはシグナル伝達に影響を与える(Blandino et al 2016)。
これは、共生細菌によるSCFAsの産生障害およびペプチドYY(PYY)およびグルカゴン様ペプチド-1(GLP-1)などの腸管ペプチドの放出低下によって悪化し、集合的に、中枢性満腹感制御障害と同様に、末梢組織における炎症およびインスリン不感症を促進する(Boulange et al 2016)。
同時に、腸内細菌叢異常症から来る信号は、上皮および免疫細胞を妨害することによって免疫代謝を調節し、糖尿病の進行および糖尿病性網膜症および腎症を含むその合併症を有利にする免疫炎症性のミリュウを生成する(Fernandes et al 2019)。
腸内細菌叢異常症はまた、高血圧、心不全、心筋梗塞、脳卒中および冠動脈疾患などの加齢に関連した心臓および血管障害の多様性と関連している(Busnelli et al 2019; Sanchez-Rodriguez et al 2020)。
いくつかの心疾患および脳血管障害の背景条件である動脈硬化症は、慢性炎症性疾患であり、腸内細菌叢異常症とも関連している(Sanchez-Rodriguez et al 2020)。
世界的に、心血管疾患の患者は、Firmicutesの有病率の増加およびBacterioidetesの減少を含む細菌集団上の大きな変化と関連している(JonssonおよびBackhed、2017)。
さらに、実験研究および臨床研究は、細菌由来のエンドトキシン、すなわちLPSおよびPGが、アテローム性動脈硬化症の典型的な慢性的な低悪性度炎症状態に寄与することを示唆した。さらに、心血管疾患のリスクが高い患者集団の中には、ヘリコバクター・ピロリやクラミジア・ニューモニアエといったいくつかの劇症菌に対して血清陽性を示すものもあった(Jha et al)。 全体的に、細菌由来のエンドトキシン血症が心血管疾患に寄与し得ると考えられている(Busnelli et al 2019;Sanchez-Rodriguez et al 2020)。
さらなる証拠は、ジスバイロティックな腸内細菌叢が、アテローム発症の病因に寄与する可能性のある付加的な有害メカニズムをリクルートするという考えを補強する。特に、トリメチルアミンの酸化のプロアテローム性産物であるトリメチルアミン-N-オキシド(TMAO)の形成は、食事中の遊離コリン、ホスファチジルコリンおよびカルニチン代謝の微生物学的分解に由来する代謝物である(Koeth et al 2013;Ussher et al 2013)。
全身性TMAOは、マクロファージによるコレステロール取り込みの亢進およびアテローム性動脈硬化性病変におけるその後の泡沫細胞の形成とともに、腸球におけるコレステロール吸収および肝細胞における胆汁酸合成を減少させることにより、アテローム性動脈硬化の強力な促進因子として記述されている(Koeth et al 2013)。
いくつかの臨床研究は、心不全、冠動脈疾患または急性冠症候群などの加齢性疾患を有する患者を含む明確な集団において、TMAOレベルとCVイベントおよび死亡率のリスクとの間の直接的な関連を示しており、これは最近、全身的なレビューおよびメタアナリシスによって補強された(Heianza et al 2017;Schiattarella et al 2017)。
TMAOと心血管疾患リスクとの同一の関連性は、慢性腎臓病患者で、炎症状態が著しく、主にCV原因による死亡率が高い疾患であることが記載されている。実際、TMAOレベルの増加は、動物モデルにおける尿細管間質性線維症の増強、腎酸化ストレスの促進および炎症と関連していた(Sun et al 2017)、また、腎臓病患者における動脈硬化性疾患および長期死亡と関連していた(Stubbs et al 2016;Tang et al 2015)。
さらに、ジスビオティック微生物による食品成分の分解に伴って生成される他のいくつかの代謝物には、アミノ酸(トリプトファン、チロシンおよびフェニルアラニン)発酵の最終産物である硫酸インドキシル(IS)およびp-クレシル(PCS)などの尿毒症毒素が含まれ、腎線維症および腎障害および機能障害の悪化を引き起こす(Satoh et al 2003)。
ISおよびPCSの血清レベルは腎機能と負の相関があり、腎疾患の重症度に応じて徐々に増加する(Huang et al 2012; Lin et al 2011)。
腸内細菌叢組成の変化は、慢性腎臓病患者においても、疾患の初期段階であっても報告されている(Barrios et al 2015)。
炎症および免疫調節の低下は、腎臓病における微生物異常の重要な特徴である(McIntyre et al 2011)。
腸の炎症およびリーキーガット症候群の結果として、LPS転座は、免疫系細胞を刺激して、全身の炎症を引き起こすプロ炎症性サイトカインの大量産生に向かわせる(Anders et al 2013; Ramezani and Raj, 2014)。
まとめると、エビデンスは、腸内環境を変化させ、腸内細菌叢を腸内環境の変化から腸内細菌叢を腸内環境の変化に向けて修正することにより、腸内細菌叢が慢性炎症を促進し、腎臓病に寄与するという悪循環を示唆している(Fernandes et al 2019)。
4. 腸内細菌叢 dysbiosis、ACE2とCOVID-19の間のクロストーク
腸内細菌叢異常と高齢COVID-19患者、特に心血管疾患、心血管疾患、心筋疾患および炎症性疾患の既往を有する患者における予後不良との関連は、以下の2つの側面に基づいて仮説が立てられる。
i) 加齢に伴う腸内細菌叢の異常と心血管疾患、心筋疾患、炎症性疾患との関連性、
ii)腸内細菌叢の異常、ウイルス感染に対する不正確な局所/遠隔宿主免疫、およびSARS-CoV-2誘導性ACE2脱落によるRASの制御緩和である。
実際、COVID-19パンデミックから得られた強力な疫学的および生化学的データは、既往の心血管疾患、代謝疾患、腎疾患および肺疾患(高血圧、冠動脈疾患、糖尿病、慢性腎臓病および呼吸器症候群を含む)を有する高齢者が、感染したときに重篤な疾患および死亡のリスクが高いことを示している(Chen et al 2020a.2020a; Guan et al 2020; Li et al 2020a; Mehra et al 2020; Roncon et al 2020; Wang et al 2020c)。
)集中治療室(ICU)でケアを受けた感染者の心血管疾患、高血圧および糖尿病の頻度は、ICU以外のケアを受けた患者と比較して、それぞれ3倍、2倍および2倍高い可能性があることが報告されている(Li et al 2020a)。
集中治療を必要とする入院者の割合は年齢とともに増加し、これは高齢者の死亡率の増加と一致している(Du et al 2020; Shi et al 2020; Team, 2020; Zhou et al 2020a)。
セクション3で精査したように、免疫産生および炎症表現型は、前述の加齢に関連した状態の規則的な主要な特徴である。特に、炎症性表現型の悪化は、SARS-CoV-2感染時のACE2保護機能の喪失によるRASシグナル伝達の障害によって強化され、全身的な「サイトカインストーム」と組織傷害をさらに助長する可能性がある(Kuster et al 2020; Wan et al 2020; Wang et al 2020b)(図1、右)。
この論文をさらに支持するために、マウスにおけるLPS誘発急性肺損傷は、ACE2の発現を低下させ、炎症性傷害を悪化させ、RASの他の構成要素、すなわちレニン、Ang II、ACE、およびAT1受容体のアップレギュレーションを引き起こすことができた(Ye and Liu, 2020)。
興味深いことに、Ang IIレベルの上昇は、性に特異的な方法で腸内微生物組成物およびメタボロミクスに直接影響を与えることが示されている(Cheema and Pluznick, 2019)。
図1
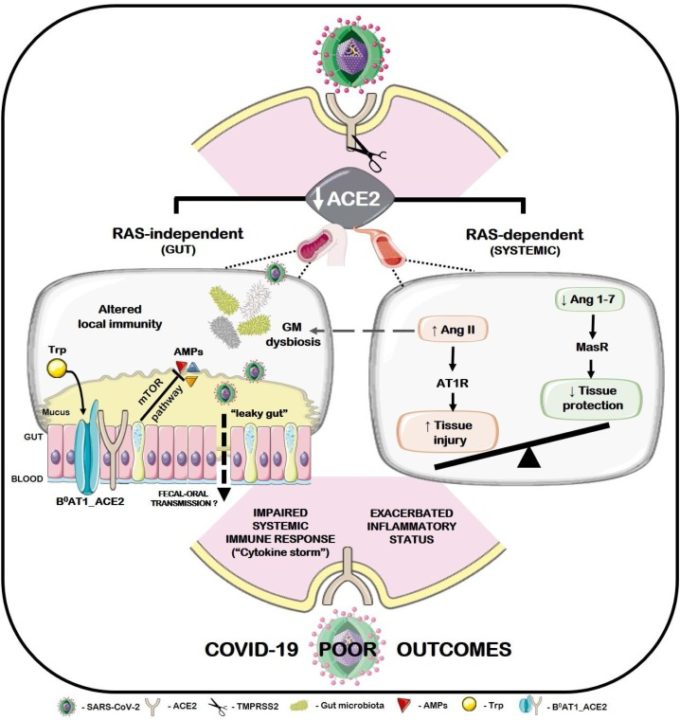
図1. SARS-CoV-2感染後のACE2の脱落と、加齢に伴う心血管疾患、心血管疾患、心筋疾患を既往症とする高齢のCOVID-19患者における不良転帰との間の仮説的な関連。ACE2保護機能の喪失によるアンバランスなAng II/Ang 1-7比は、Ang II-AT1Rシグナル伝達とそれに続く血管収縮性、親高血圧性、親酸化性、親炎症性、親線維性イベントを助長する(RAS依存性経路、右)。
さらに、ACE2の脱落はまた、腸内環境異常を引き起こす可能性がある(RAS非依存性経路、左)。
簡単に言うと、腸内B0AT1キャリアのシャペロンであるACE2の完全性の損失は、後続のmTOR依存性AMPの合成障害、変更された局所免疫と腸内微生物の生理不順を伴う中性アミノ酸輸送に負の影響を与える可能性がある。同時に、Ang IIレベルの上昇は、腸内微生物叢の組成と機能を損なう可能性がある。腸管バリアの透過性の変化は、このシナリオにさらに複雑なレベルを加え、SARS-CoV-2ウイルス粒子を含む局所的なマイクロバイオータ成分の血流への移動を可能にする。
これらの事象がSARS-CoV-2の糞便-口腔感染を促進するかどうかは、さらなる研究が必要である。それにもかかわらず、このような劇症的なカスケードは、心血管、心血管および心臓血管系の患者における既往の腸内環境異常、全身性炎症および免疫応答の低下を悪化させ、COVID-19感染症の管理にはあまり適していないことを示しているかもしれない。
さらに、SARS-CoV-2感染時のACE2機能の低下から生じるRASに依存しないイベントのカスケードは、腸内環境異常と炎症感受性の増加、すなわちmTORを介したAMPの合成障害によるものである可能性がある(Perlot and Penninger, 2013)(図1、左)。
実験的に、ACE2機能の獲得または喪失は、それぞれ、リーキーガット状態の改善および悪化と関連している(Duan et al 2019;Hashimoto et al 2012)。
さらに、腸の恒常性(B°AT1/トリプトファン輸送)に対するRAS非依存的なACE2の役割も同時に報告されている。SARS-CoV-2感染時にACE2の防御機能が失われることにより、腸内細菌叢の不衛生、腸管バリアの透過性の変化、それに伴う局所免疫や全身免疫の非効率なプライミングなどが増幅される可能性がある。
注目すべきは、このような事象は、以前に免疫産生、炎症、腸内細菌の異常プロファイルを示していた患者において決定的なものである可能性があることである。これらの観察結果をまとめると、SARS-CoV-2感染における腸内環境異常が関与していると考えられ、それが加齢に伴う心血管疾患、腎疾患、代謝疾患から生じる腸内恒常性の異常を既往症とするCOVID-19患者の予後不良を説明するのに役立つかもしれない。
したがって、COVID-19患者からの最近のいくつかの証拠は、呼吸器疾患が出現する前のGI障害(例えば、下痢およびGI不快感の他の症状)を強調している(KotfisおよびSkonieczna-Zydecka、2020)、以前のコロナウイルスパンデミックで報告されたものと同様である(Leung et al 2003)。
特筆すべきことに、腹痛はICUに入院した患者では、ICUの援助を必要としなかった患者よりも頻度が高かった(Wang et al 2020a)。以前のCoVsアウトブレイクでは、糞便中のウイルスRNAの存在が、より侵攻的な臨床経過をたどる患者の高い割合で検出された(Cheng et al 2004)。同様に、SARS-CoV-2はCOVID-19患者の糞便中に検出され、糞便-口腔感染も示唆されている(Wu et al 2020b)。
利用可能な証拠をまとめると、SARS-CoV-2感染者のGI管は、SARS-CoVについて以前に報告されたものと同様に、持続的なウイルス複製のための肥沃な場所として機能する可能性があることが示唆される。
印象的なことに、Zangら(2020)のエレガントな研究は、SARS-CoV-2がヒト小腸腸管腸管内のACE2+成熟腸球に感染できることを明確に示し、そのプロセスはTMPRSS2およびTMPRSS4プロテアーゼによって媒介されていることを示すことで、この仮説を裏付けるものである。しかしながら、SARS-CoV-2は、模擬ヒト大腸液によって急速に不活化され、感染性ウイルスは、COVID-19患者の便検体から回収されなかった(Zang et al 2020)。
したがって、SARS-CoV-2の糞便-口腔感染に対処することを目的とした将来の研究は、まだ保証されている。それにもかかわらず、腸内コロナウイルス感染は、腸-血液バリアの崩壊を引き起こす可能性があり、細菌、エンドトキシン、および微生物代謝物の全身的な拡散をもたらし、これは、セクション3で詳述されているように、感染に対する宿主の免疫反応をさらに悪化させ、有害な転帰を強める可能性がある(Leung et al 2003;Yeo et al 2020)。
こストームは、腸内ACE2軸の崩壊と一致しており、いくつかの生理学的システムの機能不全を累積し、最終的には敗血症性ショックを引き起こす可能性がある(Chen et al 2020a; Guan et al 2020)。
肺高血圧症の発症には腸-肺軸が関連していることが提案されており、その表現型は、ACE2喪失によるACE/Ang II/AT1R軸の過剰活性化とリンクした腸の不衛生およびリーキー腸を伴うものである(Kim et al 2020)。
宿主腸球の継続的なウイルス産生およびACE2枯渇、ならびに腸内微生物叢 dysbiosisは、以前にSARS-CoVについて示唆されたように、破壊された腸-肺軸を永続させる可能性がある(Leung et al 2003)。
上述のように、高齢者や加齢に伴う心血管系、代謝系、腎系、肺系の疾患では、微生物の多様性と豊富さの低下、およびバクテリ菌とバクテリ菌の比率の低下によって見られる腸内細菌の異常状態が報告されている。ここでは、腸内細菌叢の変化を示す既往症が、ACE2の完全性・機能性の低下により、SARS-CoV-2感染症を悪化させる可能性があると仮定した。この仮説は、腸管バリアの障害と糖尿病誘発性ジスビオシスの悪化を示すACE2/y-秋田マウスからの証拠によって強化されている(Duan et al 2019)。
この意味で、SARS-CoV-2感染は、腸内ACE2発現の著しい減少およびそれに続く腸管バリアの漏出、改変されたマイクロバイオータ組成物、およびメタボロームおよび悪化したエンドトキシン血症/炎症を促進する可能性がある。この可能性は、COVID-19を有する一部の患者が腸内微生物異常症を呈したことを示す最近のデータによって支持されている(Xu et al 2020)。
しかし、抗生物質のような腸内微生物叢組成を調節することができる併用薬剤の摂取との推定される関係を、将来の研究で取り上げることが重要になるであろう。
5. COVID-19のACE2ベースおよびマイクロバイオータ指向の治療機会
ACE2がヒト細胞におけるSARS-CoV-2侵入の受容体であることの発見(Hoffmann et al 2020b)は、COVID-19を潜在的に治療するためのACE2および/または他のRAS調節薬の可能性を高めている(Zhang et al 2020a)。
COVID-19患者、すなわち高血圧患者におけるACE阻害剤(ACEI)および/またはアンジオテンシン受容体拮抗剤(ARB)の使用の正確な意味合い(利点とリスク)は、ここ数ヶ月の間に激しく議論されており、いくつかの臨床試験が現在進行中である(表1)。
これらの薬剤は、理論的にはRAS阻害下の動物モデルにおいて、実験的に誘発された肺損傷の程度を減少させることで利益をもたらす可能性がある(He et al)。 COVID-19検査を受けた18,472人の患者を対象に実施された研究では、ACEIまたはARBsの使用とCOVID-19検査陽性との間に関連性は示されなかった(Mehta et al 2020)。
ACEIs/ARBs曝露は、COVID-19感染の高いリスクとは関連しておらず、重症化するリスクも死亡率も高くはなかったが、非ACEIs/ARBs降圧薬を使用している患者と比較して、死亡率の低いリスクと関連していた(Zhang et al 2020b)。
この研究は、治療を維持した場合の死亡リスクが低いことから、COVID-19患者においてACEIsまたはARBsの中止を推奨する現在の専門学会のガイドラインをさらに支持した(Cannata et al 2020b)。
同様の結論は、他の関連する研究および出版物で得られた(Fernandez-Ruiz、2020;Reynolds et al 2020)、その中には、降圧剤クラスが異なる降圧剤使用者110万人が参加した多国籍オープンサイエンスコホート研究が含まれ、ACEまたはARBの使用によるCOVID-19診断または入院の臨床的に有意な増加リスクは存在せず、COVID-19を回避するために治療を中止または変更しないことが推奨されると結論付けた(Morales et al 2020)。
表 1. ACE2または他のRAS成分を標的としたCOVID-19治療の臨床評価中の治療機会(Clinicaltrial.gov)
原文参照
他の治療的アプローチは、代替戦略としてAng 1-7受容体アゴニストまたは組換えヒトACE2(rhACE2)に依存することがあり、これは、ACE2/Ang1-7/MasR軸を介して十分な程度のRASカウンターレギュレーションを維持する試みであり、これは、既存の心血管系/代謝系/腎疾患を有する患者において特に有用である可能性がある。Ang 1-7受容体のアゴニストであるrhACE2またはAVE 0991の投与により、心血管疾患および肺疾患において有益な効果が観察された(Patel et al 2016)。
実際、AVE 0991は、心臓、腎臓および肺の有益な効果を示し、一方、rhACE2投与は、前臨床研究において、心血管疾患、腎障害および急性肺障害の症状を改善することができた(Imai et al 2005;Jia,2016;Zhong et al 2010)。
また、SARS-CoVで誘発された急性肺損傷を含む、異なる病因の急性肺損傷についても、rhACE2は有益な効果を促進した(Imai et al 2005; Jia, 2016; Kuba et al 2005)。
rhACE2は、循環するウイルス粒子をスカベンジする能力とRASのカウンターレギュレーションに起因する有益な効果を有することから、COVID-19患者に対する有望な治療戦略と考えられており、現在臨床試験が行われている(表1)。
言及する価値があるのは、rhACE2 APN01(GSK2586881)を用いた先行研究が、健康なボランティアにおいても、急性呼吸窮迫症候群患者の小集団においても、安全なプロファイルを示したことである(Haschke et al 2013;Khan et al 2017;ZhangおよびBaker、2017)。
全体的に、ACE2可溶性形態の供給は、ウイルスの宿主細胞への侵入を遅らせることによって、SARS-CoV-2感染内で二重の有益な機能を発揮する可能性があり、一方で、RAS上のACE2コントラトリー機能の仮定された維持を確保することによって、肺損傷からの保護を支援している。
さらなる注目に値する宿主細胞へのSARS-CoV-2侵入を阻止する別の可能性は、TMPRSS2活性の阻害である(Hoffmann et al 2020a; Iwata-Yoshikawa et al 2019)。
TMPRSS2阻害剤であるカモスタットメシル酸塩は、過去にSARSおよびMERS感染症内で試験され、有効な選択肢として報告されている。さらに、抗体または小分子/ペプチドでACE2をブロックすることも、さらなる研究に値する有望な戦略であり得る。
COVID-19患者における一貫した腸内微生物異常症の可能性は評価中であり(進行中の臨床試験の表2を参照)、すでにいくつかの研究によって示唆されている(第3.1節参照)。
この意味で、消化管機能および微生物叢を平衡化するための治療的栄養措置は、細菌の転座による二次感染のリスクを低減するために、プレバイオティクスまたはプロバイオティクスの使用を含めて重要であり得る。
さらに、バイオエンジニアリングされたプロバイオティクス種の使用は、薬理学的薬剤を送達するための生きたベクターとして想定されている。このアプローチは、コレラ毒素の非毒性サブユニットBと融合して分泌されるACE2を発現する組換えラクトバチルス・パラカセイ(コレラ毒素の非毒性サブユニットBと融合して分泌されるACE2を発現するラクトバチルス・パラカセイ)で処置された糖尿病性網膜症を有するマウスにおいて成功とともに使用され(Verma et al 2019)、標的条件としてCOVID-19感染を用いて複製することができた。
表2. COVID-19患者を対象とした腸内細菌叢の研究のための臨床試験(Clinicaltrial.gov)。
原文参照
COVID-19の患者を治療するために試験された様々な治療法の選択肢の中には、腸内細菌叢を調節する能力があることが示されているものがある。薬物に関しては、抗マラリア薬のクロロキンおよびヒドロキシクロロキン、脂質低下薬のスタチン、一部のインターフェロンおよびコルチコステロイド(デキサメタゾンを含む)などの免疫調節剤および抗炎症剤とともに、腸内微生物叢を妨害することが示されている(Angelakis et al 2014;Huang et al 2015;Tschurchentsthaler et al 2014;Zhao et al 2020)。
栄養補助食品の介入に関して、腸内微生物叢を調節することができるいくつかの選択肢が、COVID-19またはその関連症状との闘いにおいて潜在的に有用であると最近示唆されている(Akour、2020;Dhar and Mohannty、2020;Zabetakis et al 2020);それらの中で、ビタミン類、ビタミン類、ビタミン類、およびビタミン類は、COVID-19またはその関連症状との闘いにおいて潜在的に有用であると示唆されている。2020)
それらの中で、ビタミン、セレンおよび亜鉛、フラボノイド、オメガ3多価不飽和脂肪酸、および伝統的な漢方薬からのハーブ/化合物のパノパン(Costantini et al 2017;Feng et al 2019;Kumar Singh et al 2019;Steinert et al 2020;Yang et al 2020)。
栄養補助食品の選択肢について記載されている効果は、一般的には共生的であるが、薬剤についても同じことが必ずしも当てはまるわけではなく、その中には、微生物相の組成および機能に影響を与えるだけでなく、共生的または非共生的であり得る相互作用において、微生物相の影響を受け得るものもある。しかし、これらのアプローチの腸内マイクロバイオータへの影響は、主に他の病態(実験的または臨床的)で記載されており、COVID-19患者におけるそれらの影響についての関連情報はまだなく、さらなる解明に値する。
最後に、本疾患と腸内細菌叢異常症に関連する注意書き。COVID-19に罹患した一部の患者における消化器症状の存在、および糞便中のSARS-CoV-2の検出は、ウイルスが気道から排除された後も陽性を持続しうることから、糞便-口腔感染経路の可能性を示唆している(Xiao et al 2020)。
この意味で、糞便微生物移植や便バンキングの国際的な専門家グループは、提供者からの汚染を避けるために、提供前に慎重なスクリーニングを行う必要があるとして、推奨事項の迅速な改訂を提案している(Ianiro et al)。
6. 結論と今後の課題
ACE2は、COVID-19の病態生理において明らかに関連性のある3つの役割を持っており、その転帰と管理・治療の両方に影響を与えることが期待されている。ACE2はヒトにおけるSARS-CoV-2受容体であり、ウイルス感染時に膜貫通型プロテアーゼ(例:TMPRSS2)によって切断される。MasR受容体上のACE2シグナルは、AT1Rを介したAng IIのプロ血管収縮活性、プロ線維化活性、プロ酸化活性、およびプロ炎症活性の重要なRASカウンターレギュレーター活性を示す。
ウイルス感染後に「中和」されると、心血管系、腎系、肺系に対するACE2の保護作用が弱まり、特にSARS-CoV-2感染時に最も重篤な影響を受けるとされている前述の既往症を有する高齢者において重要である。さらに、感染者のかなりの割合で消化器症状がみられ、消化管-腸の経路が示唆されている。
腸内細菌叢の異常と腸血液関門の障害(リーキーガット)は、肥満、糖尿病、慢性腎疾患を持つ患者だけでなく、心血管患者における動脈硬化症の発症、心血管疾患 および死亡リスクの増加と関連している。
興味深いことに、ACE2は腸管上皮におけるアミノ酸輸送において主要な役割を果たしており、そのメカニズムは抗菌ペプチドの産生と関連しており、腸内細菌叢の平衡を阻害している。ウイルスSタンパク質のプライミング後に起こるようなACE2の脱離の状態では、腸内細菌叢の異常が促進される可能性があり、その結果、高齢のCOVID-19患者における予後の悪さをさらに助長し、最終的には説明することになるだろう。
COVID-19におけるACE2の重要な役割と、一部の患者の予後悪化への潜在的な影響を考慮して、いくつかの治療法が試験されており、主に以下の戦略に基づいている。- rhACE2などの可溶性ACE2;-ACE2ブロッカー(抗抗体または低分子/ペプチド);-TMPRSS2阻害剤;-Ang1-7受容体アゴニスト;-ACE阻害剤および/またはARB。これらの薬理学的戦略の中には有望な結果を示すものがあり、現在臨床試験に移行しているものもある。
さらに、患者の腸管漏れや微生物相の異常を管理すること、すなわち、プレバイオティクスやプロバイオティクス活性を有する栄養剤を使用して、薬理学的な薬剤を送達することができるバイオエンジニアリングされたプロバイオティクス戦略を含むことも関連しているかもしれない。
これからの時代は、確かにこの問題を明らかにするのに役立つ新しいデータを明らかにし、うまくいけば、このパンデミックまたは将来がもたらすかもしれない他の類似のシナリオを解決するための効果的な解決策を明らか
にするだろう。
