A Review of Persistent Post-COVID Syndrome (PPCS)
www.ncbi.nlm.nih.gov/pmc/articles/PMC7896544/
2021年2月20日
要旨
持続性ポストコービッド症候群(Long-COVIDとも呼ばれる)は、COVID-19後の持続的な身体的、医学的、認知的な後遺症を伴う病理学的実体であり、持続的な免疫抑制に加えて、肺、心臓、血管の線維化を含む。臓器および血管系の病理学的線維化は、死亡率の増加および生活の質の深刻な悪化をもたらす。
免疫・線維化調節因子であるトランスフォーミンググロースファクターβ(TGF-β)を阻害することで、post-COVIDのこれらの後遺症を軽減できる可能性がある。
現在の前臨床および臨床研究の中心は、COVID-19のメカニズムと症状の発現、およびその前駆期と前駆期である。post-COVID遺症による長期的な影響の可能性は、治療を受けた患者が大量に退院し、医療システム、患者の家族、社会全体に負担をかけ、医学的に壊滅的な打撃を受けたCOVID-19生存者をケアするためにますます重要になってくると考えられる。
このレビューでは、持続性post-COVID遺症症候群の根底にあるメカニズムと考えられる症状を探り、持続性post-COVID遺症症候群が疑われる、または確認された患者の診断と管理のための戦略の枠組みを提示する。
序論
1941年から 1945年までの間、非常に雄弁で叙事詩的なイギリスの首相であったウィンストン・チャーチルは、かつて次のように書いている:「今、これは終わりではない。終わりの始まりでさえない。しかし、それはおそらく、始まりの終わりである」と書いている。SARS-CoV-2パンデミックは3つの部分からなる物語である:プロローグまたは発症、中間章、エピローグまたは解決であり、そのうちプロローグと中間章の一部のみが書かれており、病気の広がりを制限するための封じ込めと緩和策が最終的に効果を発揮し始めることで、始まりの終わりを示すと同時に、うまくいけば終わりの始まりでもある[1]。
前提として、COVID-19は症状の解消と死亡率の回避で終了する。したがって、(適切に)早期発見と治療に主眼が置かれている。治療管理は、多臓器機能障害症候群(MODS)の原因となる過剰に膨れ上がった免疫反応、すなわち「サイトカインストーム」[2]を和らげるための蘇生および抗ウイルス剤、免疫調節剤、およびサイトカイン標的療法による即時治療に焦点を当てている。臨床的に症状のある患者は、COVID-19の氷山の目に見える部分である。しかしながら、post-COVIDの罹患率[3]と死亡率[4]の初期の逸話的証拠は、氷山の水没部分であり、特に「回復した」と宣言されてICUから退院する患者が急増していることから、専門的なアフターケアの緊急の必要性と重点化を示唆している。
我々は、ポスト敗血症症候群[5]およびポストICU症候群[6]との類推により、臨床的に有意なQOL(Quality of Life:生活の質)の低下と、感染症症状が消失した後も長く持続する一連の影響に伴う不眠死のリスクの増加を特徴とする新たな病理学的実体を「持続性ポストコービッド症候群」(Persistent post-COVID syndrome:PPCS)と呼んで、COVID生存者の病的なICU後の経過を表現している。また、敗血症生存者の約50%に発症し、「隠れた公衆衛生上の災害」[7]とレッテルを貼られている敗血症後症候群との類似性から、これらの長期的なPPCSの影響は、既存の医療能力を圧倒するのに十分な規模で発生する可能性がある。COVID-19の急性エピソードの管理を最適化するためのいくつかの戦略が評価されているが、潜在的な長期的なPPCSの後遺症の適切な管理と予防については、限られた注意しか払われていない。これはおそらく、感染症からの症状の遠隔性、および/または「一度に1つの臨床的大惨事」と「第一優先」に焦点が当てられていることに関連している。以下でより詳細に検討すると、長期にわたる病気を説明するための統一的な仮説として、トランスフォーミング成長因子β(TGF-β)の過剰発現が考えられる。
本論文では、(1)持続的なポストコービッド症候群のTGF-β駆動機序の可能性、(2)PPCSの臨床症状の概要、(3)PPCSの診断と管理のための戦略について簡単に述べている。
ポストCOVIDメカニズム
全身性炎症反応症候群またはSIRSが優勢なCOVID-19のような重度の一次感染症や外傷に続くと、圧倒的で長期にわたる相殺性抗炎症反応症候群(CARS)が発生し、感染後/外傷後の免疫抑制につながる[8]。SIRSまたは全身性炎症反応症候群と鏡像化されたカウンターレギュレーションであるCARS応答の目的は、炎症前の状態を和らげ、不適応な多臓器機能不全を防ぎ[9]、免疫学的恒常性または正常性への復帰を制御することである[10]。
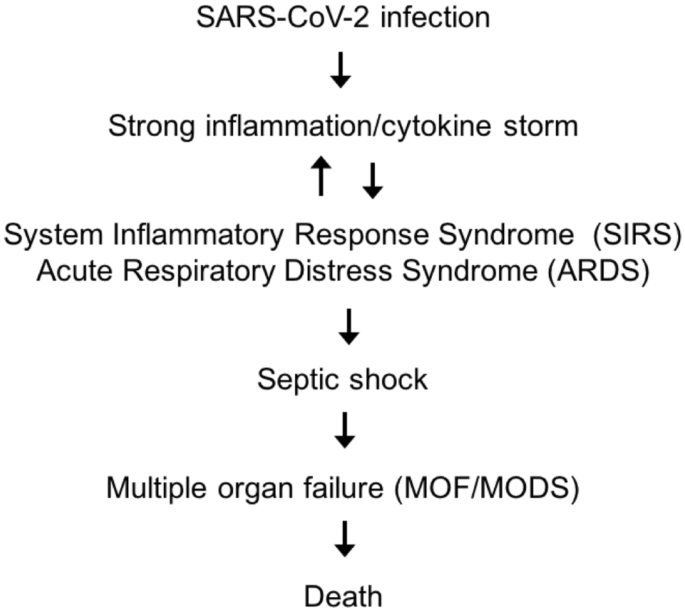
同時に相互作用する複数の因子と対立する因子が関与しており、COVID-19の転帰を最終的に決定するプロ炎症反応と抗炎症反応、すなわちSIRSとCARSの微調整されたバランスを調整している。過度の炎症性反応は、(1)ウイルスへの曝露または接種、(2)合併症の有無、(3)免疫能力の状態の機能であり、インターロイキン1,6,8,17,1β、単球化学吸引性タンパク質-1,組織壊死因子αなどの炎症性サイトカインの過剰放出によって特徴づけられ、総称して「サイトカインストーム」として知られている[11] [12]。このプロセスが放置されると、図1に示すように、急性肺障害(ALI)急性呼吸窮迫症候群(ARDS)凝固障害、低血圧、低灌流、臓器不全(多臓器不全(MOF)または多臓器機能不全症候群(MODS)としても知られている)および死に至る。
図1 死亡率につながるCOVID-19カスケード
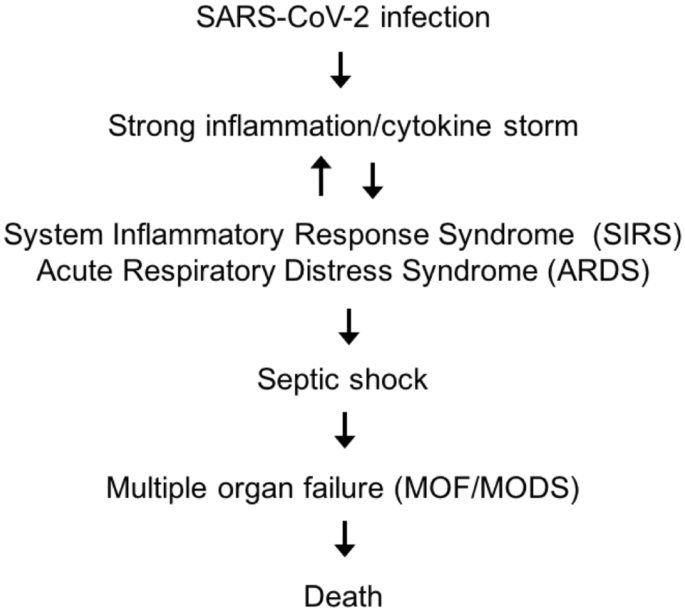
一方、炎症反応がCARSの方向に抑制されすぎている場合、患者は、最初の高炎症性サイトカインストームとARDSへの進行を「乗り切る」ことができた。は、図に示すように、敗血症後に見られ、持続性ポストコービッド症候群(PPCS)の仮説的原因の一つである持続性炎症・免疫抑制・異化症候群のためのPICSとして知られる免疫抑制の長期化の段階に入る可能性がある[14,15]。2.
図2敗血症との類推によるCOVID-19における単純化された純免疫学的応答
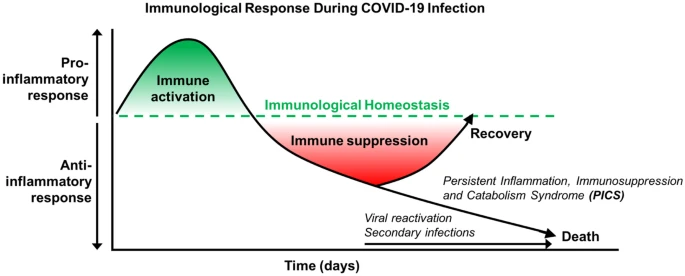
COVID-19における免疫学的応答の経時的変化:最初は、炎症性反応が優勢である。抗炎症性サイトカインはサイトカインストームを和らげるために発現する。慢性の免疫抑制では、持続性炎症免疫抑制・異化症候群(PICS)が優勢になる。初期の死亡はサイトカインストームによるものであるが、抗炎症期に起こる後期の死亡は二次感染によるものである。
この仮説を支持するために、敗血症後の患者は潜伏ウイルスの再活性化を起こしやすく[16]、複数のニュースソースは、回復したCOVID-19患者におけるSARS-CoV-2の再発または再活性化について報告している[17, 18]。同様に、敗血症と同様に、COVID-19患者は二次的な細菌・真菌感染症の発症リスクを有しており[19]、免疫抑制と調節障害が存在することが強調されている(図3)。
図3 換気による機械的ストレッチは、TGF-βなどのメディエーターを放出し、線維化を誘導する
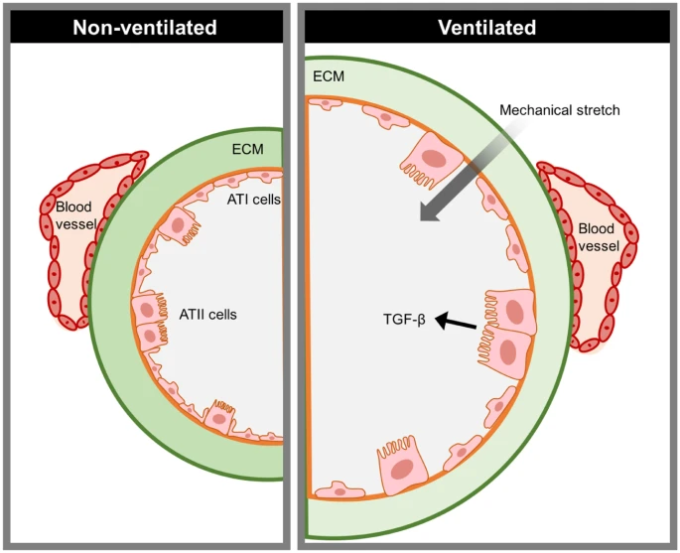
ECM:細胞外マトリックス、AT1・AT2肺胞肺細胞1・2型、TGF-β:トランスフォーミンググロースファクターβ
免疫能力の喪失に加えて、post-COVIDの患者は、回復した患者のフォローアップ画像によく見られる、間質性肺線維症(IPF)[21]とは異なる肺線維症[20]の発症に対しても脆弱である。しかし、ARDS後の線維化が問題となる真の程度は、呼吸困難、疲労、脱力感などの他の影響が、進行中の肺損傷の程度やガス交換障害の程度に比例していないように思われるため、よく定義されていない(図4)。
図4 COVID-19誘発性心臓障害の潜在的なメカニズム
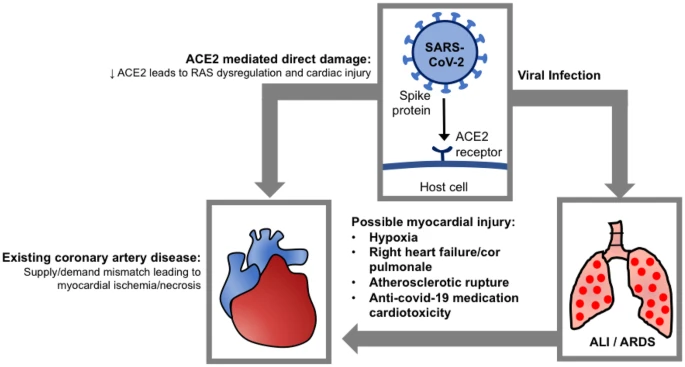
ALI/ARDS:急性肺損傷/成人呼吸窮迫症候群、RAS:レニン-アンジオテンシン系、ACE:アンジオテンシン変換酵素2
形質転換成長因子β(TGF-β)は、深在性、抗炎症性、免疫抑制作用を有する多機能性サイトカインであり、敗血症の間およびCOVID-19の間および後に上昇している[22]。COVID-19患者の肺の組織学的変化は、線維芽細胞の増殖と間質性線維化を示しており、TGF-βの関与を示唆している[23]。したがって、線維化および免疫抑制の強力な誘導因子であるTGF-βシグナル伝達は、Smadタンパク質またはMAPキナーゼとAkt [24]によって媒介され、治療的介入のための魅力的な標的となる可能性がある。
Post-COVIDの症状
Post-COVIDの後遺症は患者によって異なり、起こりうる症状の特徴付けに関するコンセンサスは得られていない[25]。発表時点では、post-COVID遺症に関する大規模な臨床研究は容易に入手できない。表1では、post-COVIDの症状を特定し診断するためのフレームワークを提案している。このフレームワークには4つのスクリーニングカテゴリーがある。(1)臨床検査、(2)放射線病理学的検査、(3)機能状態の悪化、(4)自覚症状およびQOLの指標である。以下では、post-COVIDの症状の一部を紹介する。
表1 持続的なpost-COVID遺症のスクリーニングと診断に役立つフレームワーク
| 1.実験室調査 |
|---|
| 咽頭スワブRT-PCRおよび/または抗体検査により、活動性または過去のCOVID-19感染が確認された* |
| ベースラインと比較した異常な検査所見** |
| 2.放射線病理学 |
| ベースラインと比較したCT /放射線画像の肺病理** |
| 3.機能状態の悪化 |
| ベースラインと比較した機能状態の悪化** |
| 4.主観的な症候性および生活の質のパラメーター |
| ベースラインから2週間以上経過した新しい症状または悪化する症状** |
| ベースラインから2週間を超える症状の持続期間または症状の再発** |
肺線維症と機能障害
COVID-19の症例の大部分は軽度または無症状であるが、感染した患者の約5~8%は成人呼吸窮迫症候群(ARDS)を発症し、低酸素血症、非心原性肺水腫に続発する両側性肺浸潤、および肺コンプライアンスの低下を特徴とし、しばしば機械換気を必要とする [26, 27]。ARDSの病理学的進展には、滲出性、増殖性、線維性の3つの相が重なっていると考えられている [28]。滲出性の段階では、IL-1β、TNF、IL-6などの炎症性サイトカインの放出、好中球の流入、および内皮-上皮バリアの破壊が起こり、肺胞の浸水および呼吸窮迫を引き起こす [29]。滲出性相に続いて線維芽細胞、線維芽細胞、および筋線維芽細胞が肺胞コンパートメントに蓄積し、フィブロネクチン、コラーゲンI、およびコラーゲンIIIを含むマトリックス成分の過剰な沈着をもたらす線維増殖相が起こる[30]。
ARDSにおける線維増殖反応の発現に寄与するメカニズムの1つは、せん断力が形質転換成長因子β1の分泌を誘導するだけでなく、コラーゲン合成を活性化し、コラゲナーゼ産生を阻害することから、機械的換気である[31]。
ARDS生存者の一部、ひいてはCOVID-19患者の一部は肺線維症に進行し、そのうち運動誘発性の息切れと慢性乾性咳嗽が顕著な症状であり、管理は補助酸素、呼吸リハビリテーション、肺炎球菌およびインフルエンザに対するワクチン接種からなる大部分の支持的なものである[32]。FDAに承認されている2つの薬剤、ニンテダニブとピルフェニドンは治癒しないが、肺線維症の進行を遅らせることが実証されている [33]。死亡リスクが高いこれらの患者では、運動制限とQOLの低下をARDS後最大5年間にわたって呈し続ける可能性がある [34]。
心臓線維症と機能障害
COVID-19患者は一般的に、トロポニンT(TnT)および脳内ナトリウム利尿ペプチド(BNP)の上昇レベルによって決定される心不全および心筋炎および/または既存の心血管系疾患の増悪を含む心筋損傷の徴候を呈する [35]。損傷の潜在的な機序には以下のものがある。
- 肺高血圧および右心不全を伴う肺血管抵抗の増大
- レニン-アンジオテンシン系(RAS)の過剰刺激は、二次的な高アルドステロン血症を含む心血管系への有害な影響を媒介し、低カリウム血症や心臓不整脈を引き起こす [36] 。
- 炎症性サイトカインの作用を介して動脈硬化性プラークが破裂し、特に冠動脈疾患の既往がある場合には梗塞を促進する。
- ACE-2を介したウイルスによる心筋細胞の浸潤、心筋炎の原因となる
- ARDSによる静脈還流低下と重度の低酸素血症が重なって心筋虚血・心筋壊死を引き起こす心筋酸素需給ミスマッチ
- QT間隔の延長に関連するマクロライド系抗生物質アジスロマイシン[38]、心臓の伝導障害を引き起こす可能性のあるクロロキン/ヒドロキシクロロキン、トシリズマブを含む潜在的な抗COVID薬の心毒性の可能性がある。また、プロテアーゼ阻害薬であるロピナビル/リトナビルは、PRとQT間隔を延長し、CYP3A4活性を阻害し、スタチンを含む他の心臓病治療薬の代謝に影響を及ぼす可能性がある[40]。
心筋損傷の共通点は、左室壁の肥大と線維化を含むリモデリング過程であり、収縮力の低下と全体的な機能の低下をもたらしている[41]。COVID-19の長期的な心臓への影響を予測するには時期尚早であるが、SARS-CoV-1とSARS-CoV-2の遺伝的類似性を考慮すると、SARS-CoV-1患者では12年間の追跡調査で40%の心血管系の異常が示されていることから、外挿が可能である[42]。
神経線維症と機能障害
SARS-CoV-2への感染は、発熱、咳、呼吸困難、咽頭痛などのウイルス性肺炎に典型的な呼吸器症状をもたらすことが多いが、興味深いことに、無呼吸症および嚥下障害 [43] ももたらし、これはウイルスが神経向性であることを示唆している。中国・武漢の患者214人のレトロスペクティブな症例シリーズでは、神経症状の発生率が高かった。患者78人(36.4%)に中枢神経系(CNS)症状(24.8%)末梢神経系(PNS)症状(8.9%)または骨格筋症状(10.7%)がみられた。中枢神経系症状で最も多かったのは、めまい(16.8%)と頭痛(13.1%)であった。急性脳血管障害、運動失調、てんかん、意識障害も報告された[44]。
組織線維化細胞は特定のニッチに制限されているため、組織線維化は脳を除く身体のほとんどの臓器で損傷に対する一般的な反応である[45]。しかし、例えばサイトカインストームによる血液脳関門の破壊、または神経組織への直接的なウイルス傷害では、瘢痕形成が誘導される。
神経学的および精神医学的後遺症は敗血症生存者によく見られる [46,47]。同様に、SARS-CoV-2感染後の神経精神症状も報告されている[48]。これらの症状には、うつ病、不安、および精神病が含まれる[49]。
AIDS認知症複合体、アルツハイマー病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症(ALS)多発性硬化症、不安、抑うつ、統合失調症[50]を含む複数の神経疾患はTGF-βシグナル伝達経路の調節障害と関連しているため、このサイトカインはCOVID-19誘発性神経精神症状の治療標的となる可能性がある。
COVID-19関連凝固障害
重症COVID-19感染患者の中には、凝固の劇症的活性化と凝固因子の消費を伴うDIC様凝固障害を発症するものがある。これは、凝固時間(PTおよびaPTT)の遅延、低血小板、およびそれらの消費によるフィブリノーゲンの減少(<1.0 g/L)によって特徴づけられる。血栓性合併症には肺塞栓症や脳卒中があり、特にICU患者においては薬理学的血栓予防の必要性が示唆されている[51]。
血栓性の「後遺症」には、再発の可能性、出血のリスクを高めるクーマジンまたはエノキサパリンによる長期抗凝固療法、脳血管事故(CVA)による身体障害[52]、心筋梗塞(MI)または肺塞栓症、行動や感情の変化などがある。
管理
post-COVIDの後遺症の治療のための管理戦略は、個々の患者の症状プロファイルとニーズに応じて大きく異なる。管理戦略は既往症を考慮した上で、症状が治まるまで、そしてその後もしばらくの間はケアチームが定期的にフォローアップを行うべきである。表2
に PPCS が疑われる、または確認された患者の管理に関する一般的な推奨事項の枠組みを示す。以下では、COVID 後の特定の症状に対する治療戦略の可能性を探る。
表2 持続性持続性ポストCOVID-19症候群(PPCS)が疑われるまたは確認された患者の管理に関する推奨事項
| 1.現在の症状状態または医学的懸念のマッピングによる患者の医師による検査 |
|---|
| 2.オーラルヒストリーと可能な臨床試験を通じてCOVID-19曝露状態と潜在的な病歴を確立する |
| 3.可能性のある非COVID-19併存疾患または慢性病状のスクリーニング |
| 4.急性症状または確立された基礎となる慢性状態に対して適切な治療を施す |
| 5.長いCOVID-19後遺症 としても知られる持続的なCOVID-19後の症状の可能性について患者を教育する |
| 6.定期的な患者のフォローアップを継続し、症状の悪化の発症時に患者に医療を求めるように促す |
COVID-19誘発性ARDSに類似した敗血症との類推により、SARS-CoV-2感染時の炎症亢進には、免疫麻痺状態と筋肥大状態が長期化し、いわゆる病気からの回復後も二次感染や臓器機能不全に対する脆弱性が高まる(図2)。このような免疫調節療法(例えば、GM-脳脊髄液、プールド静注免疫グロブリン(IVIG)IFNγ、インターロイキン-7,PD-L1阻害剤、IL-3)の多くが敗血症中に試みられているが、敗血症ではプロ・抗炎症性サイトカインと抗炎症性サイトカインの複雑な時間的変動があるためか、ほとんどの場合、混合した結果となっている[53]。
しかし、敗血症後症候群(ひいてはPPCS)では、持続的な炎症、免疫抑制、異化、またはPICSが優勢であり、これは悪性表現型に類似している。したがって、炎症がダイナミックに変動する敗血症が進行している間ではなく、この感染症後の状況において、特にチェックポイント阻害薬、TGF-β阻害薬、造血増殖因子、サイトカイン、ケモカインなどの免疫調節療法を検討する必要がある。特に、PPCSや敗血症後/ICU後の症候群においては、TGF-β阻害薬は、免疫抑制や線維化を中和または逆転させる薬剤として期待されている。
再利用可能な可能性のあるTGF-β阻害薬は、がん治療のために臨床で評価されている。これらには、アンチセンスオリゴヌクレオチドであるTrabedersen(AP12009,Antisense Pharma)TGF-β2,アンチセンス同種腫瘍細胞ワクチンであるBelagenpneumatucel-L(Lucanix、NovaRx)galunisertib一水和物(LY2157299。TGF-βRIの低分子阻害剤であるバクトセルチブ(EW-7197またはTEW-7197)は、TGF-β1誘導性Smad/TGFβシグナル伝達を阻害するALK5の新規低分子阻害剤であり、イーライリリー社(Eiri Lillly社)は、TGF-β1誘導性Smad/TGFβシグナル伝達を阻害する。パン-TGF-β(TGF-β1,TGF-β2,TGF-β3)をブロックする完全ヒト型モノクローナル抗体であるフレゾリムマブ(GC1008,Genzyme/Sanofi)TGF-βの低分子阻害剤であるタシスラム(LY573636)。およびBETA PRIME(AdAPT-001,EpicentRx)は、TGF-βをトラップまたは中和するためのTGF-βタイプII受容体をコードする改変複製オンコロイドアデノウイルスである[54]。表3は、これらのTGF-β阻害薬の臨床試験の数をまとめたものである。
表3 PPCSにおける再利用の可能性のある癌におけるTGF-β阻害剤の臨床試験
| エージェント | 目標 | 段階 |
|---|---|---|
| トラベデルセン(AP12009) | TGF-β2mRNA | 2b |
| Belagenpneumatucel–L(Lucanix) | TGF-β2 | 3(失敗) |
| フレソリムマブ(GC1008) | パンTGF-β | 2 |
| ガルニセルティブ(LY2157299) | TβRI | 2 |
| タシスラム(LY573636) | TGF-β | 2 |
| ベータプライム(AdAPT-001) | TGF-β1および3 | 1 |
多くの急性イベントに対する標準治療には、急性期の管理だけでなく、リスクと適切な介入が広く認識されているシナリオでは、その後の合併症のリスクを軽減することも含まれている。例えば、脳卒中後の抗血小板療法(Aggrenoxなど)整形外科手術後の直接経口抗凝固薬(リバロキサバンやアピキサバンなど)による抗凝固療法、スタチン、抗血小板薬、ACE阻害薬、β遮断薬などの心筋梗塞後のレジメンなどが挙げられる。ARDS後の合併症が認識され始めている一方で、COVID-19の急増は、PPCSとARDS後症候群を前面に押し出し、現在の標準治療がない場合にどのように対処すべきかという問題を解決する準備ができている。
結論
急性COVID-19の臨床ケアの最前線には、予防と管理のための複数のガイドライン、推奨事項、ベストプラクティスが公布され、優先順位をつけられているが、おそらく、将来の可能性よりも、当面の日々の「抗COVID戦」に焦点が当てられているため、現在、感染後のケアや回復に関するガイドラインはなく、post-COVIDの患者をどのように評価し、管理するかについての情報や戦略は著しく不足している。
このレビューの目的は、持続性ポストコービッド症候群(Persistent post-COVID syndrome: PPCS)という新たに作られた包括的な用語を、ポストセプシス/ポストICU症候群になぞらえて、見落としたり無視したりするのが容易な異質な症状のゆるやかな連合をカバーしていることを明らかにし、認知度を高めることである。しかし、PPCSの隠された「氷山」を見落としたり無視したりすることは、ポストセプシス/ポストICUのユニークなバージョンであるかもしれないPPCSの隠れた「氷山」を見落としたり無視したりすることであり、ポストCOVID患者で報告されている身体的・心理的障害の増加[55,56,57]が証明しているように、1つのパンデミック病を別のパンデミック病に置き換えたり、代替したりする可能性があり、すでに過剰な負担を強いられている医療システムに再び氾濫させる可能性がある。
それにもかかわらず、COVID-19の診断とその後の罹患率との間の因果関係を示す証拠を確立することは困難である。特に、慢性疾患と持続性ポストコービッド症候群(PPCS)は、高齢、糖尿病、喫煙、栄養不良または肥満、免疫抑制、高血圧などの共通の危険因子および前兆を共有している可能性があり、これらの病態に対する広範な脆弱性を反映している。診断や管理を困難にするその他の要因としては、以下のようなものがある。
- 急性症状と慢性症状の時間的分離
- post-COVIDおよびICU後の病理学に対する認識が不足しており、多系統の徴候や症状に関して「点と点をつなぐ」ことができない可能性がある。
- 重篤な疾患自体が COVID 後の病状の長期化の原因となっているのか、またどの程度まで COVID 後の病状と因果関係があるのか、あるいは COVID 前の併存疾患や COVID 前の臨床経過が COVID 後の負担に影響を与え、回復力の低い虚弱な患者を転換点を過ぎたところに追い込む原因となっているのか、という鶏と卵のような問題があった。
最後に、PPCS の症状を完全に「元に戻す」魔法の弾丸のような治療法を期待することは、おそらく非現実的です。しかし、PPCSの中心的な問題は免疫不全と二次感染の可能性であり、慢性的な炎症過程の末期に発症する肺、心臓、脳の線維性リモデリングと同様に、二次感染を起こしやすくなることである。しかし、免疫調節療法、特にTGF-βの阻害は、炎症免疫抑制と線維化の間の交差点に立っており、COVID-19のこれらの壊滅的な後遺症の予防のための新しい標的戦略の設計を容易にするために、感染後の免疫麻痺と線維化をリンクするメカニズムのリンチピンとして機能する可能性があります。
最初のアメリカの戦いの叫びの一つは、「赤兵隊が来る!」であった。最も最近のものは、SARS-CoV-2ウイルスの季節的な再発に起因する「再COVIDが来る」かもしれないし、それと一緒に、このレビューの前提によれば、持続性ポストコービッド症候群である。