Contents
A Review of Dietary (Phyto)Nutrients for Glutathione Support
www.ncbi.nlm.nih.gov/pmc/articles/PMC6770193/
オンラインで公開2019年9月3日
Deanna M. Minich1,* and Benjamin I. Brown2
概要
グルタチオンはトリペプチドの一種で、酸化還元バランスの維持、酸化ストレスの軽減、代謝解毒の促進、免疫系機能の調節など、様々な疾患の病態に関連する効果をもたらす重要な生理的プロセスにおいて極めて重要な役割を果たしている。生理学におけるグルタチオンの多様な役割は、グルタチオンの状態が様々な慢性・加齢性疾患における重要なバイオマーカーや治療ターゲットになることを示唆する多くの証拠と関連している。しかし、抗酸化物質とレドックスバランスについての理解を深めるとともに、個人個人の適切なバランスが鍵となる。グルタチオンレベルの最適化は、健康増進や疾病予防のための戦略として提案されているが、グルタチオンの状態と疾病リスクや治療との間の明確な因果関係はまだ明らかにされていない。しかし、ヒトの臨床研究では、アミノ酸、ビタミン、ミネラル、植物化学物質、食品などの栄養介入が、循環グルタチオンに重要な影響を与え、それが臨床上の利益につながることが示唆されている。重要なことは、遺伝的変異がグルタチオンの状態の修飾因子であり、グルタチオンレベルに影響を与える栄養因子に対する反応に影響を及ぼすことである。このナラティブレビューでは、グルタチオンの状態を改善するために使用可能な栄養戦略に関する臨床的証拠を検討する。
キーワード
ブロッコリー、がん予防、アブラナ科の野菜、グルタチオン、グルタチオンS-トランスフェラーゼ、緑茶、ニュートリゲノミクス、植物性栄養素、植物性食、セレン、ビタミン類
1. はじめに
グルタチオンは,トリペプチド(システイン,グリシン,グルタミン酸)の一種であり,多くの組織に比較的高い濃度で存在している [1]。グルタチオンは,酸化ストレスの軽減,酸化還元バランスの維持,代謝の解毒作用の促進,免疫系の調節などに極めて重要な役割を果たしている[1]。神経変性,ミトコンドリア機能障害,さらにはがんなど,加齢に伴うさまざまな慢性疾患は,グルタチオン濃度の低下や欠乏と関連しているとされる[1,2,3]。グルタチオンは、水銀や残留性有機汚染物質(POPs)などの化合物の肝臓での変換や排泄を促進することで、体内の毒素負荷を軽減するという有用性が認識されつつある[1,4,5]。
そのため、体内の内因性グルタチオン濃度を維持することは、健康の維持や疾病の軽減に重要であると考えられるが、グルタチオン濃度の低下と疾病リスクとの明確な因果関係はまだ解明されていない。これは、Halliwell[6]が「アンチオキシダント・パラドックス」と呼んでいるもので、グルタチオンのような抗酸化物質がプロオキシダント活性を持ち、体内の内因性抗酸化防御を強化するホルモン効果を引き起こすという状況を意味している。つまり、グルタチオンなどの抗酸化物質がプロオキシダント活性を持ち、内因性の抗酸化防御を強化するホルモン作用を持つ場合である。実際、レドックスバランスは病気の原因にも結果にもなるし、抗酸化物質がプロオキシダントになるレベルを知ることが難しい場合もある。そのため、健康におけるグルタチオン濃度の役割については、理解すべきことが多い。
グルタチオンの状態に影響を与える要因として、個人のグルタチオン産生能力のばらつきが挙げられる。科学論文や臨床医学で注目されている酵素には、グルタチオン-S-トランスフェラーゼやγ-グルタミルトランスフェラーゼがある。これらの酵素の中には、栄養因子の補酵素を必要とするものがある[1](図1)。酸化ストレスの増大、栄養失調、環境汚染物質への暴露による毒性負荷の増大などにより、グルタチオンの必要性がさらに高まる可能性がある[7,8,9]。表1には、グルタチオンの不足に関連するいくつかの疾患のリストが示されている。
図1 グルタチオンの肝合成と、代謝に影響を与える栄養基質、補酵素、その他の栄養素。キーとなる。
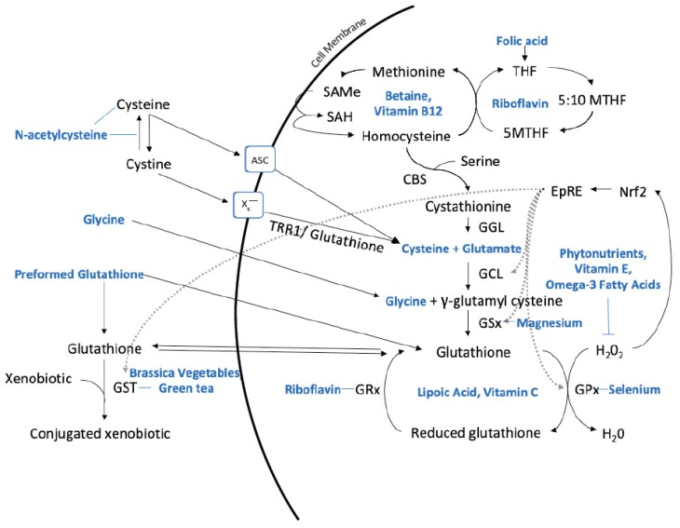
5-メチル-テトラヒドロフォレート(5MTHF)系アラニン-セリン-システイン(ASC)シスタチオニン-β-シンターゼ(CBS)シスタチオニンγ-リアーゼ(CGL)電解質応答要素(EpRE)グルタチオン-S-トランスフェラーゼ(GST)グルタミン酸システインリガーゼ(GCL)グルタチオン還元酵素(GRx)グルタチオンペルオキシダーゼ(GPx)。グルタチオンシンテターゼ(GSx)過酸化水素(H2O2)Nuclear factor erythroid factor-2-related factor 2(Nrf2)S-アデノシルメチオニン(SAMe)S-アデノシルホモシステイン(SAH)テトラヒドロフォレート(THF)チオレドキシンレダクターゼ1(TRR1)水(H2O)シスチン/グルタミン酸アンチポーターシステム(xc-)。説明 葉酸はTHFに還元されて5MTHFに変換され、続いてホモシステインに転移してメチオニンを生成する。メチオニンはSAMeを形成し、SAMeはメチル化反応によりSAHを生成する。SAHは加水分解されてホモシステインになる。ホモシステインは、メチオニンを再生するか、CBSとセリンの触媒活性を介してシスタチオニンを形成するトランス硫酸化経路に導かれる。CGLはシスタチオニンの硫黄-ガンマ炭素結合を切断してシステインを放出し、このシステインはGCLとGSxによってグルタチオンの形成に利用される。細胞外のシステインは、システイントランスポーターASCによって取り込まれるか、シスチンに酸化されてxc-システムによって取り込まれる。N-アセチルシステインはシステインを供与したり、血漿中のシスチンをシステインに還元したりする。細胞内のシスチンはTRR1やグルタチオンを介してシステインに還元される。γ-グルタミルシステインの合成はGCLによってシステインとグルタミン酸から触媒され、GSxを介してγ-グルタミルシステインにグリシンが付加されるとグルタチオンが生成される。GPxは、グルタチオンによるH2O2の還元を触媒し、還元型グルタチオンを形成し、GRxによってグルタチオンにリサイクルされる。また、グルタチオンはGSTを介して付加体を形成し、異性物質と結合することができる。酸化ストレスは、Nrf2経路を活性化し、EpRE依存的にGCL、GSx、GPx、GSTなどのグルタチオン代謝に関わる酵素の遺伝子発現を誘導し、細胞のレドックスホメオスタシスを回復させる。10,11,12,13,14]を参考にしている。
表1 グルタチオンに関連する臨床症状と疾患
| 研究の結果、多くの慢性疾患がグルタチオン濃度の低下と関連していることがわかった。そのため、グルタチオン濃度を高めることで、これらの疾患の予防や進行を抑えることができるという仮説が立てられた。以下に、グルタチオンの調節不全や欠乏に関連する疾患[2]や問題点[3]を紹介する。 |
| •老化[ 15 ]および関連する障害[ 3 ] |
| •アルツハイマー病[ 16 ] |
| •がん[ 17 ] |
| •慢性肝疾患[ 18 ] |
| •認知障害[ 19 ] |
| •嚢胞性線維症[ 20 ] |
| •糖尿病[ 21 ]、特に管理されていない糖尿病[ 22 ] |
| •ヒト免疫不全ウイルス(HIV)/後天性免疫不全症候群(AIDS)[ 23 ] |
| •高血圧[ 24 ] |
| •男性と女性の両方の不妊症[ 25 ] |
| •狼瘡[ 26 ] |
| •メンタルヘルス障害[ 27 ] |
| •多発性硬化症[ 28 ] |
| •神経変性疾患[ 29 ] |
| •パーキンソン病[ 30 ] |
低レベルのグルタチオンを修復する必要があるかもしれないが、過剰ではなく、適切なバランスが必要である。例えば、化学療法を受けている患者では、化学療法抵抗性を助長する可能性があるため、グルタチオンのモニタリングが必要になるかもしれない[17]。診断用バイオマーカーや治療ターゲットとしてのグルタチオンの利用には課題がある。赤血球(RBC)のグルタチオンは、臨床評価として容易に入手できるが、個体内変動が大きいことがわかっている[31]。しかし、この個人内変動は、時間の経過とともに比較的安定しており、これは、赤血球中のグルタチオンレベルを制御する遺伝子の変動に起因すると思われる現象である[32]。確立された赤血球グルタチオンの基準範囲が必要であり、赤血球グルタチオンの動的で個人的な追跡も考慮する必要があるかもしれない。血清γ-グルタミルトランスフェラーゼ(GGT)は、主に細胞外の還元型グルタチオンの代謝に関与しており、高値(女性では9U/L以上、男性では14〜20U/L以上)であっても「正常」基準範囲内であれば、グルタチオンの枯渇を示し、慢性疾患のリスクと関連している可能性がある[33]。
2. 遺伝子の欠失と一塩基多型(SNP)の役割
グルタチオンとその関連プロセスに影響を与え、その結果、疾患リスクに影響を及ぼす可能性のある一般的な一塩基多型(SNP)がいくつかある。これらは、解毒プロセスにおいて還元型グルタチオンを基質に結合させるグルタチオンS-トランスフェラーゼ(GST)という酵素をコードしている[34]。GSTP1とGSTM1には、複数のSNPが存在するが(例えば、GSTP1 rs1695, A105Gは、コドン105のアミノ酸がバリンからイソロイシンに置換されており、がんのリスクが高まるとされている)この総説で取り上げられているヌルアリルは、遺伝子を挟むH3領域とH5領域の間で遺伝子が欠失したものである[35]。酸化ストレス時には,GST遺伝子の発現が増加する。ある集団の20%から50%に影響を及ぼす最も一般的な多型の一つは、GSTM1遺伝子の欠失(GSTM1-null)であり、これは解毒能力を低下させ、その他の結果をもたらす可能性がある[36]。GSTT1(null)およびGSTP1(AB/BB)は、GST活性の低下に関連する追加の多型である[37]。これらの多型を1つ以上持つことは,特に汚染,喫煙,重金属,その他の毒素などの環境的誘因の影響を受けた場合に,特定の疾患のリスク増加と関連している[37]。
3. 栄養素によるグルタチオン生成の最適化
SNPsの存在や遺伝子の欠失、あるいは毒性負荷などの外因性の理由による生理的必要性の高まりなどにより、グルタチオンのレベルはある程度、食事やサプリメントによってサポートされる可能性がある。この総説では、最適なグルタチオンレベルを増加または維持する可能性のある特定の食品や栄養素の使用を支持する、重要なヒト臨床文献のレビューを試みる。
4. 前もって形成されたグルタチオン
グルタチオンをプレフォームされた状態で経口投与することは、潜在的に効率の悪いSNPや関連酵素の作用を無効にするため、最も効率的であると思われる。しかし、経口投与されたグルタチオンが消化器系のペプチダーゼによって分解されるかどうかについては、いくつかの議論があった[37,38]。この説をさらに裏付けるように、いくつかの研究 [39,40,41] では、急性 [40,41] または慢性 (4週間) [39] の経口グルタチオン補給にもかかわらず、グルタチオンレベルや酸化ストレスのパラメーターに変化がないことが示されている。
また、それとは逆の証拠もある。ある6ヵ月間の無作為化二重盲検プラセボ対照試験 [42] では、非喫煙成人54人を対象に、グルタチオンを250または1000mg/日のいずれかで経口摂取すると、用量依存的にグルタチオンの体内貯蔵量が有意に増加した。また、6カ月後には、全血中のグルタチオンの酸化型(GSSG)と還元型(GSH)の比率が改善するなど、酸化ストレスのマーカーが減少し、ナチュラルキラー細胞の細胞毒性も良好に増加した。
グルタチオンの経口投与に関するデータは様々で結論は出ていないが、最近の研究では、グルタチオンをリポソームや舌下に投与すると、生物学的利用率が高まり、全身のグルタチオン濃度に好影響を与えることが示唆されている。
健康な中年の非喫煙者12人に1日500mgまたは1000mgのリポソーム型グルタチオンを4週間投与した小規模な研究[43]では、体内のさまざまな部位でグルタチオン濃度が上昇する傾向が見られたが、2週間後の500mg投与では血漿でのみ有意な上昇が見られ、その上昇率も25%と最も大きかった。また、酸化型グルタチオンと還元型グルタチオンの比率にも改善が見られ、1週目と2週目に高用量を摂取した人では、この比率の減少が最も大きかった。また、酸化ストレスのバイオマーカーが減少し、リンパ球の増殖やナチュラルキラー細胞の活性などの免疫マーカーにも改善が見られた。
心血管危険因子を持つ健康な男性16人を対象とした別の小規模な研究[44]では、末梢の内皮機能と硬化を測定する反応性充血指数に異常が見られた人は、グルタチオン舌下投与を1日2回、100mg摂取すると動脈硬化が有意に減少した。
パーキンソン病患者において、グルタチオンの静脈内投与を用いた限られたデータが記録されている。Sechiら[45]は、9人のパーキンソン病患者にグルタチオンを静脈内投与(600mgを1日2回、30日間)し、有意な改善が報告され、治療を中止した後も2〜4ヶ月間持続した。パーキンソン病の61歳の男性を対象とした症例報告[46]では、グルテンフリーの食事、薬物療法、特定の栄養補助食品(N-アセチルシステインやSilybumなど)グルタチオン注射(1,400mg)を週に2〜3回投与するなど、多角的なプロトコルを用いて症状の改善が報告されている。
最後に、グルタチオンモノエステルを用いた予備的な細胞研究では、バイオアベイラビリティが向上するため、グルタチオンの効果的な送達剤となることが示されている[47]。
経口投与、舌下投与、リポソーム投与、静脈内投与など、どのような投与方法が最適なのかについては、依然として議論が続いている。静脈内投与、舌下投与、リポソーム投与は、消化中に生じる分解を回避できるため、経口補給よりも優れている可能性がある。
5. N-アセチルシステイン(NAC)
グルタチオンは、グリシン、システイン、グルタミン酸という3つの条件付き必須アミノ酸が、2段階の生化学的反応で結合してできる。まず,システインがグルタミン酸システインリガーゼの作用でグルタミン酸と結合してγ-グルタミルシステインが生成され,グルタチオン合成酵素を介してグリシンと結合する[48]。したがって、人体が十分な量のグルタチオンを作るためには、3つのアミノ酸すべてと十分な酵素機能が必要である[49,50]。システインは硫黄系アミノ酸であることから、特に硫黄系アミノ酸を多く含む食品を摂取することも、グルタチオン合成をサポートすることになるかもしれない[51,52]。
システインが律速段階であることはよく知られており、N-アセチルシステイン(NAC)がグルタチオンをサポートするサプリメントとして頻繁に研究、提案されている理由の根拠となっている[50]が、データのレビューによると、その使用は結論が出ていないか、曖昧であることがわかっている。認知マーカーに特定の焦点を当ててNACの補充を利用した12の臨床試験を含むシステマティックレビュー[53]は、特定の集団におけるNACの使用に何らかの利益があるかもしれないことを示しているが、研究はデザインと結果があまりにも多様であったため、決定的な結論を出すことはできなかった。今後の研究の提案として、GSTなどのグルタチオン関連酵素の遺伝子型を参加者に含めることで、異なる知見が得られる可能性があり、誰がより効果を期待できるのかを調査するのに役立つかもしれない。
軽度から中等度のパーキンソン病患者5名と対照群3名を対象としたある研究[30]では、高用量のNAC(3000mgを1日2回経口投与)を4週間投与したところ、システインレベルと抗酸化物質の測定値が上昇したが、酸化ストレスの測定値(4-ヒドロキシノネナールとマロンジアルデヒド)には相応の改善が見られず、脳内グルタチオンのレベルも上昇しないかった。さらに、参加者の中にはパーキンソン病の症状が悪化した人もいたが、NACの補給をやめると緩和された。
神経変性疾患の患者を対象とした別の研究[54]では,NACを単回静脈内投与することで,血中GSH/GSSG比と脳内グルタチオン濃度が上昇することがわかった。その比率の変化率が最も大きかった人は、脳内のグルタチオンのレベルの変化率も大きかった。この研究は小規模で期間も短かったため、これらの症状におけるNACの役割について結論を出すことはできなかったが、注目すべきは、NACを静脈内投与することで、脳内のレベルを変化させることができたという点である。
自閉症の子ども(n=31)に60mg/kg/日を3回に分けて投与した12週間の臨床試験[55]では、自閉症に伴う社会的障害には有意な影響が見られなかったものの、子どものグルタチオンレベルの上昇には有意な影響が見られた。他の研究と同様に、NACがグルタチオンレベルにどのような影響を与えるのか、補給に対する個人の反応を変化させる要因、および症状がどのように関連するのかについては、さらに調査する必要がある。GSTの多型は、NACの有効性に役割を果たしている可能性がある。男性(n=53)の騒音性難聴に対するNACの影響を調査したある研究[56]では、1日1,200mgを14日間摂取することで、騒音性の一時的な閾値変化、つまり仕事場で一定期間騒音にさらされた後に生じる難聴の量が、ベースライン、つまりシフト前のレベルに比べて有意に減少した。また、被験者をGST遺伝子型別に分類したところ、NACの摂取によって有意な効果が得られたのは、遺伝子型がNULLの被験者のみであったという。
NACは、グルタチオンレベルを高め、酸化ストレスに関連する問題を軽減する可能性のあるサプリメントとして期待されているが [57,58]、研究結果は決定的ではなく [59,60,61,62]、中には疾患別の結果もある。また、NACを摂取しても大きな影響がないという研究もある。さらに、NACは他のサプリメントの栄養素と相乗的に作用する可能性が示唆されている。例えば、グルタチオンの産生に関しては、特にNACと同時に補給した場合、グリシンがシステインと同様に重要である可能性が示唆されている[48]。さらなる研究が必要であるが、特に、十分な量のアミノ酸を持っていない人や、より高いレベルのグルタチオンを必要とする人には、グルタチオンの増加を確認するために、システインとグリシンの両方を補充することがより良いアプローチであるかもしれない。
例えば,健康な高齢者8名と対照群である若年者8名を対象とした小規模な研究[63]では,両群のベースラインのグルタチオン合成量を測定した後,高齢者には0.81 mmol NAC/kg/日(約132 mg/kg/日)と1.33 mmol グリシン/kg/日(約100 mg/kg/日)を14日間にわたって経口投与した。その結果、高齢者の赤血球中のグリシンは55.2%、システインは24.4%減少した。また、グルタチオンの量も対照群に比べて46.2%少なかった。しかし、サプリメントを摂取すると、グリシンは117.6%、システインは55.1%増加した。さらに、赤血球中のグルタチオン濃度も94.6%高く、若年層の対照者と高齢者のグルタチオン濃度にも統計的な差は見られなかったという。さらに、血漿中の酸化ストレスやF2-イソプロスタンの値も低かった。
研究者たちは、高齢者でグルタチオンが減少するのは、グルタチオン合成の前駆体であるグリシンとシステインの供給量が少ないためであり、サプリメントを摂取することで合成が促進され、レベルが回復するのではないかと推測している。印象的な結果ではあるが、今回の研究は小規模なものであることを認識することが重要だ。また、被験者が健康であったため、臨床的な効果に結びつかなかったことも注目すべき点である。
最後に、NACには、グルタチオン合成に必要なシステインを供給できることに加えて、抗酸化作用があることに留意する必要がある。酸化ストレスに対するNACの効果が、これらの抗酸化特性によるものなのか、それともグルタチオン合成の増加によるものなのかは不明である。
6. 食物性タンパク質に関する考察
理論的には、タンパク質の消化障害も健康的なグルタチオンレベルを確保する上での制限要因となりうる。低血漿アルブミン、低グルタチオンレベル、および/または、グルタチオン活性低下の症状(例えば、疲労)を持つ患者では、胃粘膜での塩酸生成の不足または減少、および/または、膵臓酵素の不全を評価することが重要であろう。次亜塩素酸症は、腸の生理機能が変化するため、実際、高齢者に多く見られる可能性があり[64]、特定の薬剤の使用も塩酸レベルに影響を与える可能性がある[65]。さらに、酸化ストレス (生理的グルタチオン濃度の低下など) [66,67] や特定の栄養素の欠乏 [68] も、胃酸濃度の低下につながる可能性がある。
グルタチオンの前駆体および基礎となるのはアミノ酸であるため、食事性タンパク質の摂取は、グルタチオンを合成する際に使用するアミノ酸プールに影響を与える可能性がある。タンパク質の摂取量を減らしても安全なレベルにとどめるなど、タンパク質の消費量を変化させると[69]、血漿中のグルタチオン合成量が変化し、抗酸化能力の低下につながる可能性がある。今回の研究では,窒素バランスの観点からは,タンパク質を減らしても(安全とされる最低量以上を維持して)回復することができたが,グルタチオンレベルの機能的変化が平衡化するまでには時間がかかることがわかった。5-L-オキソプロリンの尿中排泄量は、グルタチオンの動態、特にグリシンの利用状況を追跡するためのマーカーとして提案された。
ほとんどの人が1日の必要量を満たすためにタンパク質を補給する必要はないが、追加のタンパク質が必要な場合に有益な供給源となりうるのがホエイプロテインであり、これはシステインの含有量が高いためであると考えられる[70]。健康な人を対象とした小規模な研究(n = 18)では、ホエイプロテインを15,30,または45g/日の用量で14日間補給すると、リンパ球のグルタチオンレベルが用量依存的に増加し、45g/日の用量ではリンパ球のグルタチオンが24%増加した[71]。がん患者(n = 23)を対象とした別の小規模な無作為化対照研究 [72] では、亜鉛とセレンに加えて乳清タンパク質単離物を40g摂取したところ、対照群(n = 19)と比較して免疫グロブリンG値が4.8%増加するなど、グルタチオン値(11.7%)だけでなく、機能的な免疫マーカーも増加した。さらに、パーキンソン病患者を対象とした小規模な研究[70]では、大豆タンパクと比較して乳清タンパクを補給すると、血中グルタチオン濃度とGSH/GSSG比が有意に上昇することがわかったが、病気の臨床マーカーには有意な影響がなかった。
グルタチオンの合成をサポートするアミノ酸は、グルタチオン前駆体以外にも潜在的に存在する。いくつかの動物実験 [73,74] によると、非必須アミノ酸であるセリンは、システインの利用可能性を高め、過メチル化を減少させることで、グルタチオンの生成にプラスの影響を与える可能性がある。また、セリンは、グルタチオン合成に使用される前駆体アミノ酸の1つであるグリシンに代謝されることで、グルタチオンレベルをサポートする可能性もある。
7. オメガ3系脂肪酸
慢性的な炎症は、酸化ストレスを助長し、グルタチオンの供給を枯渇させる可能性がある[75]。炎症性および抗炎症性プロスタグランジンの産生に関与していることから、オメガ3脂肪酸はグルタチオンレベルへの影響について研究されている。ある研究[76]では、1日4000mgのオメガ3系サプリメントを12週間摂取したところ、プラセボを摂取した対照群と比較して、うつ病の発症リスクが高い高齢者では、GSH-クレアチン比が改善し、抑うつ症状が軽減した。パーキンソン病患者を対象とした別の研究では、亜麻仁油から抽出した1000mgのオメガ3脂肪酸と400IUのビタミンEを12週間摂取することで、グルタチオン濃度だけでなく、総抗酸化力が増加し、炎症マーカーである高感度C反応性タンパク質とインスリン代謝のマーカーが減少することがわかった[77]。
ある研究 [78] では、シンガポールの閉経後の中国人女性を対象に、オメガ3脂肪酸と乳がんリスクの関係にGST多型が与える影響を調査した。GST活性を低下させる遺伝子多型を持つ女性では、海洋由来のオメガ3脂肪酸の食事摂取による保護効果の増大が確認された。GST活性低下の遺伝子多型(GSTT1-null遺伝子型)を持つ海洋性オメガ3脂肪酸の高摂取者は、低摂取者に比べてリスクが少なくとも64%減少し、一部の多型ではさらに大きな保護効果が得られた。
最後に、オメガ3脂肪酸とビタミンEの併用による酸化ストレスパラメータの調査を行った9つの研究の最近のシステマティックレビュー[79]では、グルタチオン濃度、スーパーオキシドディスムターゼやカタラーゼなどの選択的酵素に有意な変化は見られなかった。
鮭はオメガ3脂肪酸の全食品として、グルタチオンの状態に好影響を与える可能性がある。妊娠中の女性では、妊娠20週目から週に2回鮭を摂取することで、グルタチオン濃度が上昇した [80]。魚油カプセルとサケを比較したところ、グルタチオンの状態に有意な差は見られなかったが [81]。
8. ビタミン
8.1. ビタミンB群
リボフラビンは、酸化されたグルタチオンを抗酸化機能に必要な化合物である還元型に変換するグルタチオン還元酵素の活性に必要な補酵素である[82]。リボフラビンの欠乏がグルタチオンレベルに悪影響を及ぼすことを確認した研究は少ないものの、ホモシステインの生成およびメチル化プロセスにはリボフラビンが必要であることが示唆されている [83,84]。メチル化サイクルは、トランス硫酸化経路およびグルタチオン代謝のサイクルと密接に関連しているため、リボフラビンレベルは重要であると考えられる。したがって、リボフラビンの欠乏は、グルタチオンの機能に影響を与え、さらに体内のレベルにも影響を与える可能性がある。生化学的な観点からは、パントテン酸(ビタミンB5)も、ATP産生における役割を通じてグルタチオン合成をサポートする可能性がある[85]。B12の欠乏[86]は、グルタチオンレベルの低下と関連している。
8.2. ビタミンC
アスコルビン酸欠乏症の48人[87]において、ビタミンCを1日500または1000mg、13週間摂取すると、プラセボと比較して、リンパ球のグルタチオンレベルが18%増加した。同様に,自分で選んだビタミンC制限食[88]と最初の1週間のプラセボ補給を行った健康な成人を対象に,6週間の試験で2週目と3週目に1日500mg,4週目と5週目に1日2000mgのL-アスコルビン酸を摂取すると,赤血球中のグルタチオンレベルが上昇した。低用量の1日500mgが最も顕著なグルタチオンレベルの上昇をもたらした。
8.3. ビタミンE
ビタミンEの補給は、内因性酸化ストレスレベルが高い糖尿病患者において、限られた範囲で研究されている[89,90]。1型糖尿病の小児[91]では、ビタミンEの補給(DL-α-トコフェロール、1日100IUの経口投与)により、グルタチオンが9%有意に増加し、赤血球中の脂質過酸化(マロンジアルデヒド)が23%、HbA1c濃度が16%低下した。1型糖尿病の子供20名と健康な対照者20名を対象とした同様の研究 [92] では、ビタミンE 600 mg/日を3ヵ月間摂取することで、糖尿病の子供の酸化ストレスマーカーとグルタチオン濃度が改善されたことが分かった。また,糖尿病性神経障害を有する成人(n = 54)[93]において,ビタミンEサプリメント(800 IU/日)を12週間投与した群は,プラセボを投与した群と比較して,心血管代謝パラメータおよび血漿グルタチオンレベルが有意に改善された。
9. その他の栄養素
9.1. α-リポ酸
α-リポ酸は、フリーラジカル種の直接的なスカベンジャーとしての機能と、グルタチオンなどの内因性抗酸化物質の再生を助ける機能を併せ持つ多機能な化合物である。多様な集団を対象とした様々な臨床試験 [94,95,96,97,98,99] は、α-リポ酸が抗酸化能力の回復に重要であることを示唆していると思われる。タンパク質栄養失調による酸化ストレスを抱える子供たちに、600mgの還元型グルタチオンを1日2回、50mgのα-リポ酸を1日2回、または100mgのNACを1日2回、20日間投与した[100]。グルタチオンとα-リポ酸は,これらの小児の生存率を対照群と比較して改善した。HIV感染成人(n=33)を1日3回300mgのα-リポ酸またはプラセボのいずれかに6ヶ月間割り当てたところ、治療群では対照群に比べて血中総グルタチオンおよびリンパ球反応が上昇した[101]。
9.2. セレン
セレンは抗酸化物質として知られており、グルタチオンペルオキシダーゼの補酵素でもある。マウスを用いた研究 [102] では、セレンを補給することで、特定のグルタチオン関連酵素の発現および活性が増加した。健康な成人336人(黒人161人、白人175人)を対象とした別の研究 [103]では、セレン濃度とセレンの補充量との間に正の関係が認められた。セレンの補充量が同程度であったにもかかわらず、グルタチオンレベルは黒人よりも白人の方が大きく増加した。過剰なセレンは、酸化ストレスを緩和するというよりもむしろ酸化ストレスの一因となる可能性があり、この効果は特定の遺伝子型に関連している可能性があることに留意する価値がある [104]。
9.3. 植物性栄養素
生理的に高用量の抗酸化ビタミンやミネラルを、植物栄養素とは別に補給すると、臨床結果が異なる可能性がある。不利な点としては、細胞の酸化還元状態を主にプロオキシダントな状態に変化させることが挙げられる[105]。したがって、酸化ストレスに対する生来の防御力を強化し、グルタチオンレベルを向上させるための安全なアプローチの1つとして、複数の植物栄養素の多様性と多面的作用を利用することが最善であると考えられる。この理論を裏付けるように、介入研究においても、果物と野菜の摂取が酸化ストレスを軽減することが示されている[106]。大多数の人が野菜と果物の1日の摂取量を満たしていないため、人々が1日の摂取量を得るための持続可能で創造的な方法が必要である [112]。
果物と野菜の摂取がグルタチオンとグルタチオン関連酵素のレベルに及ぼす影響を調べた研究 [113] はほとんどない。GST活性の高さは、がん予防と関連している[114]。これまでの細胞および動物実験 [115,116,117,118,119,120] では、特定の植物性食品成分(例えば、ブラシカ野菜のグルコシノレート代謝物およびジチオチオン、アリウム科のジアリルスルフィド、柑橘類由来のリモノイドおよびフラボノイド)が酵素活性を好意的にアップレギュレートする可能性が示されている [121] 。
94人の被験者を対象としたある臨床研究では、食事、ライフスタイル、GSTM1およびGSTT1-nullの多型をモニタリングした。また、一部の被験者を対象に、直腸GST酵素活性を測定した。その結果、果物、特に柑橘系の果物は、酵素活性が高いことと正の相関があることがわかった。野菜、特にブラシカ種は、GSTM1-plus遺伝子型保有者のGST酵素活性と相関していたが、GSTM1-null保有者では相関していなかった。アリウム野菜は酵素活性に影響しなかった。
9.4. アブラナ科の野菜
アブラナ科の野菜を摂取することで、解毒作用やがん予防効果があることを示唆する研究が数多くあり[122,123]、特に消化管に関連するがんについてはその効果が顕著である[124]。研究 [125,126] では、スルフォラファンなどのアブラナ科由来の化合物を投与すると、グルタチオン、グルタチオン関連酵素、さらには内因性の抗酸化酵素や炎症マーカーが増加する可能性が示されているが、その結果は必ずしも一貫していない [115] 。これらの化合物は、GST多型を持つ人にとって特に重要であると考えられる。
ワシントン州シアトルにあるフレッド・ハッチンソンがん研究センターの研究グループは、アブラナ科の野菜が酵素活性に影響を与えるかどうかを調べるために、さまざまなGST遺伝子型を持つ人を対象としたいくつかの摂食試験を発表している [117,127,128,129,130,131]。結果は必ずしも一貫していないものの、GST多型を持つ人のGSTを増加させるのにアブラナ科の野菜が有効である傾向があることを示唆する限られたデータがある[117,127][128,130,132]。無作為化クロスオーバー臨床試験[127]では,男性33人と女性34人が,野菜を含まない食事(「基礎食」),基礎食にアブラナ科野菜の単回投与または2回投与を加えた食事,および体重キログラムに標準化したレベルでアブラナ科野菜とアピアケス科野菜を単回投与した食事の4種類の食事をそれぞれ14日間摂取した。その結果,アブラナ科野菜の摂取(単回投与または2回投与)は,特にGSTM1-null/GSTT1-null遺伝子型を持つ男性被験者において,GSTA1/2の増加につながることが示された。
クロスオーバーデザイン[133]では,健康な若い喫煙者(n = 27)が蒸したブロッコリー(1日250 g)または対照食を10日間摂取した。ブロッコリーの摂取により,酸化したDNAが41%減少し,過酸化水素によるDNA鎖の切断に対する抵抗力が23%増加した。しかし、GSTM1-nullの遺伝子型を持つ人では、より高い保護効果が得られた。さらに,82人の喫煙者を対象とした別の研究[124]では,クレソンから抽出したアブラナ科の化合物である2-フェネチルイソチオシアネート(PEITC)を経口投与すると,揮発性の発がん物質であるベンゼンとアクロレインの解毒が促進され,GSTM1とGSTT1の両方の遺伝子型が欠損している場合にはさらに強い効果が見られた。GSTM1とGSTT1の両方の遺伝子を持つ人にはPEITCの効果は見られなかった。
9.5. 緑茶
緑茶の摂取は、白血病などの特定の癌の発生率の低下と関連している[134]。中国で行われた多施設共同ケースコントロール研究[134]では、成人白血病が確認された442例と対照442例を対象に、緑茶の摂取量とGST遺伝子型が評価された。研究者らは、緑茶を飲まない人と比較して、緑茶の飲用と成人白血病リスクとの間に逆相関があることを発見しただけでなく、GSTT1が存在するキャリアよりもGSTT1が存在しない遺伝子型を持つ人の方が、がんリスクの減少がより顕著であることを発見した。
メタボリックシンドロームの肥満者35名を、緑茶(1日4杯)水(1日4杯)緑茶エキス(2カプセル+1日4杯の水)のいずれかの介入を8週間受けるように無作為に割り付けた[135]。ベースライン時と研究終了時に,血液サンプルと食事記録が収集された。緑茶と緑茶エキスのいずれも、水のみを摂取したグループと比較して、血漿抗酸化能と全血グルタチオンを有意に増加させた。
9.6. ジュース研究
野菜や果物を食べることが困難な人にとって、これらの食品から作られたジュースを飲むことは、健康的な選択肢の一つとなるかもしれないが、医療専門家の中には単純糖分を気にする人もいるであろう。一般に、臨床研究は、果物および/または野菜のジュースを飲むことが、抗酸化状態の改善などの健康上の利点をもたらすことを示唆している[136,137,138,139]。
ポリフェノールが含まれており、これらの成分が酸化ストレスを軽減する役割を果たしていることから、ザクロやブドウのジュースなど、ポリフェノールが豊富なジュースを検討している研究者もいる。集中的なウェイトリフティングセッションを受けた9人のエリートウェイトリフターにおいて、ザクロジュースは、ポリフェノールを含まないプラセボと比較して、酸化ストレスを軽減し、抗酸化酵素活性を改善した(グルタチオンペルオキシダーゼの+6.8%の増加を含む)[140]。さらに,GST多型を有する喫煙者を対象とした研究[141]では,紫ぶどうジュースの補給(1日480ミリリットル,8週間)が有意な影響を及ぼし,全参加者のDNA損傷の大幅な減少につながった。GSTM1-nullグループでは血漿中のビタミンEが増加し、GSTM1-presentグループではグルタチオンレベルが上昇し、GSTT1-present遺伝子型では血中ビタミンCレベルが上昇したことから、ブドウジュースの抗酸化作用の影響が参加者の遺伝子型によって異なることが示された。血圧への影響も遺伝子型によって異なっていた。24人を対象とした別の介入研究 [142] では、クロスオーバーデザインを用いて、1日に400mLの従来型のブドウジュース、有機栽培のブドウジュース、または水を摂取するように被験者を割り当てました。遺伝子型は調査されなかったが,抗酸化酵素の血中マーカーは,ベースライン時に測定され,その後,最大3時間にわたって急性期に測定された。両方のグレープジュースを飲むと、水に比べて、グルタチオン、総酸化防止能、カタラーゼ、スーパーオキシドディスムターゼ、グルタチオンペルオキシダーゼが有意に増加した。グルタチオンの増加は、摂取後1時間でピークに達した。
ポリフェノールとは関係ないが、別の研究では、1日300mLのケールジュースを6週間にわたって摂取すると、GSTサブタイプに応じてさまざまな効果が得られたことが示されている[143]。特にビタミンCレベルとDNA損傷において、GSTM1-null遺伝子タイプがケールジュースから最も良好な影響を受けたとのことである。
9.7. ハーブと根菜類
ヒトの臨床試験データは不足しているが、ローズマリー[144,145,146]、ターメリック/クルクミン[147]、ミルクシスル[148]、イチョウ葉[149]など、特定のハーブや根菜類がグルタチオンレベルに影響を与える可能性を示す動物実験がいくつかある。ローズマリー抽出物を0.25〜1.0重量%の濃度で雌ラットの食餌に投与したところ、肝GSTが3.5〜4.5倍に増加した。腹腔内に注入した場合も増加が見られたが、その程度は小さかった[145]。動物実験では、ウコン抽出物とクルクミンが肝グルタチオン含量を増加させることが示された[150]。
9.8. グルタチオンを含む植物性食品
このレビューでは、主にグルタチオンレベルとグルタチオンの活性に関連する酵素を増加させることで、抗酸化防御をサポートする目的の食品や食事由来の栄養素に焦点を当てていたが、チオールリッチ化合物であるグルタチオン、NAC、システインを含むいくつかの食品があることは注目に値する(表2)。グルタチオンをサポートする食事をするには、これらの食品、特に緑色の食品、アスパラガス、アボカド、キュウリ、インゲン、ホウレンソウを毎日取り入れることが必要である。いくつかの調理のコツを表3に示する。
表2 硫黄を多く含む果物と野菜([151]より改変
| 食物 | グルタチオン | NAC | システイン |
|---|---|---|---|
| アスパラガス | 349±26 | 46±1 | 122±1 |
| アボカド | 339±10 | ND | 4±1 |
| バナナ | ND | ND | 7±0 |
| ブロッコリー | 4±1 | ND | ND |
| にんじん | 4±0 | ND | ND |
| カリフラワー | 6±1 | ND | 7±1 |
| キュウリ | 123±38 | 6±1 | 11±3 |
| グレープフルーツ | 13±3 | 4±0 | 15±2 |
| サヤインゲン | 230±2 | ND | 67±11 |
| ピーマン | 8±1 | 12±2 | 9±1 |
| グリーンスカッシュ | 47±11 | ND | 6±1 |
| レモン | 5±0 | 4±0 | 6±0 |
| マンゴー | 59±6 | ND | 10±0 |
| オレンジ | 5±11 | ND | 41±2 |
| パパイヤ | 136±12 | ND | 58±5 |
| パセリ | 17±9 | 9±1 | 8±1 |
| ポテト | 5±0 | ND | ND |
| 唐辛子 | 42±2 | 25±4 | 349±18 |
| ほうれん草 | 313±33 | ND | 84±2 |
| イチゴ | 39±8 | 5±1 | 59±5 |
| トマト | 64±10 | 3±1 | 55±3 |
| イエロースカッシュ | 39±8 | ND | 27±6 |
値は平均値±SD(n = 3)ND = not detectable)。数字はnM/g wet weight(3サンプルの平均±SD)を表す。
表3 硫黄分を多く含む野菜の調理法のポイント
- 硫黄化合物の完全性を維持するために、できれば生か軽く蒸して食べる [152] 。
- ブロッコリーなどのアブラナ科の野菜の冷凍は控える [153] 。
- スルフォラファン含有量を増加させるために、加熱過程で粉末状のマスタードシードを加える [154,155] 。
グルタチオンの状態を向上させるために特別に設計された多成分の食事介入はまだ研究されていないが、マウスに西洋風の食事を与えると肝でのグルタチオン合成が阻害され、血漿レベルが低下すること [156]、およびヒトでは伝統的な地中海風の食事を遵守すると血漿グルタチオンが高くなること [157]は興味深いことである。グルタチオンレベルを最適化するために特別にデザインされた食品ベースの栄養介入は、さらなる研究のための実りある分野となりうる。
10. 結論
グルタチオンは、疾病リスクと健康状態に関連するバイオマーカーであり、健康の最適化、疾病予防、治療に関連する重要なターゲットとなる可能性がある。赤血球グルタチオンやGGTの基準範囲は確立されておらず、個人内変動の影響を受ける可能性が高いが、これらのバイオマーカーを用いてグルタチオンの状態を個人に合わせて動的にモニターすることは可能であると考えられる。さらに、臨床応用に向けた課題としては、グルタチオンと疾患リスクおよび臨床転帰との間の明確な因果関係、グルタチオンの状態に対する遺伝的変異の影響、およびグルタチオンの状態に影響を与える栄養因子への反応が挙げられる。また、グルタチオンの状態を向上させる栄養介入の能力を探るエビデンスには曖昧さがあり、最適な投与量や投与形態を明らかにするとともに、特定の栄養素や食品に反応する可能性が高い個人のサブグループを特定するためには、さらなる研究が必要である。
しかし、前述の課題にもかかわらず、グルタチオンの状態を高めることが示されているグルタチオン前駆体、補酵素、およびグルタチオンの供給源である全食品の食事摂取を最適化することは、比較的簡単で低コストかつ安全なアプローチであり、個人のグルタチオンの状態を最適化することで健康を増進することができることは明らかである。臨床現場では、グルタチオンの状態を改善することを示唆する証拠がある食品(赤身のたんぱく質、黄銅色の野菜、ポリフェノールが豊富な果物や野菜、ハーブやスパイス、緑茶、魚などのオメガ3脂肪酸が豊富な食品)を摂取するようにアドバイスすることで実施することができる。また、特定の状況下では、栄養補助食品も有効である(表4)。グルタチオンを豊富に含む食品がグルタチオンの状態に影響を与える可能性についても、解明が必要である。グルタチオンの状態を高めるために特別にデザインされた多成分の食事療法は、臨床医学と将来の研究にとってエキサイティングな機会となる。
表4 グルタチオンレベルをサポートする栄養素と食品の概要
| 栄養素と食品 | 推奨用量 |
|---|---|
| アルファリポ酸 | 300mg3×日; 200〜600mg /日[ 158 ] |
| アブラナ属の野菜 | 250g /日 |
| クルクミン | 安全な12g /日までの用量; 1〜2g /日が抗酸化能力に役立つことがわかっています。ピペリンによる生物学的利用能の増加[ 159 ] |
| 果物と野菜のジュース | 300〜400mL /日 |
| グルタチオン(リポソーム) | 500〜1000mg /日[ 43 ] |
| グルタチオン(経口) | 500-1000 mg /日[ 41、42 ] |
| グリシン | 100mg / kg /日[ 63 ] |
| 緑茶 | 4カップ/日 |
| N-アセチルシステイン | 600-1200ミリグラム/分割用量で一日が、6000 mg /日までは、研究に有効であることが示されている[ 30、53、56、160 ] |
| オメガ3脂肪酸 | 4000mg /日[ 76 ] |
| 鮭 | 150gを週2回[ 80 ] |
| セレン | 247μg/日のセレン強化酵母; 100〜200 ug /日。毒性のために400 UG /日ウォッチ上記のもの[ 103、160 ] |
| ビタミンC | 500-2000 mg /日[ 87、88 ] |
| ビタミンE | 100~400 IU /日[ 77、91 ] |
| 乳漿タンパク | 40g /日[ 72 ] |
