Contents
A Potential Role for Photobiomodulation Therapy in Disease Treatment and Prevention in the Era of COVID-19
オンラインで公開2020年12月1日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7673843/
Ann Liebert,1,2,3,* Brian Bicknell,4,3 Wayne Markman,5,3 and Hosen Kiat6,7,8
要旨
COVID-19は進化するパンデミックであり、ウイルスを封じ込めることを困難にする要因が組み合わさって、世界的な影響を広範囲に及ばせている。感染症の症状は壊滅的なものであったり、少なくとも脆弱な人々にとっては非常に衰弱する可能性がある。入院や死亡を含むウイルスの悪影響のリスクが最も高いのは高齢者であることは明らかである。その他のリスクがあるのは、心血管疾患や代謝疾患などの併存疾患を持つ人や、免疫反応が過敏な人である。ウイルスに対する急性反応を持つ患者に対する治療法は限られており、これらの重篤な影響を緩和することができる潜在的な戦略が緊急に必要とされている。探索されていない治療のための1つの潜在的な手段は、マイクロバイオーム腸/肺軸である。ウイルスに対する急性反応によって重篤な影響を受けた人々に加えて、感染の影響からの回復が遅い人々や、ウイルスの拡散を阻止するために実施された対策によって悪影響を受けた人々のための治療オプションも必要とされている。
治療の選択肢の一つとして、光生物学的調節(PBM)療法が考えられる。PBMは、炎症性疾患、痛み、組織治癒、細胞エネルギーのための安全で効果的な非侵襲的で簡単に導入できる補助的な治療オプションであることが長年にわたって示されていた。また、最近では、腸内マイクロバイオームを変化させるPBMの有効性も実証されている。PBM療法は、高齢者や併存疾患を持つ人など、COVID-19に対して最も脆弱な人のための潜在的な治療法として検討する価値がある。この治療法は、ウイルス感染者、ウイルスの影響からの回復が遅い人、COVID-19パンデミックを抑制するために課せられた隔離制限のために通常の運動やリハビリテーションプログラムを拒否されている人にとって、潜在的に有利な治療法となる可能性がある。
キーワード
COVID-19,光生体調節、免疫調節、ミトコンドリア機能不全、マイクロバイオーム
はじめに
2019年12月に初めて報告された(www.who.int/csr/don/05-january-2020-pneumonia-of-unkown-cause-china/en/)が、現在、2100万人以上が新型重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に感染している。感染自体とその治療法は、世界で50万人以上の死亡者を出しており、それは日々増加し続けている www.worldometers.info/coronavirus/。
コロナウイルスの異なるタイプの数百ではない場合は数十があるが、そのうちの4つは、軽度と主に上気道感染症(いわゆる風邪)を引き起こすことが示されている; 2株は、呼吸器感染症の重度と頻繁に致死的なアウトブレイクを引き起こす 2002年にSARs(重度急性呼吸器症候群)と呼ばれる1つは、他の、MERs(中東呼吸器症候群)は 2012年に発生した。2019年後半から猛威を振るっている3番目の最新のコロナウイルスパンデミックは、まだ別の株によって引き起こされている。ウイルス粒子は直径約100ナノメートルで、電子顕微鏡でしか見ることができない。ヒトへのウイルスのエアロゾルまたは飛沫感染は、口、鼻、目の粘膜表面を介して侵入を得る[1]。ウイルスの侵入は、血管内皮、腎臓、心血管系組織、小腸の上皮に発現する膜関連酵素であるアンジオテンシン変換酵素2(ACE2)受容体を介して媒介される。ACE2発現と感染症との関係は明らかにされていない[2]。アンジオテンシン変換酵素阻害薬やアンジオテンシン受容体拮抗薬による心血管疾患(心血管疾患)の治療は、ACE2発現をアップレギュレートさせる追加効果があり、個々のウイルス応答において重要な役割を果たしている可能性がある。
症状が明らかになるまでの潜伏期間の中央値は4.9~5.8日で、1~14日の範囲である[3]。一度感染して伝染すると、ヒトでは比較的長い潜伏期間が感染の拡大を促進する [3]。潜伏期間を過ぎても、感染者の症状は、症状がないか、または最小限のものから、華麗で急速に進行する呼吸窮迫まで、多岐にわたる。高齢者はCOVID-19の劇症的なシークアラ[4-6]に最も素因があり、おそらく免疫系の老化、炎症性疾患の発現の増加、および蓄積されたミトコンドリア機能不全によるものと考えられている[7]。米国では、全死亡者の77%が65歳以上の年齢層である[5]。免疫系に影響を与える慢性的な併存疾患を持つ人は、心血管疾患 [8]、II型糖尿病(2型糖尿病)[9,10]、慢性呼吸器疾患[10]、高血圧[10]、癌[11]、メタボリックシンドローム[12]、肥満[13,14]を含む、2番目にリスクの高いグループである。COVID-19による死亡者の1%未満が併存疾患を有していないことが報告されている[15]。第三の影響を受けやすいグループは、神経系や内皮および血管反応に影響を与え、免疫反応が過剰に亢進する神経免疫軸を持つ人々である。このような人たちは若年層であることが多く、環境ストレス因子に対して過興奮性の生理的反応を示すことがある。この反応の危険因子には、片頭痛、紅色筋痛症、てんかんなどのイオンチャネルパチーの遺伝子型が含まれており、その結果、これらの内皮感受性が生じる [16]。このグループは、より高い知性を持っている可能性があり [17]、医療従事者の中では過剰に代表されている可能性がある。医療従事者は一般人口と比較して罹患率および死亡率が高い可能性があるが [18]、これはこの免疫過剰興奮性が何らかの影響を与えている可能性がある。
ウイルスに感染しやすい人は、免疫の調節障害、不随意な脱酸素、呼吸困難、多臓器不全、異化状態の長期化による衰弱などに陥る可能性がある。重要なことに、COVID-19感染症の管理に現在使用されている抗生物質や大量のコルチコステロイド、抗ウイルス剤、免疫調節剤などに関連した心血管系のADRが確立されていることや潜在的な心血管系のADRを含む治療介入に対する副作用(ADR)を受けることもしばしばある[19,20]。感染の他の特徴としては、心血管障害[2]、心房細動[21]、感染者の3分の1以上に影響を及ぼす中枢神経系および末梢神経系症状[22]、口内潰瘍、および嗅覚過敏/無嗅覚(嗅覚喪失)などが挙げられる。肺炎への急速で劇症的な進行は、高齢者や併存疾患のある人に起こることがある。これは、初期の免疫反応の低下に続いて、不適切な過剰免疫反応または「サイトカインストーム」が起こる結果として起こると考えられている。その結果として生じる絶え間ない炎症は、肺組織および血管構造を含む重要な器官に影響を及ぼす [6]。この過剰反応性の免疫反応は、好中球の勧誘と活性化に関連している可能性がある [24]。その後の細胞損傷および多臓器不全は、感染そのものよりも死亡リスクを高め、特に高齢者および併存疾患を持つ人に多く見られる。COVID-19のサイトカインストーム[25, 26]を予防または鎮静化するために、コルチコステロイドを含む免疫抑制療法 clinicaltrials.gov/ct2/show/NCT04355247 が行われているが、これまでのところ、ささやかな成功にとどまっている。より標的を絞った治療法が緊急に必要とされている。
COVID-19からの回復はしばしば長期化し、長期的な予後はまだ完全には実現されていない。未知の割合では、退院後も継続的な症状があり、また、あからさまな呼吸器症状やその他の生命を脅かすような症状が回復している。www.theguardian.com/australia-news/2020/jul/17/most-COVID-19-patients-admitted-to-a-sydney-hospital-in-march-still-have-symptoms によると、退院後3~4ヶ月の時点で、回復したCOVID-19患者の80%までは症状が継続していたと報告されている。非特異的な痛みや痛み、呼吸困難、動悸、関節や胸部の痛み、めまいや軽い頭痛、頭痛、疲労感、低呼吸、無呼吸はまれではない [27]。より重篤な進行性の症状には、肺高血圧や間質性線維症、心嚢液貯留や心筋炎、自律神経失調症[28]、筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)[29]、うつ病[30]、自己免疫疾患[31]などの神経学的および神経精神医学的症状がある。
COVID-19パンデミックの結果としてあまり認識されていないのは、パンデミックを封じ込めるために取られた措置が、パンデミック弱者に与えた意図しない影響である。このような人々の多くは、封鎖期間やウイルスの蔓延と戦うために必要な社会的隔離のために、人付き合いができず、運動やリハビリのクラスに参加することができなかった。このストレスは、対策が保護するように設計されている個人(高齢者や併存疾患を持つ人)の回復力や免疫力を低下させる効果がある[32]。
現在のCOVID-19パンデミックに対する魔法の弾丸のような解決策は、効果的なワクチンに向けて多くの研究が行われているが、近い将来には考えられない。交差感染を減らすための幅広い社会的・生活習慣的対策は、一部の地域や国では成功しているが、他の地域や国では成功していない[33]。新規で効果的な薬物療法、疾病予防のためのワクチン、COVID-19と戦うための既存の薬剤の再利用などの開発と発見が精力的に進められているが[34]、COVID-19パンデミックの重篤な影響や副作用を軽減することを目的とした、学際的な共同研究を含む潜在的な戦略の大規模臨床試験も必要とされている[5]。
消化管マイクロバイオームへのリンク
腸内マイクロバイオームと疾患感受性との間には強い関連性があり、COVID-19が最も可能性が高い[35]。腸内細菌叢は免疫に影響を与えることがよく知られており[36, 37]、腸粘膜と相互作用し、プロおよび抗炎症性サイトカインの産生を刺激する。炎症性の低い状態は健康な腸内細菌叢をサポートし、その結果、非炎症性の状態を維持することに貢献する。腸内細菌叢へのカスケードは粘膜バリアの崩壊につながり、調節障害を起こした微生物集団の微生物産物が周囲の組織に漏出し、炎症反応を増加させ、腸内細菌叢はさらに肥大化する。これは、一般的に免疫力の低下およびCOVID-19感受性に寄与することが知られている併存疾患(肥満、2型糖尿病、心臓病など)に寄与している。高齢者では、腸内微生物の多様性が低下していることが多く、腸内環境の悪化に寄与している。さらに、腸のマイクロバイオームと肺の健康を結びつける腸/肺軸があり[38]、腸の代謝物は肺に移行し[37]、腸内細菌は急性呼吸窮迫症候群(ARDS)への対応において重要な役割を果たしている[35]。少数の入院COVID-19患者のマイクロバイオーム解析の初期の結果では、健康なマイクロバイオームを代表する細菌が枯渇し、日和見病原体が濃縮されるなど、マイクロバイオームが悪影響を受けていることが示されていた[39]。これらの変化は疾患の重症度と相関しており、入院期間を通して持続していた。
食事やサプリメントで腸内マイクロバイオータの構成を変化させることで、一般的に免疫力を向上させることができる[40]一方で、マイクロバイオームを変化させることで(水溶性食物繊維で)アレルギー性肺炎の重症度を低下させることが示されている[41]。腸内マイクロバイオームの変調(食事、水溶性食物繊維、プロバイオティクスと)は、一般的にウイルス性呼吸器感染症を支援するための潜在的な方法として示唆されている[42]と特に[35]でSARS-Cov-2。腸内細菌叢がACE2受容体と心血管系の健康に影響を及ぼす可能性があり、それゆえに心肺治療の潜在的なターゲットであるという憶測がある[43]。さらに、ACE2受容体は腸内腸球でも発現している[35]。ACE2の発現(マウスモデルでは)は、COVID-19入院中に枯渇した集団の一部である腸内マイクロバイオーム(バクテロイデス種)の特定の種によって制御されうる[39]。このことの意味合いはまだ調査されていない。
口腔内マイクロバイオームもまた、免疫の重要な構成要素である。健康な微生物集団は、免疫系の異常、炎症反応、または口腔衛生状態の悪さによって障害されることがある[44]。乱れた微生物群は、ウイルス感染を防ぐことができないだけでなく、歯周炎、心血管疾患、アルツハイマー病[45]などの多くの疾患に関与している[46]。興味深いことに、歯周病は、肥満、心血管疾患、2型糖尿病、および加齢と強い関連があり、COVID-19の予後不良に関連する同じ併存疾患と関連しており、口腔内マイクロバイオーム異常症およびCOVID-19に対する感受性の可能性が提起されている[47,48]。口腔衛生の改善は、健康な口腔マイクロバイオームを維持する方法として示唆されており、これはウイルス感染に対してある程度保護されている可能性がある[49]。
臨床医学における光生体変調(PBM)療法
古くから、太陽光を含む光は、無数の病気に対する幅広い健康効果があることが知られている。1903年、デンマークの医師ニールス・リベリ・フィンセン博士は、紫外線や青色の光で結核を、赤色の光で天然痘を治療した功績により、ノーベル医学生理学賞を受賞した[50]。低レベルレーザー治療とも呼ばれるPBM治療の現代的な臨床実践は、半世紀以上前にハンガリーのSemmelweis医科大学のEndre Mester博士と同僚たちが創傷治癒に対する治療効果を実証して以来、進化を続けてきた結果である[51]。
PBMは、狭い波長帯の光(LEDまたはレーザー)を使用して、熱効果を伴わない細胞応答を変調させるものである。事実上、PBMは健康へのリスクがなく[52-54]、その安全性プロファイルは超音波検査と同等である。多くの薬物療法とは異なり、PBMは重篤な副作用がなく、その性質上、非侵襲的である。PBM療法は、ほとんどの場合、携帯型、携帯型、装着型の機器を使って10~20分以内に行われ、安全に繰り返し行うことができる。1回の治療で測定可能な症状や臨床的効果が得られるが、PBM療法は通常、複数回の治療セッションの経過として提供される。
PBMの主な標的は、ミトコンドリアの電子輸送鎖、特に複合体IV、シトクロム-C-オキシダーゼであると考えられており、発色団として作用し、赤色光および近赤外光を吸収する[55]。この吸収の効果は、複合体からの活性酸素種(ROS)の放出であると考えられており、膜電位の上昇、ATP産生の増加、およびATP、cAMP、ROS、Ca2+および一酸化窒素(NO)を介した下流の細胞シグナル伝達を可能にし、遺伝子の転写に影響を与える[55]。また、オプシンや光活性化イオンチャネルなど、結果として生じる生理学的効果を伴って光を吸収することができる他の多くの発色団も存在する。免疫調節におけるPBMの送達に最も効果的な波長は、シトクロム-C-オキシダーゼとポルフィリンの吸収ピークが640nmに、HbO2が900nmに集中していることから、赤色および近赤外領域であると考えられる[55]。効果的なPBMに必要なエネルギーは低く、1~16ジュール/cm2の範囲である。PBMの線量は二相性であり、ある閾値以上(照射量ウインドウの外側)では、エネルギーを増加させても治療効果は増加しないことを意味する[56]。
PBMは、多くの臓器システムにおいて、身体に多くの効果をもたらし、細胞およびミトコンドリアレベルでの作用を通じて、様々な障害を治療することができる(図1)[55]。実験モデルでは、PBMに対する免疫応答の程度およびタイプは、治療が適用される解剖学的表面によって影響を受ける。例えば、免疫調節効果は、四肢に比べて胸腺領域に適用した場合、インターロイキン(IL)-2、一酸化窒素(NO)およびヒートショックプロテイン70産生の好ましい上昇を伴って、より効果的であるように思われた。治療量、累積投与量、および曝露の持続時間も役割を果たしているようであり、治療持続時間が過度に長引くと、免疫抑制に対する治療効果の減衰および逆転を引き起こす可能性さえある[57]。
図1 光生物学的調節療法を用いた治療が成功していることが示されている疾患
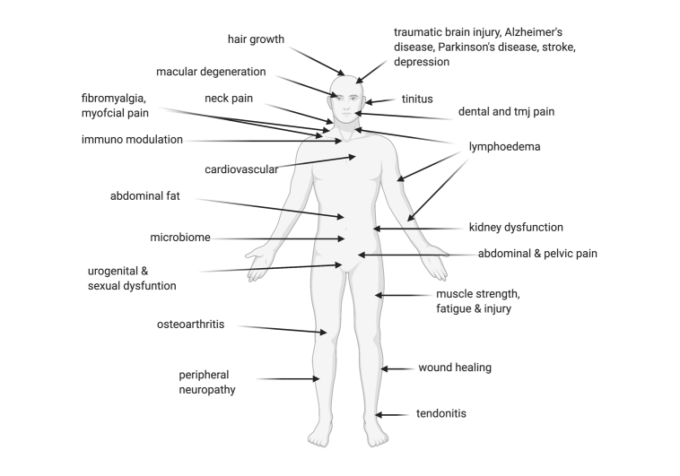
文献には、炎症を含む多くの疾患過程におけるPBMの治療効果が実証された実験や臨床試験が数多くある。最近では、MSCC/ISOOガイドライン(www.mascc.org/mucositis-guidelines)で、化学療法や放射線療法後の口腔粘膜炎の治療の標準治療としてPBM療法が推奨されている。
光生体調節療法と一般的な健康
PBMは、細胞や組織の一般的な健康と回復力を向上させることが示されている。PBMのミトコンドリア代謝やATP生成を改善する効果は、スポーツや陸上競技における筋力やパフォーマンスの向上につながり[58, 59]、動物や細胞培養モデルにおいて筋肉の衰えや変性の減少につながることが示されいてる。[60-62]。このことから、呼吸窮迫下のCOVID-19症例の治療の候補となる。PBMは、損傷または病変した細胞、組織および個体において、より効果的であることが実証されている[55]。また、PBMは、胸壁の筋肉を治療すると慢性閉塞性気道疾患に効果があることが示されている[63]。効率的なミトコンドリアは、病気の克服や回復過程においても重要である。多くの場合、ミトコンドリアの機能不全は加齢とともに増加し、感染症やその他の免疫障害の後の回復を可能にするには十分ではない場合がある[64]。PBMはミトコンドリア機能を高めることが知られているが、動物モデルでの老化過程に対するPBMのプラスの効果は、ヒトではまだ実証されていない[65]。また、PBMのミトコンドリアへの作用は、転写因子を活性化する効果があり、炎症性シグナル伝達に関与する遺伝子の発現増加につながる可能性がある[66]。
PBMは、動物モデルにおいて心筋梗塞の縮小や炎症の軽減に有効であり[67]、ヒト心血管疾患の治療法として示唆されており[68]、ACE2の発現を調節することが示されている[67]。また、PBMは、重要な血管拡張因子であるNOの放出により、末梢および中枢神経系の両方で血流と酸素化を改善することが示されている[69, 70]。PBM療法は、ウイルス感染後の慢性疲労、線維筋痛症や中枢性疼痛の他の例と同様に、治療に使用されている[71]。
免疫調節におけるPBMのエビデンスと潜在的メカニズム
PBMは炎症および免疫の調節において多能性効果を発揮するようである[72]。多くの研究で、PBMは活性化した炎症細胞から放出されるプロ炎症性サイトカイン(IL-1β、IL-6,IL-8,TNF-αなど)やその他の炎症マーカーを減少させ、一方で抗炎症性サイトカイン(IL-10)を増加させることで炎症を調節することが実証されている[72]。サイトカイン調節および補体カスケードに対するPBMの免疫調節効果は、強力な抗炎症分子であるa-MSHを含むPOMC/メラノコルチンシグナル伝達経路の直接的な調節を介して視床下部下垂体軸の調節を含むPOMC経路を介して起こる。POMC経路はPBMによって制御されており[73]、PBMはACTHとβ-オピオイドの両方、そして興味深いことにACE活性[74]を調節している。
免疫応答に対するPBMの中心的な効果の一つは、好中球数のバランスを整え、好中球効率を改善し、好中球の細胞外トラップ形成を調節することにより、好中球機能の調節を介している[75]。好中球の過剰蓄積を減少させることは、急性肺炎の軽減におけるPBMの効果の主要なメカニズムである[77]。これは、自己免疫疾患におけるサイトカインストームのカスケードを防ぐ上で極めて重要である。PBMはまた、M1およびM2マクロファージの表現型の比率を調節し、プロ炎症性サイトカインおよびケモカインを減少させ、抗炎症性サイトカインを増加させ、このように炎症プロセスのバランスをとる[78]。
PBMによって促進されるこれらの炎症性変化は、多くの身体プロセスに深遠な影響を及ぼす。例えば、PBM療法は、末梢血単核球およびCD4+細胞を調節して、IL-10を増加させ、IFN-γを減少させることにより、多発性硬化症患者および健常成人における炎症作用を減少させることが示されている[79,80]。PBMは、肺線維化のマウスモデルにおいて、炎症性細胞数、プロ炎症性サイトカイン、および線維化組織を減少させる[81]。ラットの急性肺炎症は、PBMで浮腫、好中球流入、TNF-αを減少させ、ラットではIL-10を減少させている[82]。
Yuら[83]は、ラットの誘導性急性腹膜炎の実験モデルにおいて、PBMは対照群と比較してリンパ球の増殖とリンパ球ATP合成の亢進をもたらし、PBM群の60日生存率は対照群の2倍であったことを示した(p<0.001)。Assisら[84]はさらにPBMの免疫調節能力を実証し、PBMで治療された敗血症ラットではIL-6活性が低下し、アトロジン-1およびMuRF-1の免疫発現が低下した(敗血症に関連した筋異化状態のマーカー)。
PBMは分裂刺激応答性リンパ球の増殖とリンパ球のATP合成を亢進させる[83]。PBMによって誘導されたリンパ球増殖のもっともらしいメカニズムは、光とヘモグロビンの反応を介して酸素ラジカルを産生することである[85]。実際、免疫細胞では、PBMは活性酸素種、NOまたはインターロイキンの産生を最も頻繁に誘導し、抗炎症効果につながる[85]。様々な免疫応答プロセスが細胞エネルギーに大きく依存しており、敗血症や敗血症性ショックの症例では後者のエネルギーが低下していることはよく知られている[86, 87]。ミトコンドリアはおそらく、PBMの光受容体として作用し、リンパ球やマクロファージを含む様々な細胞において、核酸合成の活性化と細胞増殖の引き金となるいくつかの経路を介して、細胞エネルギー合成を強固に再活性化してATPレベルを再確立している[88, 89]。
気道炎症、腸内マイクロバイオームおよび自律神経失調症におけるPBM
PBMは、腸の虚血および再灌流によって誘導される急性肺損傷のマウスモデルにおいて、プロ炎症性サイトカイン(IL-6,TNF-α)を減少させ、抗炎症性サイトカイン(IL-10)を増加させることにより、好中球の活性化を制御し、プロと抗酸化メディエーターのバランスを回復させるのに有効であることが示されている[82, 90]。これはまた、肺線維症のマウスモデル[91]およびタバコの煙によって誘導される慢性閉塞性気道疾患[92]においても示されている。炎症を助長する肺への好中球の浸潤も、PBMによって減少する[78]。
肺炎を治療するためのPBM療法の有効性は、従来の治療のみを受けた45人の乳児と、対照として別の18人の健康な新生児を受けたのと比較して、「Vostok」レーザー治療装置を用いたレーザー治療も2~3日間受けた場合に報告されている。未熟児網膜症の治療に赤色光治療を使用した試験[93]では、注目すべき副作用として、治療群の未熟児21人全員の生存が確認されたが、非治療群の4人は肺の合併症で死亡した(pers.com. また、ARDSはPBM療法で正常に治療できることが報告されている[94]。
我々は以前、マウスモデルでPBMが腸内マイクロバイオームを好ましい形で変化させることを示した[95]。我々はまた、多くのヒト試験で腸内マイクロバイオームに好ましい変化を示しており(準備中の原稿)現在、PBMが口腔内マイクロバイオームを変化させる可能性を調査している。腸内マイクロバイオームへの影響のメカニズムの一つとして、PBMによる腹部の脂肪組織の炎症の抑制が考えられる。ダイエット、プレバイオティクス、運動、またはPBMのいずれかによって、腸内マイクロバイオームを不摂生状態から改善することは、炎症プロセスを減少させ、一般的な健康状態を改善し、将来のサイトカインストームを含む、将来の免疫学的な侮辱から保護することになるであろう[96]。
最近では、神経学的および神経精神疾患の多くの症状に対処するための経頭蓋PBMの使用に大きな関心が寄せられている[97]。経頭蓋デバイスは、神経振動を変調させることが示されており[70,98]、健康な成人の認知を改善し、TBIs患者の認知パフォーマンスを改善し[99]、うつ病の症状を改善することが示されている[100]。我々は、パーキンソン病患者の認知スコアの改善において、PBM療法が肯定的な効果を示すことを実証した(原稿準備中)。
COVID-19に対するPBMの可能性
最近の出版物の中には、血液を直接または経皮的に標的とすることでCOVID-19の治療および/または回復にPBM療法が有用であることが示唆されている[101, 102] [102, 103] 、および/または肺を標的とすることで[104]。呼吸筋に対するPBM療法の少なくとも1つの試験が進行中であり、https://clinicaltrials.gov/ct2/show/NCT04386694,ロシアではCOVID-19の治療法としてPBM療法が試みられている www.lazmik.ru/assets/templates/docs/Coronaviridae_SARS_COVID-19_LLLT_protocol_eng1.pdf。重度のCOVID-19肺炎患者に対するPBM療法の有効性についての最近の症例報告が1件ある[105]。
COVID-19の危機には、PBM療法の恩恵を受ける可能性のある分野がいくつかあり、特に高齢者や、ウイルスに対して特に脆弱な併存疾患や状態を持つ人々の間では、その恩恵を受ける可能性がある。
- ウイルスに感染して集中治療室に入院している患者さんは、胸部へのPBM療法により、気道の改善、血液の酸素化の改善、呼吸を補助するための筋力の向上が期待できる。PBMはまた、免疫系のバランスを整え、サイトカインストームへの進行に抵抗するために免疫の過活動を抑えるのに役立つかもしれない。同様のメカニズムは、ウイルスに感染した脆弱な人が、入院につながるような症状の悪化を回避するのに役立つかもしれない。
- しかし、COVID-19におけるPBM療法の主な臨床的有用性は、回復期に慢性的な症状を呈し続ける患者(高齢者、複数の併存疾患を持つ患者、免疫興奮性の高い患者など)にあるようである。これらのグループは特に回復が長期化した重篤な感染症にかかりやすい。PBM療法は、細胞エネルギーと全身の健康状態、肺の免疫機能、腸内微生物/免疫状態、脳機能を改善し、筋肉疲労を軽減する可能性がある。また、パーキンソン病患者において、PBMがアノスミア(嗅覚脱失)を容易に逆転させることが示されている(原稿準備中)。短期的には、PBM療法によりCOVID-19からの回復が改善され、感染後の後遺症リスクが減少する可能性がある。長期的には、PBM療法により、これらの集団におけるウイルス感染に対する脆弱性を高める併存疾患が改善される可能性がある。また、ウイルス感染に対する過剰反応のリスクが高い若年層の高興奮性者を特定することも重要であろう。
- ロックダウンや社会的孤立化によって、定期的な運動や通常のリハビリテーションに参加することができないなどの悪影響を受けている人も、上記と同様にPBM療法の恩恵を受ける可能性が高い。
- PBMのもう一つの利点は、ワクチン接種の補助療法としての効果である。高齢者や併存疾患を持つ人は、ワクチンに反応しない、または反応しない傾向が最も強い[106]。柏木ら[107]は、近赤外レーザーがワクチン接種のアジュバントとして作用し、免疫グロブリン-Eを増強することなく、皮内インフルエンザワクチン接種に対する免疫応答を有意に増加させることを実証した。このことは、マウスインフルエンザ致死量チャレンジモデルにおいて、アジュバントされていないワクチンコントロールと比較して、保護の増加をもたらした。このように、PBMが非侵襲的でリスクがなく、簡単に導入できるアジュバント療法として、特にリスクの高い集団に効果を発揮することは、エキサイティングな仮説である。
結論
COVID-19は、免疫状態や炎症状態に影響を与える併存疾患を持つ人々の大きな課題であるだけでなく、免疫応答の老化、ベースラインの炎症の増加、ミトコンドリア機能不全の増加、腸内マイクロバイオームにおける微生物の多様性の低下という複合的な問題を抱えている高齢者においても、特に攻撃的である。PBM療法は、さらなる迅速な評価に値するものであり、特に最もリスクの高い集団に適した、安全で、非侵襲的で、副作用がなく、容易に導入できる補助的な治療法と予防法を提供できる可能性がある。COVID-19感染症や病気の予防におけるPBMの役割を評価する研究は、最終的には高齢者や慢性病人に利益をもたらすだけでなく、様々な疾患の予防、治療、治癒における低リスク、低コストの介入として、より大きな影響を及ぼす可能性がある。これは、COVID-19の影響を受けた最も脆弱な人々、特にウイルスに感染した高齢者、感染の影響からの回復が遅い人々、および必要な隔離制限のために通常の運動/リハビリテーションプログラムを拒否されている人々に意味を持つ可能性がある。
