A metabolic handbook for the COVID-19 pandemic
pubmed.ncbi.nlm.nih.gov/32694793/
要旨
感染症アウトブレイクの場合、臨床的な解決策は通常、効率的な病原体の破壊に焦点を当てている。しかし、COVID-19パンデミックは、感染症が複雑で多系統の状態であり、生存率を最大化するためには全体的な理解が必要であることを思い出させてくれる。
COVID-19や他のすべての感染症にとって、代謝過程は、感染症の発症メカニズムやその結果として生じる病態や病態生理、さらには感染に対する宿主の防御反応と密接に関連している。
ここでは、代謝とCOVID-19との関係を検討する。2型糖尿病や高血圧などの既往の代謝異常が重症・重症感染症の重要な危険因子である理由を論じ、これらの代謝異常の病態生理とCOVID-19の疾患経過との間の類似性を強調する。
また、細胞レベル、組織レベル、臓器レベルでの代謝が感染症に対する防御を促進するためにどのように利用されるかについて、耐病メカニズムに焦点を当てて議論し、COVID-19の生存者にとっての長期的な代謝的影響について推測している。
主な研究内容
重症急性呼吸器症候群(SARS)コロナウイルス2(SARS-CoV-2)と呼ばれる新型コロナウイルス(CoV)によるCOVID-19アウトブレイクは、2019年12月下旬に中国の武漢で初めて検出された。中国以外では2020年1月に最初の症例が報告され、3月には世界保健機関(WHO)(http://who.int/)がアウトブレイクをパンデミックと宣言した。本パースの執筆時点で、世界保健機関によると、200カ国以上からCOVID-19の症例が報告されており、世界的に700万人近くの症例と40万人の死亡者が報告されている。
感染症発生時の即時の対応は病原体の観点からアプローチすることであるが、それは疾病の重症度が病原体の負担と直接関係しているからである1。しかし、SARS-CoV-2感染症の複雑さは、この視点だけでは感染症の生存率を理解するのに十分ではないことを思い出させてくれる2。
ほとんどの感染症と同様に、SARS-CoV-2の病原性は連続的に存在している。これらの重症化・重症化は、感染に対する宿主の反応によって引き起こされ、結果として多系統の機能不全と病理学を引き起こす。
COVID-19患者に見られる病態は、感染症の中では必ずしも新しいものではない。例えば、極端な凝固および多臓器障害は、臨界期に進行する多様な感染症の結果であり得る。むしろ、このパンデミックは、感染症を生き抜く方法を理解できるように、感染症に対する私たちの視点を変える必要性を浮き彫りにしている2。
COVID-19や他のすべての感染症については、この視点は、
- 感染症の発症機序、病態、病態生理学の理解、
- 既往症の病態とその結果としての病態生理学(免疫機能の変化を超えて)が、感染症が発症した後の病気への感受性にどのように影響するかの理解を必要とする。
- ダメージとその結果として生じる病態生理を防御する身体の内在的防御機構、
- 病態と病態生理を緩和し、抗ウイルスベースのアプローチを補完する治療法を開発する方法。
COVID-19は多臓器疾患であるため、感染症生存者における回復およびリハビリテーションのプロセスを理解することも重要であるが、感染症治療のこの側面は非常に軽視されている。重症または重症のCOVID-19の生存者は、感染から数年後には様々な病的症状を示すようになる。
私たちは、感染や患者の治療によって生じた損傷が、回復期における新たな病態の発現にどのように影響を及ぼすかを理解しなければならない。ウイルスに焦点を当てた研究から一歩踏み出すことができれば、患者の健康寿命と生活の質を最大限に高めるために、感染を乗り切り、完全に回復させる方法を学ぶことができるであろう。
代謝は、COVID-19感染後の感受性、回復、生存の重要なレギュレーターとして浮上してくるであろう。感染症と宿主の代謝プロセスは密接に関連しており、宿主の代謝の変化は、感染の間、細胞、組織、臓器、生理学的なすべてのレベルで起こる4,5,6。
COVID-19では、これらの変化は細胞レベルで最も明らかであり、ウイルスが宿主の細胞機械をハイジャックしてウイルスの複製をサポートし、病原性を促進する。しかし、組織、臓器および生理学的レベルでの宿主の代謝応答はまた、ウイルス感染中に発生し、これらの応答のいくつかは、感染症から身を守るために宿主の適応メカニズムを反映している可能性が高い4,5。
代謝が病原体を破壊する宿主の抵抗性反応にどのように影響するかを理解することが最も注目されてきたが、最近の他の感染症からの証拠は、代謝プロセスが感染中に起こる生理的損傷から保護し、結果として生存を可能にする宿主防御機構の重要なメディエーターであることを実証している5,7,8,9,10。
さらに、COVID-19に関する初期の臨床データでは、2型糖尿病(2型糖尿病)やその他の代謝性健康状態が全体的に悪化している人は、感染症に罹患する前に代謝的に健康であった人よりも、より重篤な感染コースを発症するリスクが高いことが実証されている11。この知見は、主にこれらの個人がウイルス感染と複製に寛容であることに起因しているが、メタボリックシンドロームと 2型糖尿病 によって引き起こされる生理的合併症は、おそらく、ウイルスの負担とは無関係に COVID-19 関連の病理学を開発するために個人をより敏感にしている。
最後に、SARS感染症や他の重篤な疾患から生き残った人は、回復過程で代謝性合併症を発症しやすく、これらの感染症やその治療法が、代謝性健康に長期にわたる巻き添え被害をもたらす可能性があることを示唆している。この観点では、代謝とCOVID-19との関係について論じる。2型糖尿病や高血圧などの代謝健康を損なう既往の代謝異常が、重症・重症感染症の重要な危険因子となりうる理由を論じ、これらの代謝異常の病態生理とCOVID-19の疾患経過との間の類似性を強調している。
また、細胞レベル、組織レベル、臓器レベルでの代謝が感染症に対する防御を促進するためにどのように利用されるかについて、耐病性メカニズムに焦点を当てて議論し、COVID-19の生存者にとっての長期的な代謝的影響について推測する。
代謝の健康とCOVID-19の疾患経過
SARS-CoV-2感染による宿主の健康への影響は複雑であり、病気の重症度にはかなりのばらつきが見られる(図1)。COVID-19の症例は、無症状者と症候性者のいずれかに分類される。無症状者は感染者の25~50%を占め、SARS-CoV-2が陽性で症状を示さないキャリアと、ウイルスが陰性であるが、症状を示さずに先行感染を示す血清転換を示すキャリアで構成されている12(http://CDC.gov/)。
感染時には、これらの人々は、健康維持の表現型6を示し、時間をかけて健康を維持している。症状のある人には、症状のない前症状期の後に病気を示す人が含まれる。これらの人々の約80%は「軽度」の病状を示し、残りの20%は肺炎、急性呼吸窮迫症候群(ARDS)、呼吸不全、敗血症性ショック、多臓器不全を伴う重症・重症の段階に進行する3。
図1:COVID-19患者の病期
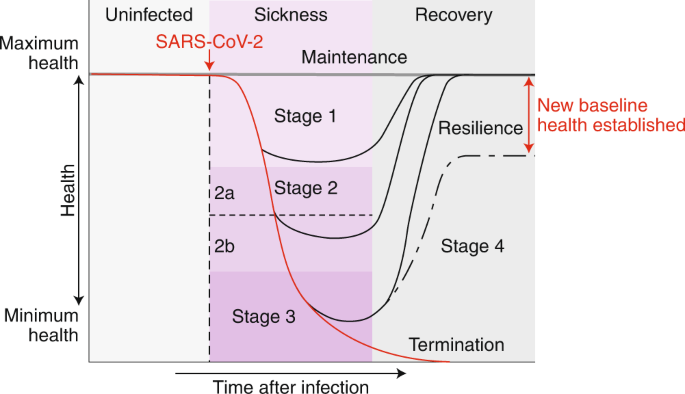
図1
感染後、患者は健康な状態を維持し、病気の兆候を示さない(健康維持)。症状が出た場合の経過は、4つの段階に分けて説明することができる。ステージ1は軽症で、発熱、倦怠感、乾いた咳などを呈する。ステージ2は、低酸素を伴わない、または伴わない肺炎の段階が特徴である(2a、2b)。
疾患経過に沿ってさらに進行した患者は、急性呼吸窮迫症候群、ショックまたは多臓器不全を発症する(ステージ3 III)。感染から回復する患者(ステージ4)は回復力のある表現型を示する。患者の中には元の健康状態に戻らない人もいて、健康のための新たなベースラインが確立される。ステージ1または2でピークを迎えた患者は、それぞれステージ2または3を回避して回復期に入る。
症状のある人の臨床経過は4つのステージに分けられる(図1)。
- ステージ1は、症状が出てから始まる3。一般的には、乾いた咳と発熱を呈し、味覚や嗅覚を失い、全身の倦怠感を感じることがある。ほとんどの人にとっては、十分なセルフケアを行えば、感染はこの段階に限定されている3。
- ステージ2は、感染の肺期を表する3。この段階に入ると、低酸素を伴わない場合(ステージ2a)と、低酸素を伴う場合(ステージ2b)のいずれかで、肺炎や肺炎を発症する3。このような人は入院が必要になる。低酸素状態が長く続くと、機械換気が必要になる傾向がある3。
- その後、患者はステージ3に進行する可能性がある。このような患者は重体であり、ARDSや肺外全身性高炎症症候群を発症する可能性がある。さらに、ショック、血管閉塞、呼吸不全、心肺虚脱、心筋炎、急性腎障害、その他の肺外合併症を発症する可能性がある3。
これらの患者の予後は悪く、一部の患者は死亡に向けて衰え続けるが、他の患者は回復期であるステージ4に入り、生き残って回復力のある健康表現型を示す4(図1)。
個人の代謝の健康は、複数の生理学的システムによって調整された生体の代謝プロセスが適切に機能していることによって表される。これらのシステムが障害されると、生体の代謝プロセスが機能不全に陥り、代謝健康度が低下する(図2)。重症化したCOVID-19の主な危険因子は、代謝健康状態の低下である(図2)。
過去のコロナウイルスのアウトブレイクでは、2型糖尿病は感染者の最も一般的な併存疾患の一つであった13,14。この所見と一致して、2型糖尿病、肥満、高血圧はCOVID-19感染者の主要な併存疾患のようであり、より重症で重症なCOVID-19の疾患コースと関連している15,16,17。この所見の理由は多因子性である可能性が高く、従来は免疫機能障害が関与していると考えられている。
例えば、メタボリックシンドロームおよび2型糖尿病を有する患者は、一般的に免疫機能が低下しており18、SARS-CoV-2に対する抗ウイルス反応が結果的に低下している可能性がある。また、2型糖尿病やメタボリックシンドロームの生理的合併症もSARS-CoV-2の発症に相乗的な役割を果たしている可能性が高く、ウイルス負荷とは無関係に重篤な病態を発症しやすくなっている。
同様に、米国の COVID-19 の患者の中では、肥満の若年者は入院を必要とし、より重篤で重篤な疾患を発症する可能性が高い19。この所見は、肥満が若年成人のCOVID-19をより重症で重篤な症例へとシフトさせる可能性を示唆している。考えられる説明としては、肥満が横隔膜のエクスカーションを阻害することで換気に物理的ストレスを与えることが考えられる。さらに、糖尿病は肺線維症、慢性閉塞性肺疾患、呼吸機能低下のリスクを高める(図2)。
COVID-19感染者が肺の段階まで進行して肺炎やARDSを発症すると、これらの状態がさらに患者の呼吸や低酸素状態を複雑化させ、多臓器障害を引き起こすことになる。
図2 メタボリックシンドローム、2型糖尿病、COVID-19の類似性。
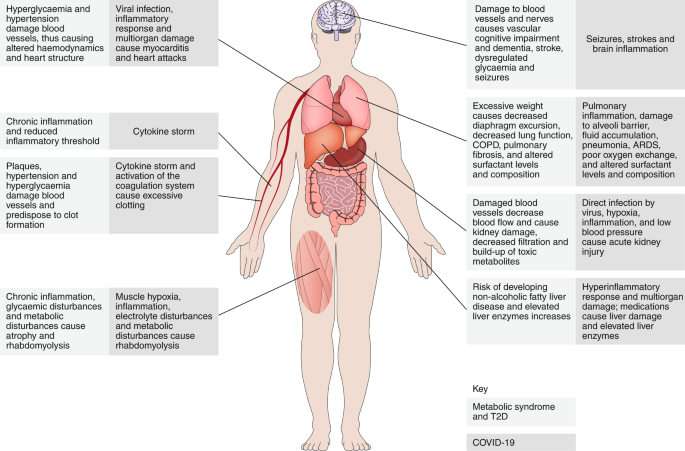
図2
COVID-19、メタボリックシンドロームおよび2型糖尿病は多系統疾患である。メタボリックシンドロームや2型糖尿病の病態や病態生理は、COVID-19によって損傷を受けたシステムと同じシステムに影響を与えるため、おそらく患者は感染中により重篤な病態を発症しやすくなると考えられている。
重要なことは、伝統的にメタボリックシンドロームと2型糖尿病は免疫機能の低下により感染症にかかりやすくなると考えられてきたが、生理学的な観点からこれらの病態の類似性を理解することは、COVID-19に対するこれらの患者のより大きな感受性は、ウイルス感染を制御できないというよりも、病理学的な感受性の増加とその結果として生じる病態生理学に起因するものである可能性が高いことを示唆している。COPD、慢性閉塞性肺疾患。
メタボリックシンドロームや2型糖尿病による追加的な生理的変化は、COVID-19との相乗効果により、疾患経過をさらに複雑にしている可能性が高い。メタボリックシンドロームと2型糖尿病は慢性炎症状態である(図2)。COVID-19の重症期と重症期は、感染に対する過剰な炎症反応(サイトカインストーム)によって駆動されるため、メタボリックシンドロームの既往歴のある患者では、ベースラインの炎症状態が高くなると、炎症反応が病原性レベルに達する可能性が高くなり、生理的障害が発生する可能性が高くなる20(図2)。
同様に、糖尿病と高血圧だけでも腎臓病の危険因子となる。糖尿病は、腎臓機能の低下21,22により、他の臓器にダメージを与える有害代謝物が蓄積される糖尿病性腎疾患を引き起こする(図2)。高血圧による血管の損傷は、腎臓への血流を低下させ、結果として腎障害を引き起こする(図2)。腎障害はCOVID-19の合併症としてよく見られることから(参考文献23)、これらの既往代謝状態による腎障害は、SARS-CoV-2感染時に腎障害を起こしやすくなる可能性がある。
肥満、糖尿病および高血圧は、脳卒中および心血管合併症のリスクを増加させ、これはCOVID-19の重症および重症の症例でも観察される(文献24,25および図2)。持続的な高血糖および肥満は血管を損傷し、プラーク蓄積の危険因子であり、それ自体が血栓を引き起こすのに十分である。COVID-19を有する人は凝固反応の悪化を示し、これはプラークを有する既存の損傷血管と組み合わせて、脳卒中または肺塞栓症の可能性を増加させる可能性がある。肥満と糖尿病の血管への影響は高血圧につながり、その結果、血行動態に影響を与え、心臓の構造を変化させる(図2)。
これらの変化は、宿主の炎症反応、ARDSによる低酸素、ウイルスによる心臓の感染、または肺外多臓器障害に反応した他の心臓への影響により、心臓が損傷を受けやすくなる可能性があり、したがって、COVID-19を有する一部の人々が心臓損傷および心臓発作のような疾患の徴候を示す理由を説明する可能性がある。
最後に、脳では、糖尿病患者の血管および神経の損傷は、血管性認知障害、認知症および脳卒中を引き起こす。また、糖尿病患者の血糖値の調節異常は、発作を引き起こす26。COVID-19の人は発作、脳卒中、脳炎を経験し、代謝の悪い人は脳の健康に悪影響を及ぼす既往因子があるため、これらの疾患を発症しやすくなる可能性がある(図2)。
糖尿病患者における高血圧、心血管疾患、腎症、網膜症の有病率は、これらの疾患の発症にレニン-アンジオテンシン系(RAS)が関与していることを示唆している。RASの活性代謝物であり、末梢血管抵抗を増加させる強力な血管収縮剤であるアンジオテンシンIIは、インスリン抵抗性を引き起こし、腎臓でのナトリウム吸収を調節する。
臨床試験でのRAS阻害薬による治療は、糖尿病患者の血管合併症を減少させることが明らかになっている27。SARS-CoV-2の宿主細胞への侵入を媒介する受容体であるアンジオテンシン変換酵素2(ACE2)は、アンジオテンシンIIの作用に拮抗し、血管拡張を誘導する。
2型糖尿病の人では、ACE2の発現はSARS-CoV-2の複数の標的組織で上昇しており(参考文献28)、この上昇は糖尿病に関連した生理機能障害から体を保護する適応機構であることが提案されている29。この発現上昇は、SARS-CoV-2の侵入とその後の複製、および2型糖尿病患者の体内での拡散を促進する可能性がある。したがって、2型糖尿病における代謝健康をサポートするために使用される生理学的防御戦略は、COVID-19のコンテキストでは不適応である可能性がある。
糖尿病における慢性高血糖がCOVID-19の疾患経過を複雑にする損傷をもたらすのに対し、新たなエビデンスは、COVID-19および2型糖尿病を有する人々において、制御異常なグルコースだけでは有害であることを示唆している。
中国でCOVID-19が確認された7,000人以上のコホートを対象としたレトロスペクティブ研究では、制御された血糖値がCOVID-19および2型糖尿病30患者の転帰の改善と関連していることが示唆されている。血糖コントロールは、宿主の炎症反応を調節し、炎症性損傷シグナルに対する組織の感受性を制限し、感染の重症・重症期における生理機能を維持するために必要であると考えられる。
このように、COVID-19の病態生理の理解に貢献することに加えて、代謝の悪い健康状態がどのように個人をより重症化させやすいかを理解することは、患者における生物学的な代謝変数を操作することで、より好ましいものへと疾患経過を変化させるのに十分であるかもしれない。
重症または重症COVID-19生存者における長期にわたる代謝健康合併症
重症または重症のCOVID-19患者であっても生存している患者は、感染と治療の持続的影響を経験しながら回復までの長い道のりを歩むことになるかもしれない31(図1)。そのような持続的影響の一つは、生物学的代謝異常の発現であると考えられる。SARS-CoVやその他の重篤な疾患から回復した患者の研究は、この考えを支持している。
中国のある研究では、SARS-CoV感染者の感染回復後12年後に代謝異常が検出された。これらの異常には、高脂血症や心血管系の異常のほか、高インスリン血症、インスリン抵抗性、高血糖、1型糖尿病、2型糖尿病32などの糖代謝異常の徴候が含まれる。血清メタボロミクスは、これらの個体が遊離脂肪酸、ホスファチジルイノシトール、リゾホスファチジルコリン、リゾホスファチジルイノシトール(LPI)に障害があることを示した。
LPIは、インスリン放出やGタンパク質共役型受容体55(GPR55)の活性化など、グルコースの恒常性を調節することが示唆されており、SARSからの回復後の患者におけるグルコース代謝異常のメカニズムの可能性が示唆されている32。中国のSARS患者を対象とした別の研究では、2型糖尿病の既往歴のない患者の50%が感染中に2型糖尿病を発症し、3年後には5%の患者に糖尿病が残存していた33。
COVID-19患者と同様の病態を示す重症患者では、一般的に代謝異常が長期にわたって持続する34。例えば、ある研究では、急性腎損傷を経験した重篤な患者では、回復期にマッチドコントロール患者よりも新規発症糖尿病の発生率が高かった35。
重症または重症のCOVID-19の生存者における長期にわたる代謝異常の根本的な原因は、おそらく、感染と医療介入の両方の結果として生じる精神的、感情的、生理学的な要因が複雑に絡み合った、多因子性のものであろう(図3)。
精神的には、ARDSの生存者は、低酸素状態と炎症状態、換気と鎮静が原因となる長期的な認知障害を示すことがある36。エピソード記憶が乏しい人は、内部の空腹状態や満腹感に対する感受性が低下しているため、制御できない食事をする傾向があり、その結果、体重増加や高体重指数37につながる。
情緒的には、ARDS生存者では、うつ病や心的外傷後ストレス障害の割合が高く、代謝に悪影響を及ぼす傾向があり、暴飲暴食や強迫的な食事、身体活動へのモチベーションの低下が原因となっている38(図3)。重症または重症のCOVID-19生存者のリハビリテーションには、代謝の健康を最大化し、感染前のベースラインの健康状態に戻る可能性を高めるために、認知訓練と情緒的健康を促進する努力が必要である。
図3:COVID-19の代謝健康に対する長期的な効果。
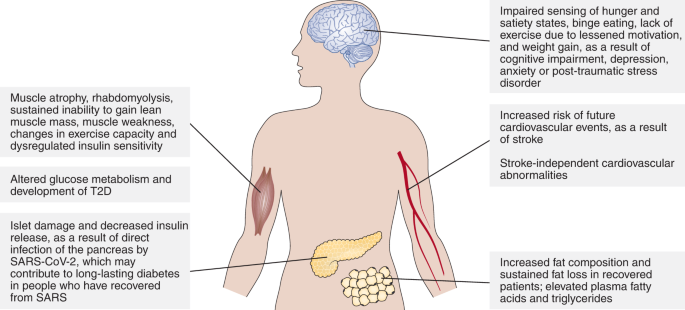
図3
COVID-19および関連する治療法によるダメージは、体内の様々なシステムにダメージを与え、精神的、感情的、生理学的な影響を長期に渡って及ぼす可能性がある;これらの影響は、回復過程を妨げる代謝異常をもたらす可能性がある。
生理学的には、膵臓、骨格筋、脂肪組織、肝臓などの内分泌系および代謝系臓器の損傷が、COVID-19感染者における新規発症メタボリックシンドロームの発症に寄与していると考えられる(図3)。
COVID-19感染者は感染中に膵臓障害を発症することが報告されており、これは循環膵酵素のレベルの上昇によって示されている。膵臓はACE2を発現しており、SARS-CoVウイルスがその受容体に結合することで膵島が損傷を受け、インスリン分泌が低下する33。
ARDSやその他の重症患者では、代謝異常や感染症に対する炎症反応、さらには栄養チューブや固定化などの医療介入により、劇的な筋肉の消耗が見られる(図3)。集中治療室に入院してから1週間以内に、これらの患者は体重の約20%を失う可能性がある39。
米国では、ほとんどの生存者は退院後1年以内に入院前の体重に戻っているが、体組成分析では、体重増加は除脂肪体重の増加はなく、脂肪組織の増加によるものであることが示されている。ARDS生存者はまた、筋繊維機能障害による筋力低下を引き起こすミオパチー39を経験している。敗血症の生存者では、長期的な筋力低下と衰弱は、筋肉の再生に必要な衛星細胞のミトコンドリアおよび代謝の障害によるものである40。
これらの変化は、重症生存者の筋力低下と運動能力の変化に伴う身体的健康の全体的な低下を説明する可能性がある41。運動能力の低下および除脂肪筋量の低下は、生存者のインスリン感受性を低下させる可能性がある。COVID-19の人では悪液質はまだ報告されていないが、重症・重症の場合はその可能性がある。損傷による骨格筋の破壊である横紋筋融解症はCOVID-19患者で報告されており(参考文献42)、筋肉の健康状態の長期的な異常に寄与している可能性が高い。
脳卒中はCOVID-19の合併症として報告されている(ref. 24)。回復期には、脳卒中患者は将来の血管イベントのリスクがある43。代謝およびエネルギーバランスの長期にわたる変化が、これらの将来のイベントの重要な推進因子であるように思われる。脳卒中から回復した患者では、体重減少と栄養不良が頻繁に観察される43。
この体重減少は従来、悪液質によるものと考えられてきたが、最近のデータでは、持続的な脂肪組織の喪失も関与している可能性が示唆されている。脳卒中モデルでは、マウスは最初に脂肪組織量が減少することを特徴とする体組成の長期的な変化を示すことがわかっているが、それはその後、より低いレベルで維持される43。
この効果は、遊離脂肪酸やトリグリセリドを含む血漿脂質のレベルの長期的な変化と関連している43。遊離脂肪酸やトリグリセリドの持続的な上昇は、SARSから回復した人やCOVID-19の可能性がある人の心血管系の異常につながる可能性がある(図3)。
COVID-19、SARS-CoV、および他の重篤な疾患の間に類似性があることを考えると、今後数年の間に、新発症のメタボリックシンドロームの発症とCOVID-19の既往歴との間に関連性が見出される可能性が高い。これらの潜在的な長期的影響は、患者が受ける医療介入の種類や、代謝性健康に影響を与える社会的変数に大きく依存するため、どのような影響が特定の地域や国に特有のものであり、どのような影響がより一般化可能なものであるかを判断することが重要となる。
したがって、代謝性健康に焦点を当てたリハビリテーションプログラムは、代謝性健康を促進し、患者をベースラインの代謝性健康状態に戻すための精神的、感情的、生理学的な戦略を用いて、患者のリハビリテーションプログラムに統合されなければならない。
COVID-19に対する防御のための代謝の活用
COVID-19の疾患発症は、宿主に対するウイルスの直接的な影響と、感染に対する宿主の反応の付随的な損傷に依存している1。COVID-19に対する宿主の反応と同様に、臨床的な疾患経過とウイルスの動態との関係を調べることは、感染の異なる段階における患者の生存を促進するために最も効果的な異なる防御戦略を概念化するのに役立つ(図4および5)。
COVID-19患者のウイルス動態を系統的に研究した結果、ウイルス負荷は症状発現から1週間目にピークを迎え、2週間目には着実に低下することが示されている44,45,46,47。疾患の重症度とウイルス負荷の間には関連性はない。
ウイルス負荷が低下すると、宿主主導の炎症亢進期が始まり、感染の重症化と臨界期が進行する。宿主免疫応答およびウイルスを破壊する抗ウイルス療法を含む抵抗性戦略は、患者が無症状のとき、またはウイルス負荷がピークに達するステージ1のときに実施されれば、COVID-19治療に最も効果的である。
ステージ2に進むにつれ、ウイルス負荷が低下していくため、患者の生理機能を維持し、生命を維持するためには、耐病性と抗ウイルス性の戦略を通じた感染に対する宿主の反応による巻き添え被害への対応がより重要になってく(図4、5)。
インフルエンザ患者の臨床データから、重症・重症患者においては、ウイルスではなく宿主を標的とすることの重要性が示されている。最適な抗ウイルス療法を受けた重症患者の約25%が依然として死亡している48。この知見は、ウイルスに対する宿主の反応がインフルエンザの転帰を決定する主要な因子であることを示唆しており、この結論はCOVID-19についても当てはまる可能性が高い。
さらに、SARSのマウス研究では、抗ウイルス免疫が低下しているにもかかわらず、宿主とウイルスとの協力を促進することで100%の生存率が得られることがわかっている49。臨床パラメータやバイオマーカーは、患者の病期を決定し、介入のための最も適切な方法を決定する上で重要となる6。
図4:COVID-19患者の病期と治療法の関係。
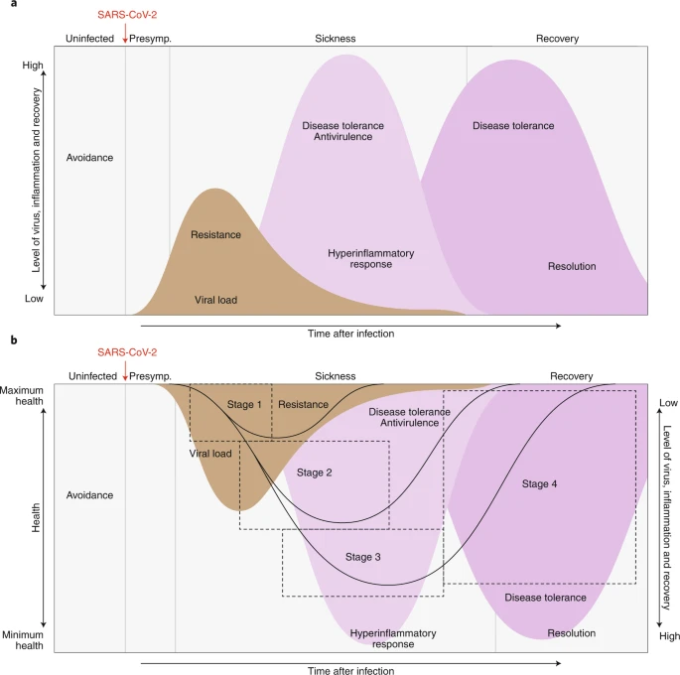
図4
SARS-CoV2感染後、ウイルスは複製し、レベルが着実に低下する44,45,46,47の後、ステージ1の間にピークレベルに達する。ウイルスレベルが低下すると、宿主の炎症反応は炎症亢進期に増加する。
最終的にこの反応は減少し、疾患の回復期が始まる。これらのパラメータと感染の臨床経過との関係を調べることで、どの防御戦略が最も効果的であるかが明らかになる。感染前は回避が最も明確な防御戦略である。感染後、患者は発熱、倦怠感、その他の軽度の症状を伴うステージ1に移行する。
ウイルスレベルは、患者が回復するか、重症または重症の感染段階に進行するかとは無関係に、患者が第1段階を抜けるにつれてピークを迎え、低下し続ける。抗ウイルス剤は、無症状の患者やステージ1の患者に最も効果的である。
ステージ2までには、宿主の炎症反応が疾患を牽引し、ステージ3まで続く。耐病性および抗ウイルス戦略は、ステージ2および3の患者に最も効果的である。患者が生存していれば、宿主の炎症反応はおさまって治癒期に入り、ステージ4では回復に向かって耐病性薬物はステージ4の患者に最も有効である。
ステージ1またはステージ2で重症度がピークに達した患者は、ステージ2またはステージ3を回避して回復期に入ることができる。
図5:COVID-19に対する防衛戦略の枠組みを示す図。
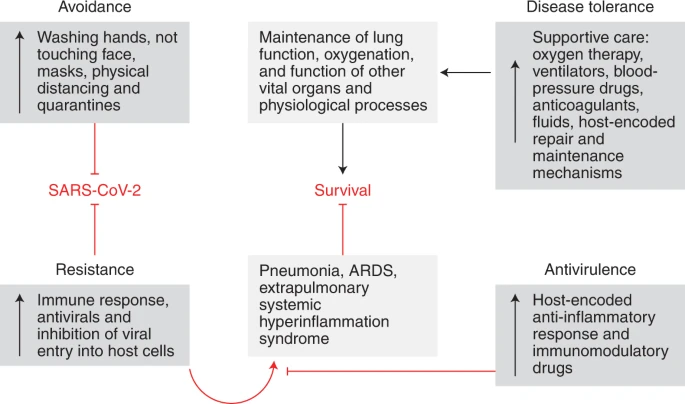
図5
病気を引き起こす感染症の能力は、感染に対する宿主の反応に大きく依存している。防御的な健康メカニズムは、感染症に挑戦している人の維持や回復力を促進するために進化した6。
これらの誘導性メカニズムは、生物が病原体に拮抗するか、または耐えられるようにすることによって動作する。病原体に拮抗することは、回避および抵抗性戦略によって媒介される。
回避メカニズムは、主に感覚的な合図によってトリガされ、病原体6に感染することから宿主を防ぐためにされている生得的および学習された行動メカニズムである。抵抗性メカニズムは、免疫系によってコード化されており、それが宿主に感染した後に病原体を破壊する1。
病原体への耐性は、疾病耐性と抗ウイルス戦略(生理的ダメージを制限し、病原体の存在下での健康を促進することで、感染によるフィットネスコストを軽減する生理学的防御)によって媒介される1。抗ウイルス機構は、宿主の生理的変化に基づく中和戦略であり、病原体の感染能力や宿主での複製能力に影響を与えることなく、感染中の病原体シグナルを制限するものである6,9,10。
耐病性メカニズムは、組織の損傷に対する感受性を最小化することで感染時の損傷を制限し、生理機能の維持と修復を促進する1,6。回避・抵抗性メカニズムは病原体を回避・根絶することで維持・回復力を促進するのに対し、耐病性・抗ウイルス性メカニズムは病原体の存在を許容することで健康を促進するのである6。
この同じ枠組みは、患者の疾患経過に影響を与えるCOVID-19に対する公衆衛生や医療介入を理解する上で重要である。COVID-19では、重症・重症期への進行は、感染に対する宿主の抵抗性防御の結果として生じる炎症反応の亢進によって引き起こされる。
抗ウイルス戦略は、これらの病原性シグナルを中和してダメージを最小化する。疾病耐性戦略は、これらのシグナルに対して生理的な防御を提供する。隔離、物理的距離、衛生的手段は回避戦略として機能する。
COVID-19治療薬の現在の候補戦略には、宿主の炎症反応を中和するための免疫調節戦略と同様に、従来の抗ウイルス剤をベースとした戦略が含まれている2。呼吸器系病原体および他の傷害に関する研究からの最近の証拠は、COVID-19患者の効果的な治療のために宿主の代謝プロセスを標的とするための強力な支持を提供してきた。
以下、患者が感染と戦い、生き残り、そして感染から回復するのを助けるために、COVID-19の各段階で、細胞、組織、器官レベルでの宿主代謝の操作がどのように標的化され得るかについて論じる。
また、宿主の代謝の健康のための防御戦略の結果についても議論する。私は主に肺環境での代謝を利用することに焦点を当てているが、COVID-19で起こりうる肺外損傷から保護するために代謝をどのように標的化することができるかについて推測している。
回避防御がCOVID-19を防ぐ
COVID-19のパンデミックに対抗するためには、自己および政府が主導する回避メカニズムが不可欠である。これには、手洗い、顔に触れないこと、病気の人から離れること、マスクやその他の個人用保護具の着用などが含まれる。COVID-19では、検疫や物理的な距離をとることを含む回避の仕組みも、ナイーブな人の感染を防ぐための公衆衛生上の重要な対策であり、感染量を減らし、感染の発生をより多くの期間に分散させ、医療システムに負担がかからないようにすることを目的とした「フラット化」の動きの中で、重要な役割を果たしてきた(図4、5)。
回避防御は代謝プロセスによって駆動されない可能性が高いが、回避メカニズムの中には、個人の代謝の健康に大きな犠牲を払うものもある(図6)。例えば、物理的な距離を置くことで、個体の生物学的代謝にかなりの付加的なダメージを与えることになる。
動物やヒトの研究では、社会的隔離は体重増加や肥満、脂肪率の増加、除脂肪体重やインスリン抵抗性の低下と関連しており、社会的隔離されたヒトでは新たに2型糖尿病50,51,52,53と診断される可能性も高い(図6)。
図6:COVID-19に対する防御のための宿主代謝の標的化
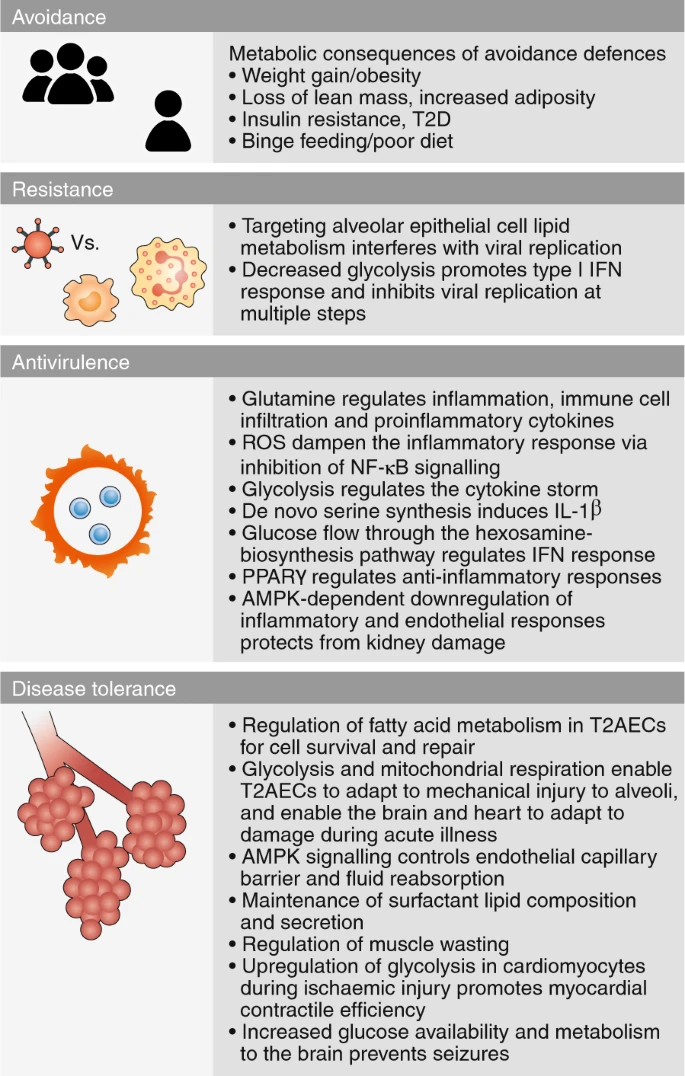
図6 個人はCOVID-19に対する4つの防御戦略を用いることができる。
回避メカニズムは、個人が感染を獲得するのを防ぐ。これらのメカニズムは代謝プロセスによって駆動されない可能性が高いが、いくつかの回避メカニズムを使用することによる付随的な損傷は、代謝の健康に有害な影響を与える可能性がある。
抵抗性戦略は、感染を破壊することによって宿主を保護する。宿主代謝の様々な側面は、宿主細胞におけるウイルス複製を阻害し、病原体を破壊するために宿主の免疫応答を高めるために、潜在的に標的化され得る。
宿主の代謝を標的とすることは、感染中に誘導される病原性シグナルから保護するための抗ウイルス防御と、損傷シグナルに対する組織の感受性を制限し、損傷を経験する可能性があるにもかかわらず組織が機能することを可能にし、また損傷から回復することを可能にする疾患耐性防御の両方を促進するための実行可能な戦略である。
T2AECs、II型肺胞上皮細胞、活性酸素、活性酸素種。
物理的距離のための代謝的影響の発生につながる基礎的なメカニズムは、生理学的、精神的、行動的要因が関与する複雑なものである。外に出られないことや抑うつ状態によって引き起こされる活動的なライフスタイルから、より座りっぱなしのライフスタイルへの移行は、生体の代謝に悪影響を及ぼす52,53。急性の座り仕事のライフスタイルは筋肉量の減少を引き起こし、ヒトではグルコースレベルの上昇、インスリン抵抗性、脂肪率の上昇を引き起こす52,53。
社会的孤立は、健康的な食事を摂取する能力を制限する可能性がある。この制限は、家を離れるとウイルス感染症に感染してしまうのではないかという恐怖の感情状態によって引き起こされることがある。実験動物やヒトでの社会的孤立は、不安、恐怖、または抑うつによって引き起こされた快適な摂食と同様に、過食と暴飲暴食の行動を誘発する50,52,53。
この反応は、セロトニン、神経ペプチドY、α-メラノサイト刺激ホルモン、コカインおよびアンフェタミン調節型トランスクリプトペプチドを含む摂食および満腹感に関与する様々な神経伝達物質の誘導によるものと考えられる;これらの経路は、社会的孤立が誘発する過食症の根底にある分子機構を構成している可能性がある50。実際、社会的隔離中にコカインおよびアンフェタミン調節転写物(CART)を集中的に投与することで、ラットを過嚥下から保護することがわかっており、CARTを遮断することで、再社会化の摂食行動への影響を防ぐことができる50。
最後に、社会的孤立によって誘発されるストレス応答は、不健康な代謝応答をもたらす行動的および生理学的変化を引き起こす。例えば、コルチゾールは、感情や暴飲暴食の動機を強めたり、インスリン抵抗性や筋萎縮を誘発したり、脂質、グルコース、アミノ酸代謝を直接変化させたりすることがある50,54。
したがって、COVID-19のパンデミックが終了した後、私たちの回避戦術は、より多くの人々がメタボリックシンドロームを発症する原因となり、その結果、すでに存在するメタボリック疾患のパンデミックを悪化させることになると提案する。さらに重要な懸念は、既存の代謝性疾患を持つCOVID-19の人々は、重症化や臨床疾患を発症しやすいため11、もしCOVID-19パンデミックの第二波が発生した場合、パンデミックの第一波での私たちの回避防御のために、より多くの患者がより重症化してしまうのではないかということである。したがって、これらの必要な回避行動を実践している人は、代謝の健康を促進するために、運動と健康的な食事のルーチンを維持しなければならない。
COVID-19に感染した人が実践した回避防御は、患者の疾患経過にも影響を及ぼす可能性がある。社会的隔離および隔離は、感染中の代謝健康状態の違いに寄与する。社会的隔離によるこれらの代謝の変化が疾患経過に影響を与えるかどうかは不明であるが、宿主の代謝が感染の結果を決定することは十分に確立されており6,9,10、社会的相互作用が感染に対する防御に重要であることが知られている55。
社会的孤立が感染防御に及ぼす影響が代謝の摂動によるものかどうかは、まだ明らかにされていない。したがって、隔離や物理的な距離を置くなどの回避行動と感染防御との間には、潜在的な難問が存在すると考えられる。感染を封じ込めながら、患者の社会的交流を促進することを考えなければならない。また、公衆衛生や医療介入がCOVID-19の感染者に及ぼす代謝的影響を理解しなければならない。
抵抗勢力はCOVID-19と戦う
回避機構は、最も成功した例であっても100%効果があるわけではないので、他の防御戦略を実施しなければならない。抵抗性戦略は、ウイルスを破壊することで宿主を保護し、COVID-19の経過の初期、すなわちウイルスレベルがピークに達するときに有効である(図4および5)。
この初期段階でSARS-CoV-2に対する抵抗性を促進するためには、以下の3つの戦略を用いることができる。
(1)宿主細胞へのウイルスの侵入を防ぐ、
(2)ウイルスがハイジャックした感染上皮細胞を標的にして複製を防ぐ、
(3)宿主の免疫反応を標的にしてウイルスを破壊する、
という3つの戦略である。現在、COVID-19の治療に有効な抗ウイルス剤は存在せず、そのような治療法の開発は、ウイルスに対する治療法の発見対応の中で優先的に行われてきた。現在試験されている潜在的な抗ウイルスCOVID-19治療薬は、ウイルス感染症と闘うための従来の論理を含んでいる56。しかしながら、証拠は、宿主細胞レベルおよび免疫細胞レベルの両方で宿主代謝を標的とすることが、COVID-19を治療するための有効な抗ウイルス戦略であり得ることを示唆している。
RNAウイルスに関する最近の研究は、感染症を治療するための抗ウイルス戦略として宿主細胞代謝を標的とする可能性を実証している。CoVの発病は、ウイルスのスパイクタンパク質と宿主細胞上のACE2との間の相互作用によって駆動されるプロセスにおいて、ウイルスRNAゲノムの宿主細胞への侵入を伴い、次いで、スパイクタンパク質のタンパク質分解的切断およびエンドサイトーシスによって媒介されるウイルスの宿主細胞への侵入が行われる。
RNAゲノムは宿主細胞に寄託され翻訳され、翻訳・複製に必要な複製・転写複合体が形成される。その後、ウイルスはパッケージングされ、組み立てられて放出され、その後、新しい細胞に感染する57。ヒトCoVに感染した上皮細胞では、リピドミクス解析により、飽和および不飽和脂肪酸とリン脂質の蓄積が示されており、感染細胞の脂質プロファイルの変化がウイルスの複製に重要である可能性が示唆されている58,59。
この考えと一致して、試験管内試験(in vitro)で上皮細胞の化合物AM580との処理を介して転写因子SREBPのタンパク質分解処理の阻害、および生体内試験(in vivo)で感染したマウスでは、細胞内脂質液滴形成、二重膜-ベシクル形成とウイルスタンパク質のパルミトイル化59,60を減少させることを含む複数のステップに作用することにより、ウイルスの複製を阻害することが判明している。さらに、AM580はRNAウイルスHIN1の表面糖タンパク質ヘマグルチニンのパルミトイル化を減少させ、それによってインフルエンザの複製を阻害する59,60。この知見は、感染した上皮宿主細胞の脂質代謝を標的とすることが、COVID-19治療のための抗ウイルス戦略の可能性を示唆している(図6)。
呼吸器ウイルス感染症と診断された小児では、肺におけるグルコースの取り込みが亢進している61。この知見と一致し、小児ドナーのインフルエンザ感染ヒト気管支上皮細胞を解析したところ、ウイルスの複製に必要なc-Myc、解糖、グルタミニリシスが増加していることが示唆されている。
PI3K-mTORシグナル伝達経路の阻害剤であるBEZ235を投与すると、c-Myc誘導の抑制とPI3K-mTOR経路のホメオスタシス61の回復により、ウイルス力価と感染に関連した病態が減少する。Caco-2細胞では、SARS-CoV-2への感染は、炭素代謝をアップレギュレートすることがわかっている。
解糖阻害剤2-デオキシ-D-グルコース(2DG)による治療は、Caco-2細胞におけるSARS-CoV-2の複製を防止し、したがって、宿主のグルコース代謝を標的とすることは、COVID-19を治療するための実行可能な抗ウイルス戦略である可能性を示唆している(参考文献62および図6)。
SARSおよびMERSでは、ウイルス負荷に関して遅延した抗ウイルス反応がある49。同様に、SARS-CoV-2では、ウイルス負荷に関して抗ウイルス反応の低下が観察される63。宿主の抗ウイルス応答の重要な構成要素であるI型インターフェロン(IFN)の誘導は、自然免疫系による病原体関連分子パターンの認識に応答して誘発される。
BALB/cマウスでは、SARS-CoV感染は、遅延したI型IFN応答を伴って、感染後16時間までにほぼ最大のウイルス負荷に達する。感染後6時間後にI型IFN IFN-βを経鼻投与すると抵抗性が促進され、感染初期のウイルス負荷が低下し、マウスの生存率が上昇する49。この知見は、ウイルス負荷を早期に制御することが疾患の進行を防ぐために必要であり、感染経過の早期にIFN-I応答を促進することが、COVID-19患者において有効な抗ウイルスベースの戦略である可能性を示唆している(図6)。
最近の報告では、RNAウイルスに対する抗ウイルス応答を代謝的に標的化してIFN-I応答を促進することができることが示されている64。レチノイン酸誘導性遺伝子I様受容体(RLR)ファミリーは、細胞質ウイルスRNAを検出し、活性化後、インターフェロン調節転写因子(IRF3)およびIFN-Iの活性化に必要なミトコンドリア抗ウイルスシグナル伝達タンパク質(MAVS)の誘導を導く。
MAVSはミトコンドリアに局在し、ヘキソキナーゼ-2 (HK-2)と相互作用する。RLRの活性化は、この相互作用を無効にし、したがって、HK-2の下流の解糖中間体のレベルを低下させる。低グルコース条件下で、またはヘキソキナーゼ阻害剤を用いて細胞を増殖させると、タイプIのIFN-I応答が増強されるが、解糖によって生成される乳酸はMAVSに直接結合することでIFN-I応答を抑制する。
マウスでは、絶食誘発性低血糖はIFN-Iを増加させる。マウスを乳酸脱水素酵素A阻害剤で処置すると、より強固なIFN-I応答が得られ、RNAウイルスに対するより大きな抵抗性が得られる64。
上記の研究は、宿主細胞内の免疫応答またはウイルス複製を標的とすることにより抵抗性防御を促進するために宿主の代謝を操作することが、COVID-19患者に対する有効な治療戦略であり得ることを示すいくつかの実証を提供している。
いくつかの優れたレビューでは、免疫代謝と抗ウイルス防御について記述されており、抵抗性防御を促進するために宿主の代謝を潜在的に操作する追加の方法が示唆されている65,66,67。これらの治療法は、感染症の重症度を最小限に抑えるために感染の初期段階で実施されれば、COVID-19に対して有効である可能性がある。
生理的防御は生存と回復を促進する
臨床症状が軽い無症状のステージ1の患者には抗ウイルス剤が有効であるが、ステージ2、3に入ってからは、患者のウイルスに対する耐性を高める必要がある(図4、5)。
このような段階に入ると、感染症はウイルスに起因する疾患から宿主の反応に起因する疾患へと変化する。ステージ2の肺炎による炎症は、肺胞マクロファージからのサイトカインの放出と好中球の肺環境へのリクルートによって特徴づけられる炎症亢進期に至る。これらの免疫細胞は血小板活性化因子およびプロテアーゼを放出し、肺胞上皮-毛細血管内皮バリアに作用して肺胞環境を損傷する。
このバリアの破壊は、肺胞内に体液やがれきの蓄積、界面活性剤の分泌低下、肺胞の崩壊を引き起こし、その結果、ガス交換が低下し、低酸素症、呼吸困難、錯乱、チアノーゼ、タキプノを引き起こす。後の段階では、修復反応の調節障害のために、肺の線維化が起こる可能性がある。全身性の炎症と低酸素は、脳、心臓、腎臓などの重要な臓器に肺外病理を引き起こする。
生理的防御は、患者が(1)抗ウイルスに基づいた戦略で損傷を引き起こす病原性反応をブロックし、(2)損傷に組織、臓器や生理的感受性を制限し、耐病戦略1,6で損傷に直面して生理機能を維持することにより、感染に耐えられるようにすることができる(図5)。
病態を引き起こす炎症亢進期における宿主の反応は、よく理解されている。この理解は、ARDSや抗IL-6療法のような肺外疾患を引き起こすサイトカインストームを遮断することで抗ウイルスメカニズムとして作用する治療法の候補を追求することにつながっている68。
疾患耐性のメカニズムについてはあまり知られておらず、そのため治療は、酸素需要を満たすために肺機能を促進することで疾患耐性を改善するための支持療法に限定されてきた。しかし、他の肺の感染症や肺の損傷の条件だけでなく、正常な肺の生理学の知識に基づいて、予測は、COVID-19への疾患耐性が誘導されるかもしれない方法として行うことができる。
両方のケースでは、最近の研究では、疾患耐性と抗ウイルス防御が主に代謝プロセス7,8,9,10によって駆動されることを実証している。以下では、宿主の代謝を標的にして、宿主の生理的防御を促進する方法について、主に抗ウイルス性および耐病性の方法に焦点を当てて、損傷に対する感受性を制限し、肺環境の修復を促進する方法について述べる。また、COVID-19患者の肺外損傷に対する防御のために代謝をどのように活用できるかについても述べている。
病原性シグナルをブロックする抗ウイルス代謝戦略
代謝プログラミングは炎症反応を調節するために不可欠であり、宿主細胞の代謝を標的とすることは、重症または重症のCOVID-19患者における抗ウイルス性を促進する明確な方法である。
リポ多糖(LPS)誘発性肺障害のマウスモデルでは、グルタミンアナログ6-ジアゾ-5-オキソ-L-ノルロイシン(DON)によるグルタミン代謝の阻害は、好中球浸潤の減少、および間質性マクロファージおよび炎症性サイトカインおよびケモカインの低レベルによって特徴づけられるように、肺の炎症を減少させる。
これらの効果は、成長因子アンフィレグリンの早期発現と肺損傷からのより速い回復と関連している69。この知見と一致して、LPS誘発性肺損傷を有するマウスでは、グルタミン処理は、肺環境へのサイトカイン産生および好中球のリクルートを悪化させる。
しかし、様々な肺障害誘導方法およびグルタミン投与経路を有する他のモデルでは、グルタミンはARDSに対して保護的であることが判明している。疾患発症に対する効果の違いは、グルタミンの投与経路、投与時期、ARDS70を誘発する特定の傷害の違いによって説明されると考えられる(図6)。
ミトコンドリアを標的とすることは、ARDSを生き延びるための重要な抗ウイルスメカニズムになる可能性がある。活性酸素は転写因子NF-κBの活性化と炎症反応を制御する。LPS に曝露した好中球をミトコンドリアの複合体 I の阻害剤であるロテノンまたはメトホルミンで処理すると、細胞内のスーパーオキサイドと過酸化水素が増加する。
これらの効果は、LPS誘導NF-κB活性化およびプロ炎症性サイトカイン産生の阻害と関連している。LPS誘発性肺傷害のマウスモデルにおいて、ロテノンまたはメトホルミンによる治療は、肺における複合体Iの阻害および好中球浸潤、原炎症性サイトカインおよび肺水腫の減少を含む肺傷害に対する保護をもたらし、したがって、好中球におけるミトコンドリア機能を標的とすることは、COVID-19の間の抗ウイルス防御を促進する可能性があることを示唆している。
メトホルミンはオートファジーを誘導し、COVはオートファジーを複製に利用する可能性がある71; その結果、COVID-19患者におけるメトホルミン治療のタイミングは、重症で重症の場合には難しいかもしれない。
SARS患者に見られるサイトカインストームは、IFN-I反応の遅延によって引き起こされることが示唆されている72。COVID-19の患者では、頑健な食欲不振反応が報告されている(参考文献73)。絶食誘発性低血糖は細胞の抗ウイルス応答に影響を与え、ウイルス感染中にMAVSおよびIFN-I応答を活性化するので、これらの後期段階でIFN-Iを抑制するための潜在的な細胞代謝標的は、HK-2の活性化、例えば摂食またはグルコースの投与、または乳酸塩による処置に関与しているかもしれない。
実際、インフルエンザ感染のマウスモデルでは、食欲不振反応を覆すか、またはグルコースの経口投与で感染からマウスを保護するのに十分であることが判明している7。肺における解糖とIFN-Iの関係は、抗ウイルス防御の促進の複雑さを示している。
解糖を阻害することは、理論的にはCOVID-19の初期段階ではIFN-I反応を誘導し、抵抗性防御を促進する可能性があるため有益であると考えられるが、疾患の宿主反応段階の後半では、サイトカインストームを抑制するための抗ウイルス機構において、解糖を促進することによってIFN-Iがダウンレギュレートされるはずである(図6)。
異なる前炎症性サイトカインの誘導に対する解糖の差動効果は、COVID-19の抗ウイルス性標的としての解糖の候補性をさらに複雑にするであろう。IL-1βは、COVID-19を有する人において上昇するプロ炎症性サイトカインである(参考文献74)。
解糖阻害剤2DGでのマウスの処置は、LPS処置中のIL-1βの成熟を阻害することが見出されている75。さらに、LPS処理マウスを2DGで処理すると、LPS誘発死から保護される7。
解糖は、de novoセリン合成の前駆体である3-ホスホグリセリン酸の生成を介して、生体内でのIL-1βの成熟をサポートしている76。LPSを負荷したマウスをホスホグリセリン酸脱水素酵素(de novoセリン合成の基質)の低分子インヒビターであるPH-739-005Nで処理すると、LPS誘発性の致死およびIL-1βの成熟からマウスを保護するのに十分である(参考文献76および図6)。
解糖に加えて、グルコースはヘキソサミン生合成経路を流れる。この経路の最終生成物は、ウリジン二リン酸N-アセチルグルコサミン(UDP-GlcNac)である。O-linked β-N-アセチルグルコサミン転移酵素(OGT)は、標的タンパク質上のセリン残基またはスレオニン残基へのUDP-GlcNAcの転移を媒介する。インフルエンザAウイルス感染時には、OGTが誘導され、OGTはインターフェロン調節因子5(IRF5)と結合し、IRF5はその後O-GlcNacylatedされる。
この過程は、IRF5のユビキチン化とその後のサイトカイン産生に必要であり、インフルエンザ感染によるサイトカインストームを引き起こする。マウスの遺伝子解析により、OGTがIRF5を介してインフルエンザ誘発性サイトカインストームを媒介していることが確認されている77。したがって、ヘキソサミン生合成経路を阻害することは、SARS-CoV-2を含む呼吸器感染症の抗ウイルス戦略として有効である可能性がある(図6)。
ペルオキシソーム増殖因子活性化受容体γ(PPARγ)は、核内受容体であり、M2マクロファージの分極や炎症性サイトカインの過剰産生の抑制など、代謝や炎症の様々な側面を制御している。マウスのインフルエンザA感染時には、PPARγはIFN-I依存性の方法で肺胞マクロファージでダウンレギュレートされる78。
マクロファージおよび他のLyz2陽性細胞におけるPPARγを欠損したマウスは、インフルエンザA感染時に野生型マウスよりも大きな炎症反応を示し、死亡率も増加した78。これらの知見と一致して、PPARγの予防的または治療的アゴニストで治療されたマウスは、インフルエンザ感染時の罹患率と死亡率の減少を示した79。
興味深いことに、肥満ではPPARγの制御異常が認められ、代謝性疾患を持つ人のSARS-CoV-2に対する感受性の増加は、PPARγ活性の欠陥を介した炎症反応の制御異常によるものである可能性が示唆され、これらの患者におけるPPARγを標的とすることが治療法の選択肢となる可能性がある(図6)。
上記の研究は、宿主細胞の代謝を操作することが、COVID-19に対する抗ウイルス防御を促進するための有効な戦略である可能性があることのいくつかの例を提供する。しかしながら、抗ウイルス戦略は抵抗性戦略に直結しているため、抗ウイルス戦略は固有の複雑性を有し、潜在的に抵抗性防御を損なう可能性があり、より重篤な疾患を誘発する可能性がある。
免疫細胞における免疫代謝と代謝リプログラミングに関する最近のレビューでは、抗ウイルス目的で炎症反応をダウンレギュレートするために代謝を標的とする方法の追加例が示されている65,66,67(図6)。
疾患耐性はダメージに対する感受性を制限する
抗ウイルス療法に基づくアプローチには、2つの潜在的な懸念がある。第一に、これらのアプローチは免疫反応を阻害するため、ウイルスや二次的な細菌感染に対する患者の感受性を高める可能性がある2,80。
第二に、考慮しなければならない感染の重要な時間的側面がある。効果的であるためには、抗ウイルス戦略はダメージを受ける前の早期に実施されなければならない。したがって、耐病性の促進に焦点を当てることは、組織の損傷に対する感受性を制限し、この損傷の存在下で生理機能を維持し、回復反応を開始するために合理的であるように思われる2。タイミングは確かに重要であり、組み合わせ戦略はCOVID-19患者において最も効果的であると思われる。
COVID-19の間の炎症性損傷に対する感受性を潜在的に制限する一つの方法は、病原性シグナルの存在下で適応し、生存することによって上皮細胞の感受性を制限することである6。 急性肺エンドトキシン血症誘発性損傷のマウスモデルでは、肺胞上皮細胞は、脂肪酸酸化の障害だけでなく、Ppargc1aとCpt1aを含むミトコンドリアの生合成と脂肪酸酸化に関与する遺伝子の発現低下を示す。
PGC-1Aをコードする遺伝子であるPpargc1aを肺胞上皮細胞から欠失させると、マウスはLPSによる鼻腔内治療によって引き起こされる肺損傷に対してより感受性が高くなり、上皮細胞におけるカスパーゼ-3切断の増加と関連した効果が得られることから、急性肺損傷に対するこれらの細胞の生存には、肺胞上皮細胞における脂肪酸酸化の欠如が必要であることが示唆されている81。
PGC-1Aはミトコンドリア脂肪酸酸化酵素をコードする核内遺伝子の転写制御においてPPARαと協働し、脂肪酸酸化を誘導する82。PPARαアゴニストをマウスに投与することで、LPSによる肺障害を予防することが可能であり、その結果、PGC-1Aは肺胞上皮細胞の脂肪酸酸化を促進することで、急性肺障害に対する耐病性を促進し、その結果、細胞死を防ぐことができる可能性がある81。
したがって、肺胞上皮細胞における脂肪酸酸化を促進することは、上皮バリアを維持することにより、COVID-19患者の生存率を高めるために有用である可能性がある。同様に、肺上皮の修復および肺上皮機能の回復は、ARDSによる肺損傷の修復に必要である。この過程では、II型肺胞上皮細胞が増殖し、I型肺胞上皮細胞へと分化する。脂肪酸の酸化を介してII型上皮細胞の生存を促進することは、I型細胞への分化が可能な細胞数を維持することによって修復過程に必要であり、したがって、COVID-19の回復期に重要であると考えられる(図6)。
PGC-1Aは、ミトコンドリア生合成、酸化的リン酸化、グルコース生成およびグリコーゲノゲン分解を含む細胞代謝における多くの付加的な機能を実行する;これらの機能は、急性肺損傷における耐病性を促進するために重要であるかもしれない。これらの機能に関連したグルコース異化作用は、PGC-1Aの保護効果に寄与している可能性がある。
肺の機械的延伸損傷のマウスモデルでは、肺上皮細胞の延伸はコハク酸脱水素酵素の阻害につながり、コハク酸のレベルの増加につながることがわかっている83。コハク酸は肺胞上皮細胞の低酸素誘導因子(HIF)1αを非酸素的に活性化し83、その結果、細胞の解糖能、トリカルボン酸フラックスとミトコンドリア呼吸を増加させることにより、これらの上皮細胞の機械的ストレスへの適応を促進し、その結果、肺胞上皮細胞によって生成されるATPの量が増加する。
HIF1αの薬理学的安定化剤であるジメチルオキサログリシンをマウスに投与すると、肺の炎症や肺水腫から保護され、ガス交換が改善され、生存率が向上する83。これらのデータは、ARDSステージ中のCOVID-19の肺胞上皮細胞における解糖を標的とすることが、感染時の耐病性を促進するための有用な戦略である可能性を示唆している。さらに、この戦略は、肺損傷の一因となり得る機械的人工呼吸器の使用によって引き起こされる付随的な肺損傷から保護するのに有用である可能性がある。
これらのデータは、COVID-19のARDS期における耐病性には解糖が有益である可能性を示唆しているが、前述したように、COVID-19患者における解糖を標的とすることは、抵抗性、抗ウイルス性および耐病性を含む宿主防御の複数の側面に解糖が及ぼすと思われる差異のある効果によって複雑になるであろう。したがって、COVID-19治療のためにこのプロセスをドラッギングするための重要な時間的および細胞標的の考察がある(図6)。
肺胞上皮バリアを維持することに加えて、毛細血管内皮バリアの完全性を維持することも、肺血管透過性を防止するために不可欠である。ARDSにおける毛細血管内皮バリアの機能不全は、肺胞間隙や肺胞腔内に体液や高分子が蓄積し、肺水腫を引き起こす。キナーゼAMPKは、正常な内皮細胞機能と内皮バリアの完全性の維持に重要な調節因子である。
AMPKはまた、細胞代謝の重要な調節因子でもある。LPS誘発急性肺損傷のマウスモデルでは、AMPK活性は肺で阻害されている。AMPKを欠損したAMPKαノックアウトマウスは、野生型マウスよりもLPS誘発性急性肺損傷に感受性が高く、バリア機能障害が増加し、それにより炎症、浮腫およびうっ血が生じる。AMPKを活性化する薬剤AICARでマウスを治療すると、バリアの完全性が増加し、急性肺損傷に応答して肺血管透過性と全体的な罹患率が低下する84。
このように、高炎症状態に対応してバリアの完全性を維持することによる耐病性の改善を介してCOVID-19患者の生存を促進するためには、肺胞上皮細胞に加えて肺内皮細胞での代謝を標的とすることが重要な戦略であると考えられる(図6)。
肺サーファクタントは、90%の脂質と10%のタンパク質からなるリポタンパク質複合体で、上皮細胞から分泌され、肺胞表面をコーティングしている。空気と体液の表面張力を低下させることで換気を促進し、ガス交換を促進して肺胞の崩壊を防ぐ。ARDSでは肺胞表面張力が上昇し、崩壊が起こり、その後のガス交換不良や低酸素症の一因となることがある。
この反応は、肺環境に分泌される界面活性剤の量の変化、およびリン脂質、脂肪酸、中性脂質、界面活性剤-アポ蛋白質組成の変化によるものである85。ARDS患者では、気管支肺胞洗浄液のリン脂質組成のプロファイリングにより、ホスファチジルグリセロールレベルの低下とマイナー成分86の量の代償的な増加を伴う組成の変化が示されている。界面活性剤の中で最も豊富な脂肪酸であるパルミチン酸のレベルも、ARDSを持つ人では減少している86。
急性肺損傷の動物モデルでの作業は、界面活性剤代謝の変化がARDS87の間にこれらの変化に責任があるかもしれないことを示唆している。これらの知見は、適切な組成と分泌を維持するために肺上皮細胞における界面活性剤の代謝を操作することが、肺胞の完全性と構造を維持することによってCOVID-19の疾患耐性を促進するために有益である可能性を示唆している(図6)。
界面活性剤の生理学はまた、生物レベルで代謝的に調節されているように見える。レプチンを欠損したマウスでは、肺胞上皮細胞による界面活性剤産生の重要な調節因子である副甲状腺ホルモン関連タンパク質の肺の発現が低下している88。しかし、レプチンがARDSの文脈で保護的であるかどうかは疑問である。
ブレオマイシン誘発性線維症のマウスモデルでは、レプチン受容体欠損マウス(db/db)は肺線維症の発症から保護されている。この保護は、ARDS線維化の病因に寄与するサイトカインであるTGF-β1に対する転写反応を阻害するPPARγのレベルの上昇と相関している89。
興味深いことに、健康的な体重のコントロール動物と比較して、肥満動物モデルでは、肺脂質沈着、界面活性剤レベルおよび組成が変化している90。さらに、肥満ラットは、肺のサイズの増加を示し、このように呼吸機能の変化と一緒に、肺の表面積に対する界面活性剤の欠乏を引き起こす90。
これらの知見は、レプチンがARDSの生存期には保護的であるが、ARDSの回復期には不適応であることを示唆している。さらに、界面活性剤の生理的変化は、メタボリックシンドロームやCOVID-19に関連したリスクの増加に寄与している可能性がある(図6)。
肺炎とARDSの両方で肺胞液の蓄積が起こり、ARDSに進行したCOVID-19患者では肺水腫が発生し、それが低酸素を助長している。II型肺胞上皮細胞は、体液の再吸収を媒介することにより、水腫の解消に実質的に寄与する。
このプロセスは、主に先端ナトリウムチャネルと基底側のNa/K-ATPaseによって媒介されるプロセスにおいて、肺胞上皮全体でのNa+の活発な輸送に依存している。細胞全体でNa+とK+の輸送は、イオン勾配を維持し、細胞のATPの〜40%を消費する。ARDSや肺炎時の肺胞内の低酸素環境は、細胞膜におけるこれらのトランスポーターの量を減少させ、体液の再吸収を阻害する。
低酸素環境はミトコンドリアの反応性酸素種が介在するCRACチャネルの活性化を引き起こし、それによりCa2+/CaMKKb依存性AMPKの活性化とNa/K-ATPaseトランスポーターのエンドサイトーシスを引き起こし、肺胞液のクリアランスを阻害する91。
したがって、上皮細胞の形質膜におけるNa/K-ATPaseトランスポーターのレベルを維持することは、体液の再吸収を促進するための重要な耐病機構であると考えられる。この維持は、HIFを介して達成され得る。Na/K-ATPaseのエンドサイトーシスはPKCζによって媒介される。
低酸素状態では、HIFはユビキチンリガーゼHOIL-1Lをアップレギュレートし、これがキナーゼPKCζを標的にして分解される。その結果、細胞膜におけるNa/K-ATPaseトランスポーターの量が安定化され、低酸素誘発性肺障害からの保護が得られる92(図6)。
ARDSの炎症期を乗り切った患者は、本疾患の修復期に入る。肺組織の修復は肺機能を回復させるために不可欠であり、耐病性メカニズムによって媒介される。しかしながら、このプロセスの調節障害は肺線維症を引き起こす可能性がある。
この段階はしばしば後期線維化期と呼ばれる。COVID-19の患者の約20~30%は、感染の重症期または重症期を生き抜いた後に肺機能が低下しており、肺線維症93を経験している可能性が示唆されている。
肺線維症の治療法はないが、早期に発見されれば、抗炎症剤や抗増殖因子を含む治療法が線維症の発症を減少させるのに有効であるかもしれない。宿主の代謝を標的とする薬剤もまた、肺線維症を予防する可能性がある。
肺胞Ⅱ型上皮細胞におけるミトコンドリア機能不全および脂質代謝の変化は、肺線維症の病因と関連している。ブレオマイシン誘発性肺線維症のマウスモデルでは、脂肪酸の伸長を触媒する律速酵素である長鎖脂肪酸ファミリーメンバー6(Elovl6)の伸長レベルが線維化肺で低下している。
ElovI6の欠乏は、肺胞壁肥厚94に関連する肺線維症の感受性を増加させる。線維化性肺では、ミトコンドリア脂質修復酵素リゾカルジオリピン・アシルトランスフェラーゼの発現が低下する。この酵素の過剰発現は肺線維化95から保護する。線維化性肺では、上皮細胞は、小胞体ストレスの原因となる、誤って折り畳まれたタンパク質の大きな凝集体を蓄積する。
同様に、脂肪酸の脱飽和に関与する酵素であるステアロイル-CoAデサチュラーゼを阻害すると、マウスにおいて小胞体ストレスと肺線維化を引き起こす96ことから、上皮細胞の代謝が線維化性肺における小胞体ストレスを制御している可能性が示唆されている。Chuらは、線維化患者の肺のパルミチン酸レベルがコントロール個体よりも高いことを報告している。
パルミチン酸を豊富に含むウェスタンタイプの食事を与えられたマウスでは、マウスはブレオマイシン誘発性肺損傷に対してより重篤な反応を示し、また、小胞体ストレスマーカーの発現の上昇と肺線維化を示す。試験管内試験(in vitro)でのパルミチン酸は、小胞体ストレスを引き起こすことにより、肺上皮細胞に直接毒性を示す。
CD36脂質受容体の削除は、これらの毒性効果を廃止し、したがって、肺上皮細胞による脂質の感知が小胞体ストレスを誘発することができることを実証し、その結果、肺損傷時に肺の線維化反応を促進する可能性がある。しかし、CD36脂質受容体の欠失は、これらの毒性効果を廃止する97。したがって、COVID-19患者の回復を促進し、感染前の元の健康状態に戻る可能性を高めるために、肺代謝を標的とすることは、追加的な治療法の選択肢となる可能性がある(図6)。
COVID-19患者の肺生理を標的とした治療は、重症患者や重症患者の治療には不可欠であり、耐病性戦略が最も有用であると考えられるが、抗ウイルス戦略は狭い治療領域ではある程度の効果が得られる可能性がある。
耐病性戦略の有効性は、重症または重症の患者に限定されるものではない。例えば、肺胞上皮細胞を標的とし、炎症性損傷に対する感受性を制限する薬剤を早期に投与することで、肺への損傷を制限することができる。これは、感染症防御および治療の一般的な側面では十分に評価されていないものであり、代謝標的化戦略に最も適合した戦略である可能性が高い。
COVID-19患者における肺外イベント
ここでは、COVID-19の高炎症期の肺への影響に焦点を当てて議論してきたが、心臓や心血管系の他の構成要素、骨格筋、脳、腎臓への損傷、消化管への影響など、肺外への影響も患者に現れる(図2)。これらの肺外事象の原因は明らかにされていないが、これらの事象には多くの非排他的な説明が存在する。
第一に、これらの組織の多くはACE2を発現しており、したがって、これらの患者における臓器損傷は、SARS-CoV-2がこれらの組織に感染した直接的な結果である可能性がある。
第二に、損傷は宿主の炎症反応の直接的な影響の結果であり得る。第三に、損傷は、臓器の機能不全およびその結果として生じる他の臓器の生理学的機能の低下の結果であり得る。例えば、呼吸不全は低酸素を引き起こし、これは他の生理学的システムを損傷し得る。
同様に、心血管系の損傷は、他のシステムへの酸素化血液の送達を制限し得る。急性腎障害は、他のシステムに毒性のある代謝物の血液中への蓄積を引き起こす可能性がある。原因にかかわらず、これらの合併症を呈する患者に対する最も論理的な防御戦略は、
- 損傷を制限し、
- 損傷を経験しているにもかかわらず、臓器がその生理学的機能を実行できるようにし、
- 臓器の修復を促進するための耐病性である6。
代謝を標的とすることは、これらの目標を媒介するための実行可能なオプションである6。
COVID-19では、武漢で行われた研究では、患者の20~45%が感染による心臓障害を経験していることが示されている98。同様の割合の患者が感染中に血液凝固異常を起こすことが報告されている99。心臓の損傷は、酸素を含んだ血液を全身に供給する心臓の能力を低下させる可能性がある。この影響は、血液凝固と相まって、臓器不全につながる肺外低酸素症に寄与する可能性がある。
心臓および心臓血管系はACE2を発現しているため、この作用は、ウイルスによる直接的な感染、または感染中の宿主応答の付随的な損傷によるものである可能性がある(図2)。心臓は、心臓代謝を調節することで、病原性シグナルや傷害に適応する優れた能力を持っている。
脂肪酸の酸化は、恒常的条件下での心臓の主要なエネルギー基質である。心不全時には、心筋細胞のエネルギーが変化し、好ましい基質として脂肪酸からグルコースへとシフトする。虚血性の損傷時には、心臓は損傷に適応するためにリモデリングを行い、肥大を示し、この反応は心筋細胞における解糖のアップレギュレーションと関連している100。
この重要な耐病性メカニズムにより、心臓は損傷を受けているにもかかわらず、病原性シグナルの存在下で生理機能を発揮することが可能となる6。ブドウ糖代謝への移行は、心筋の収縮効率を促進し、このように酸素消費に対するATP産生の比率を最適化する。豚モデルでは、グルコースの酸化を増加させ、脂肪酸代謝を減少させることで心臓の効率が改善され101、COVID-19患者では、心臓の病状への適応を促進することで耐病性を促進する方法として有用である可能性がある(図6)。
COVID-19患者では、脳卒中や発作などの脳や中枢神経系に症状が現れることが報告されている102(図2)。脳の特定部位の細胞はACE2を発現しているが、実際にウイルスが脳に感染するかどうかは不明である。
確かに、脳卒中や発作は、呼吸不全や心血管系へのダメージなど、宿主の反応の付随的なダメージの結果である可能性がある。ウイルス性炎症を模倣するためにポリ(I:C)のマウスモデルでは、脳によるグルコース代謝は、感染時に発生するアンフォールドタンパク応答への神経細胞の適応を促進するために必要である7。
絶食による脳へのブドウ糖の利用可能性の低下は、致死的な発作につながる7。この知見は、てんかん患者における観察結果と一致しており、その発作は酸化的グルコース代謝の障害と関連している103。したがって、脳内のブドウ糖代謝を標的とすることは、COVID-19を含む中枢症状を引き起こす幅広い疾患の耐病戦略として有効である可能性がある(図6)。
他の臓器と同様に、腎臓もミトコンドリアの機能不全を示し、重症または重症の場合には細胞内ATPのレベルが低下する104,105。尿道結紮と穿刺を伴う敗血症マウスモデルでは、AMPKの腎リン酸化が上昇している。AMPアナログAICARを用いたAMPKの活性化は、マウスを結紮・穿刺による急性腎障害から保護し、この効果は炎症や内皮細胞の活性化と傷害の減少と関連している106。
この場合、AMPK活性が腎臓へのダメージシグナルとなる炎症・内皮細胞反応をダウンレギュレートするため、AMPKは抗ウイルス機構として作用しているように見える。AMPKはエネルギーの重要な調節因子でもあるため、急性腎損傷に対するAMPK活性による腎保護の一部には、エネルギーバランスの調節と臓器の耐病性の促進が関与している可能性があり、それによって疾患期の腎臓の機能を可能にしていると考えられる(図6)。
骨格筋の萎縮は、肺でのガス交換がうまくいかないために起こるハイパーカプニアの合併症である。損傷した筋肉の分解による萎縮の一形態である横紋筋融解症は、COVID-19の末期患者において報告されている(参考文献42および図2)。
この状態は生命を脅かすものであり、COVID-19患者で観察される急性腎障害と関連している可能性がある。細菌性肺炎による急性肺損傷のマウスモデルでは、白色脂肪組織におけるIGF-1の誘導は、骨格筋へのシグナル伝達を介して細菌性肺炎に対する耐病性を促進し、その結果、骨格筋のサイズを維持する8(図6)。
これらの例は、感染症の間に個人の生理的防御を促進するために、臓器の代謝がどのように調節され得るかを示している。生理的防御機構の全領域を解明し、COVID-19や他の疾患の感染時にこれらの機構を利用するために代謝をどのように標的にすることができるかを明らかにすることは、今後の研究において重要であると考えられる6。
即効性のある臨床的影響
COVID-19パンデミック、過去のSARSアウトブレイク、その他のウイルス性疾患や重症化した疾患の状況から得られたデータは、宿主の代謝を考慮しなければならないことを示している。
代謝異常は重症化および重症化の危険因子であり、COVID-19の疾患コースをコントロールするために代謝パラメータを管理しなければならないことを実証している。血糖管理はCOVID-19のより良い転帰と関連している。
高血糖の症例にはインスリン投与またはGLP1、低血糖の症例にはグルコースのような手段による管理は、患者のケアに有益であるかもしれない。患者の疾患耐性を促進する代謝ストラテジーもまた治療上の可能性があり、複数のシステムにおいて有益な効果を有することができるストラテジーが理想的であろう。
脂肪酸酸化の調節は、様々な臓器および生理学的システムにおける疾患耐性の促進に重要であるように思われるので、そのような可能性のある候補の一つは、PPARアゴニストの投与であろう。PPARアゴニストは、虚血性障害時の心臓、急性障害時の腎臓、ARDSモデルにおける肺損傷に対する組織保護的な役割を持つことが示されている107,108。
トリメタジジンやペルヘキシリンのような脂肪酸の酸化を調節する他の薬剤もまた、心臓、腎臓、肺において保護効果を有しており107,109、追求すべき有望な手段である可能性がある。COVID-19は新しい感染症であるため、感染症を治療するための最も効果的な代謝標的はまだ知られていない。
この病原体は新しいものであるが、その病態は古く、いくつかの重篤で重篤な状態に対して一般化可能である。SARS-CoV-2によって活性化される上流の経路は他の疾患のそれとは異なるだろうが、最終的には病理と死につながる同じ経路に収束する可能性が高い6、したがってCOVID-19と同様の病理を引き起こす他の疾患との間にはいくつかの共通点がある可能性が高いことを示唆している。
結論
感染症パンデミックについて考える際に適切なのは、次のパンデミックが発生するかどうかではなく、次のパンデミックがいつ発生するかという文脈である。次のパンデミックでは、効果的なワクチンや抗菌薬をベースとした戦略が感染症と戦うために利用できる可能性は低い。どのパンデミックにおいても、最初の防御策は、患者の耐病性を促進し、患者が感染から回復するまでの時間を確保するための支持療法であった。
過去1世紀に発生した感染症アウトブレイクの病理を調べてみると、病原体は異なっていても、病理は同じであることがわかる。COVID-19パンデミックは、私たちが感染症をどのように考えるかという点で焦点を広げていかなければならないことを思い知らされる重要な出来事となった。
病理がどのようにして起こるのか、ダメージの結果として生理機能がどのように変化するのか、病理や生理機能障害、免疫反応から身を守るためにどのような方法があるのか、そして病原体を破壊する方法を理解するために、より全体的な視点から感染症にアプローチしなければならないのである。
次のパンデミックが発生したときに、効果的なワクチンが開発される前に感染者を治療できるように、耐病性に基づいた戦略の開発に着手しなければならない。我々は、既往症の病態生理がCOVID-19やその他の感染症の病態にどのように影響を与えているのか、また、これらの病態が患者を感染症によるダメージを受けやすくするのかを理解しなければならない。また、感染症患者の回復過程を理解し、感染症の後遺症がどのように患者を他の疾患を発症しやすくするかを理解しなければならない。
COVID-19、過去のSARSの発生、および一般的に重要な感染症の発生から得られた証拠は、感染症の感受性、治療、および回復のために代謝プロセスと健康との関係を理解することの重要性を浮き彫りにしている。
細胞レベル、組織レベル、臓器レベル、生理学的レベルでの宿主の代謝を標的とすることは、病気の経過に沿った様々な段階でCOVID-19に対する防御を促進するための実行可能なアプローチである。従来の感染症の見方を超えて考えれば、私たちは感染症をより良く治療することができるようになるであろう。
