Contents
A longitudinal study of SARS-CoV-2-infected patients reveals a high correlation between neutralizing antibodies and COVID-19 severity
公開: 2021年1月6日
pubmed.ncbi.nlm.nih.gov/33408342/
ヴァンサン・レグロス、ソレーヌ・ドゥノリー、マノン・ヴォグリグ、ベルトラン・ボソン、エグランティーヌ・シレ、ジョセリン・リガイル、シルヴィ・ピレ、フローレンス・グラタール、シルヴィ・ゴンザロ、ポール・ヴェルホーヴェン、オムラン・アラティフ、フィリップ・ベルテロー Carole Pélissier, Guillaume Thiery, Elisabeth Botelho-Nevers, Guillaume Millet, Jérôme Morel, Stéphane Paul, Thierry Walzer, François-Loïc Cosset, Thomas Bourlet & Bruno Pozzetto
要旨
SARS-CoV-2感染によって誘発される免疫応答を理解することは、再感染からの保護の観点から、公衆衛生政策およびCOVID-19のワクチン開発にとって非常に重要である。本研究では、生きた SARS-CoV-2 粒子または SARS-CoV-2 S ウイルス表面タンパク質(Spike)を偽型化したレトロウイルスを用いて、140 人の SARS-CoV-2 qPCR 確認感染者のコホートから採取した血清サンプル中の中和抗体(nAb)反応を調べた(症状が軽度の患者を含む)。
我々は、nAb価が疾患の重症度および抗スパイクIgGレベルと強く相関していることを示した。実際、集中治療室の患者は高いnAb価を示した;逆に、軽度の疾患症状の患者は不均一なnAb価を示し、無症状の患者や外来診療のみの患者はnAb価がないか、または低いことがわかった。
SARS-CoV-2 に感染した患者の nAb 活性は、他のコロナウイルスに感染した患者と比較して、回復後に比較的急速に低下することがわかった。さらに、常在コロナウイルスと SARS-CoV-2 との間に交差中和が見られなかったことから、ヒトコロナウイルスの過去の感染により、SARS-CoV-2 に対する保護 nAbs が生成されない可能性が示唆された。
最後に、最近ヨーロッパで現在の主要な変異として同定されたスパイク蛋白質のD614G変異は、中和のエスケープを許さないことを発見した。
以上の結果は,SARS-CoV-2 誘発疾患の免疫関連の理解に貢献するものであり,SARS-CoV-2 の病態における体液性反応の役割を迅速に評価することが必要である.
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は 2019年後半に中国の武漢で初めて出現した。ジョン・ホプキンス大学とコロナウイルスリソースセンターによると、コロナウイルス病(COVID-19)と名付けられたSARS-CoV-2によるこの病気は 2020年8月中旬までに世界で75万人以上の死亡者を出しており、感染者は2100万人を超え、過小評価されている可能性が高い数字となっている。本疾患の特徴は急性呼吸窮迫症候群であるが、喉の痛み、乾いた咳、発熱、倦怠感、筋肉痛、鼻水、下痢などの非特異的な症状を伴うことが多いです1。
SARS-CoV-2 感染によって誘発される免疫反応を理解することは、再感染から身を守るという観点からも、公衆衛生政策やワクチン開発のためにも極めて重要である。3,4 SARS-CoV-2感染から回復したほとんどの人は、感染後7~14日目にSARS-CoV-2ウイルスのヌクレオカプシド(N)またはスパイク(S)タンパク質を標的としたIgM、IgG、IgA応答を発現することが報告されている5,6,7。7,8,9 SARS-CoV-2に対する防御の免疫的相関関係についての見解が乏しいことを考えると、他のヒトコロナウイルスによる免疫反応から推測したくなる。例えば、パンデミック性コロナウイルス感染者のnAb活性は、再感染が頻繁に報告されているように、それ以外の時期には急速に衰退することがある10 が、SARS-CoVや中東呼吸器症候群関連コロナウイルスに対するnAbは最大36ヶ月間検出される11,12 。
本研究では,SARS-CoV-2 感染が確認された 140 例の SARS-CoV-2 感染者コホートの血清中の nAb 活性を定量した。その結果、nAb の力価は疾患の重症度と強く相関することが示された。重要なことは、nAb活性の持続性も定量化したことであり、回復後のnAbの減少が比較的急速であることを示している。さらに、常在コロナウイルスの感染による交差防御は認められなかった。最後に、最近ヨーロッパで発見された主要な変異体として同定されたスパイク蛋白質の D614G 変異は、nAb 逃避を誘導しないことを発見した13。
材料と方法
倫理学
この研究は、サンテティエンヌ大学病院の倫理委員会(参照番号IRBN512020/CHUSTE)によって承認された。
患者とサンプルの由来
2020 年 3 月から 5 月までの間に、サンテティエンヌ大学病院で追跡された合計 140 例の患者が登録された。全患者において鼻咽頭スワブを採取し、逆転写酵素qPCR(RT-qPCR)アッセイによりSARS-CoV-2 RNAが陽性と判定された。患者は医療処置により3つのグループに分類された。集中治療室(ICU)に入院したのは44例,ICUでの治療を受けずに入院(HOS)したのは42例,無症状の8例(ASY)を含む54例が排他的外来治療(EOC)を受けた。
発症後時間は、最初の症状が発現してからの時間と定義した。
ICU群とHOS群では、発症後の3つの期間(0~15日、16~30日、30日以上)の追跡調査で3~4検体の血清を採取した。EOC群では、発症後13~62日目に2検体の血清を採取した。
野生型SARS-CoV-2を用いた血清中和アッセイ
nAbアッセイに使用したVero-E6細胞(ATCC CRL-1586)上で培養したウイルス株(RoBo株)は、重度のCOVID-19を有するサンテティエンヌ大学病院の患者HOSの鼻咽頭吸引液から得られた臨床分離株であった。この菌株を、1ml当たり100〜500個の組織培養感染用量50%(TCID50)を含むアリコート中のダルベッコの修正イーグル培地-2%子牛胎児血清で希釈した。各血清検体を1:10に希釈し、連続2倍希釈液を等量のウイルス(100μlずつ)と混合した。室温で30分間穏やかに振盪した後、混合物の150μlを、Vero-E6細胞で覆われた96ウェルマイクロプレートに移した。次いで、プレートを5%CO2インキュベーター中で37℃に置いた。測定は、5〜6日後に、ウイルスコントロールの細胞毒効果が〜100TCID50/150μlに達したときに顕微鏡的に得られた。細胞層の>50%が保存された場合、血清は細胞を保護したと考えられた。中和力価は、細胞を保護したより高い血清希釈の逆数として表される。
SARS-CoV-2偽粒子の調製と中和
簡潔に説明すると、HEK293T細胞(ATCC CRL-1573)に、MLV Gag-Pol、緑色蛍光タンパク質(GFP)レポーター、およびSARS-CoV-2スパイク(D. Lavillette氏からの寄贈品)を発現するコンストラクトをトランスフェクトした。D614G変異を有するスパイクタンパク質をコードするプラスミドをPCR突然変異誘発により生成した。15 中和アッセイのために、~1×103の擬似粒子のサンプルを、Vero-E6R細胞の感染前に37℃で1時間、血清または対照抗体の100倍希釈でインキュベートした。ID50(すなわち、感染性の50%を阻害する血清希釈)を決定するために、ICU患者からの血清の連続3倍希釈液を疑似粒子と混合し、上記のように処理した。導入後72時間で、GFP陽性細胞の割合をフローサイトメトリーにより決定した。対照として、RD114疑似粒子を用いて同様の処置を行った。
抗スパイクSARS-CoV-2 RBD(Sino Biological)抗体および抗gp70 RD114(ViroMed Biosafety Labs)抗体を、それぞれ陽性および陰性対照nAbsとして使用した。
SARS-CoV-2ppの抗体依存性増強
抗体依存性増強(ADE)アッセイでは、THP-1細胞(ATCC TIB-202)に感染する前に、1×103個の擬似粒子のサンプルを、血清または対照抗体の100倍希釈および5000倍希釈で1時間37℃でインキュベートした。導入後72時間で、GFP陽性細胞の割合をフローサイトメトリーで測定した。対照として、VSV-G疑似粒子を用いて同様の手順を行った。
SARS-CoV-2に対するIgG抗体測定用市販キット
抗SARS-CoV-2 IgG抗体の測定には、2つの市販キットを使用した:S1-S2タンパク質に対する抗体を測定するLIAISON® SARS-CoV-2 S1/S2キット(Diasorin)およびウイルス核タンパク質に対する抗体を測定するARCHITECT SARS-CoV-2 IgGキット(Abbott Laboratories)。
統計的分析
統計解析は、GraphPad Prism-6ソフトウェアを用いて行った。有意値は、グループに応じて、Kruskal-Wallis検定、Dunnの多重比較検定またはt検定を用いて算出した。変数間の相関を評価するために、スピアマン係数とp値を計算した。2次多項式回帰は、95%信頼区間を示す線とリボンを用いてプロットした。P値<0.05は統計的に有意とみなされ、以下の表記が使用された。****P ≤ 0.0001; ***P ≤ 0.001; **P ≤ 0.01; *P ≤ 0.05; ns(有意ではない)P > 0.05。
結果
COVID-19の患者さんと臨床情報
本研究では,Saint-Etienne大学病院(フランス)のSARS-CoV-2感染症の検査室確認済み患者140例を対象に,同意を得た。そのうち,44例がICUに入院し,42例がICUでのケアを受けずにHOSとなり,54例がEOCを受けた(うち8例はASY患者).さらに、季節性コロナウイルスに感染している被験者の血清検体は 9 例であった。日常的な臨床管理のために採取された血液サンプルのうち、廃棄された血液サンプルの利用可能性に基づいて、COVID-19症状の発症後の様々な時点で患者から合計299検体の血液サンプルが採取された。重要なことに、いくつかの患者は、ICU患者19人、HOS患者14人、EOC患者4人と、発症後117日目までに少なくとも3回の採血が行われた。
全体的に、このコホートでは、COVID-19の重症度のばらつきと、すでに特定されている共通の併存疾患が再現されていた16,17,18。ICU群とHOS群の主な臨床症状は、発熱(90.1%)呼吸困難(56.3%)咳(53.5%)無力症(29.6%)下痢(23.9%)筋肉痛(8.5%)喀痰(7.0%)および無呼吸・嚥下(4.2%)であった。臨床症状は両群間に差はなく、重症度に差があった。EOC群では、中等度の症状は発熱、咳嗽、無力症が中心であった。
表1 COVID-19患者の3群の特徴
疑似粒子中和は野生型SARS-CoV-2の中和と相関する
生きたウイルスの試験管内試験中和は、nAbsの評価のためのゴールドスタンダードな方法と考えられている。しかし、SARS-CoV-2はBSL-3施設を必要とし、評価には時間がかかる。そこで、我々は、迅速、安全かつ確実にnAb活性を評価するために、SARS-CoV-2ppアッセイと名付けられたSARS-CoV-2擬似粒子アッセイを開発した。非特異的中和活性を識別するために、SARS-CoV-2ppアッセイで検査した各血清は、RD114pp(補足図1)すなわち、猫内在性レトロウイルスRD114.15の表面糖タンパク質でコーティングされた疑似粒子と並行して試験した。
我々はまず、2つのアッセイ、すなわち、生きたSARS-CoV-2と疑似粒子を使用して、COVID-19患者からの血清サンプルの中和活性を比較した。ライブウイルスについては、中和は、ID50(感染性の50%を阻害する血清希釈)によって評価された;疑似粒子アッセイのために、それは無血清状態に対する1/100血清希釈でのパーセント中和として表された。陰性血清、すなわちパンデミック前血清と同様に、140人の患者からの各血清サンプルのnAb活性を、いずれかの方法を用いて盲検的に定量した。高いスピアマン順位相関(ρ=0.75)によって示されるように、同様の結果が得られた(図1A)<1.5%の有意な不一致点があった。したがって、SARS-CoV-2ppに基づく中和アッセイは、nAb活性を定量するために確実に使用することができる。
図1 SARS-CoV-2の血清中和はCOVID-19患者の入院単位と相関している
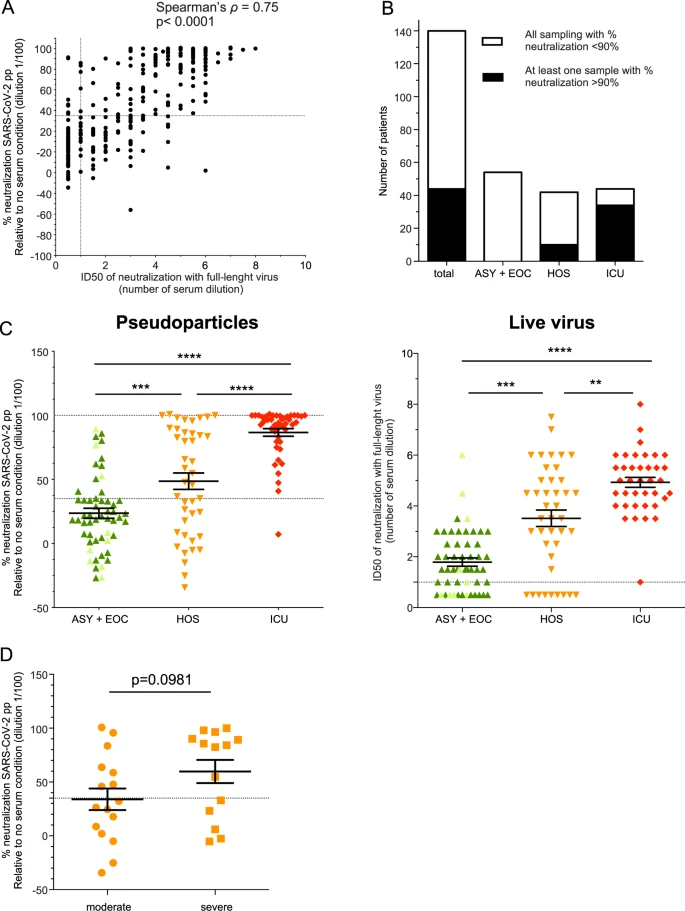
A 希釈数(1/10で希釈した血清から始まる2倍希釈)としてプロットされた生ウイルスのID50と、すべての検査済みサンプルについてのSARS-CoV-2ppの中和率との間の相関。B 中和率に応じて示されたグループに分類された患者数。白色:中和率が90%以下になったサンプル。C 入院単位に応じて分類された患者ごとの SARS-CoV-2pp との中和率(左)または生ウイルスとの ID50(右)の比較。血清が連続して採取された患者については,症状発症から 20日後に最も近い時期に採取された血清を選択した。薄緑色の部分は、EOC患者のうち無症候性患者(ASY)である。D HOS患者における症状の重症度に応じた中和の割合。中和のカットオフ(35%)は、SARS-CoV-2ppについては、陰性血清1/100希釈の平均中和率+2 SD58を用いて設定した。野生型ウイルスについては、すべての陰性血清がこの閾値以下であったため、ID50のカットオフは1/10希釈(最初に試験した希釈)に設定した。
SARS-CoV-2 nAb反応はCOVID-19症状の重症度と相関する
SARS-CoV-2感染後に生じる体液性免疫応答を調べるために、SARS-CoV-2ppと野生型ウイルスの両方を用いて、患者の血清サンプルのnAb活性を症状の重症度の関数として比較した。
その結果、中和活性には大きなばらつきがあったが、異なるグループのほとんどの患者がnAbsを産生していた(図1C)。さらに、44人(31.4%)の患者がロバストな中和を示し、SARS-CoV-2ppアッセイでは90%以上の中和が可能であった(図1B、合計)。
驚くべきことに、ICU患者は、HOSやEOC患者のような疾患症状の軽い他のグループと比較して、高いnAb活性を示したことがわかった(図1C)。実際、ICU患者のうち、サンプリング時にnAb反応を示さなかったのは1人だけであり、HOSおよびEOC患者では、nAb活性は低く、より不均一であった。具体的には、HOSおよびEOCの患者では、それぞれ21.9%および25%の患者で、サンプリング時に野生型SARS-CoV-2を中和するnAbを発現しなかった(図1C右)。また、HOS患者の34.5%の血清にはSARS-CoV-2ppに対する中和活性が認められず、EOC患者では70.7%に増加した(図1C左)。
HOS患者については、症状の重症度に応じた分類を試みた。その結果、呼吸数が30/分以上、血中酸素飽和度が92%以下、CTスキャンや集中酸素療法で肺病変が認められた患者を「重症」と定義した。HOS患者は、上記の基準を満たさない場合は「中等度」に分類された。しかし、HOS患者の症状の重症度とnAb価との間には有意な相関関係は認められなかった(p=0.0981)。このことは、症状の重症度だけがHOS患者のnAb活性の多様性を説明する唯一の要因ではないことを示している。さらに、中和と年齢、性別、または最初に陽性のRT-qPCR評価のCtとの間に関連性は見出されなかった(データは示されていない)。
最後に、いくつかの血清が SARS-CoV-2pp 感染性を増強するようであることを観察した。抗体が感染を促進し、したがってウイルスの拡散を促進するかどうかを調べるために、異なるFcγ受容体を発現するTHP-1細胞への感染を介して、異なるグループの患者からの血清によって媒介されるADE効果を試験した(補足図2)。軽度(n = 7)中等度(n = 10)重度(n = 9)の病型を発症した患者からの血清と、他のコロナウイルスに感染した患者(n = 9)からの血清を選択した。しかし、どのような状態でも増加は観察されず、ICU 患者で観察された重症型の疾患は ADE を媒介していないことを示唆している。
全体的に、これらの結果は、nAb活性と症状の重症度との間に高い相関性があることを示しており、重症の症状を持つ患者でのみ頑健な体液性反応が生じるか、体液性反応が疾患の悪化に寄与していることを示唆している。
SARS-CoV-2抗N抗体および抗S抗体はnAb反応と相関する
検出可能な nAb 活性を持たない EOC 患者が多数存在することから、一般的に nAb の高力価は感染に対する保護を与えると考えられているため、感染した患者における保護の相関関係を特定することに疑問が生じる。そこで我々は、SARS-CoV-2粒子の成分に対して上昇したIgG応答が、患者サンプルで検出されたnAb活性と相関するかどうかを確認しようとした。この目的のために、抗Sおよび抗N IgG反応を、市販の2つの検査法を用いて測定した。我々は、SARS-CoV-2陽性患者からのサンプルのほとんどが、少なくとも1つのアッセイで陽性であることを発見した(図2A、B)。興味深いことに、抗S IgG力価はnAb力価と高い相関を示したが(スピアマンのρ=0.7075,図2B)抗N IgGとnAbsの間の相関は低かった(スピアマンのρ=0.5765,図2A)。注目すべきことに、抗Nおよび抗Sの力価は、軽度の相関を示しただけであった(スピアマンのρ=0.5148,補足図3)。このような違いは、患者の各カテゴリー間のIgGの分布を比較したときに特に明らかであった。実際、EOC患者とICU患者の間では、抗S IgGのプロファイルの重なりは低く、nAbsのプロファイルに類似していた(図1Cと図2C左の比較)が、EOC患者とICU患者の間では、抗N IgGの値の強い重なりが検出された(図1Cと図2C右の比較)。これは、抗S IgG値がnAb活性の存在およびレベルを示すのに関連していることを示唆している。実際、我々の結果は、抗SIgG値が>124AU/mLの血清の95%がSARS-CoV-2ppを強く中和し得ることを示した(>90%中和)。
図2 SARS-CoV-2の血清中和は抗S抗体と相関する
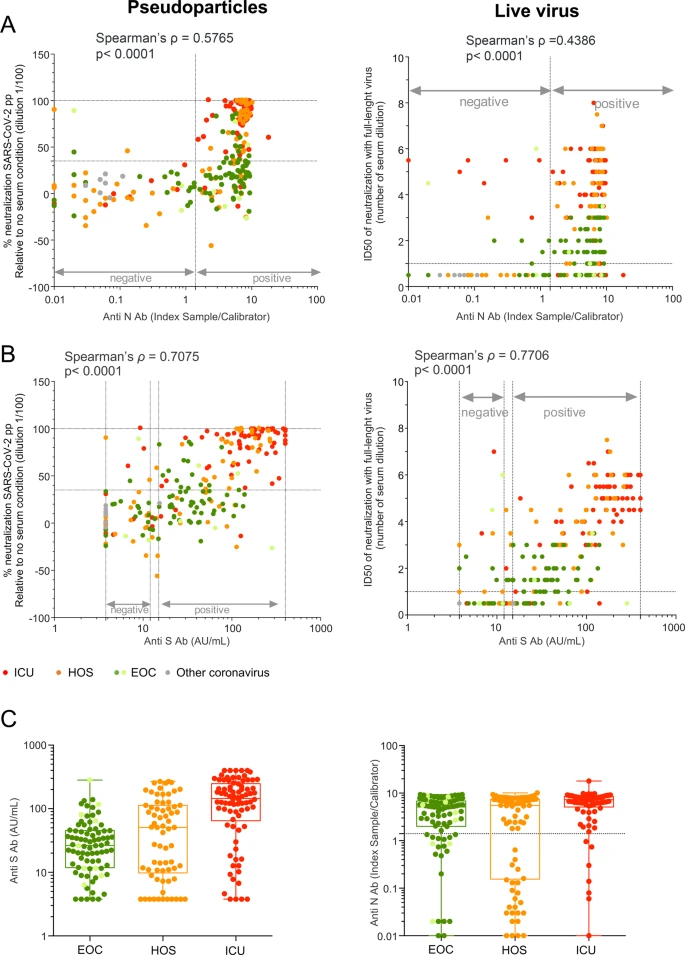
A SARS-CoV-2ppの中和率(左)または生ウイルスのID50(右)と抗N抗体で測定した血清中和率との相関。B 抗S抗体を用いたAと同じ。C 3群の患者における抗S(左)および抗N(右)IgG値の分布。
全体的に、これらの結果は、抗S IgG反応が個体における中和活性のマーカーとして使用できることを示している。
SARS-CoV-2のAb動態は、COVID-19患者におけるnAb活性の急速な衰えを示す
次に、抗S IgGおよびnAb活性の動態を評価した。実際、臨床形態の多様性に加えて、我々のコホートの重要な特徴の一つは、ほとんどの患者で血清を連続的に採取していたことであり、体液性因子の持続性を推定することができた。我々は、体液性反応を示した患者では、抗S IgGとnAb活性の両方が症状発症後5-7日目に一般的に検出可能であることを発見した。これらの抗体は急激に増加してピークに達するが、発症40日後から徐々に減少するようであった(図3A、B)。さらに、抗S IgGの傾向はnAbsと同様のパターンをたどっており、抗S IgGと中和活性の相関性をさらに確認することができた。
図3 中和抗体の出現と寿命
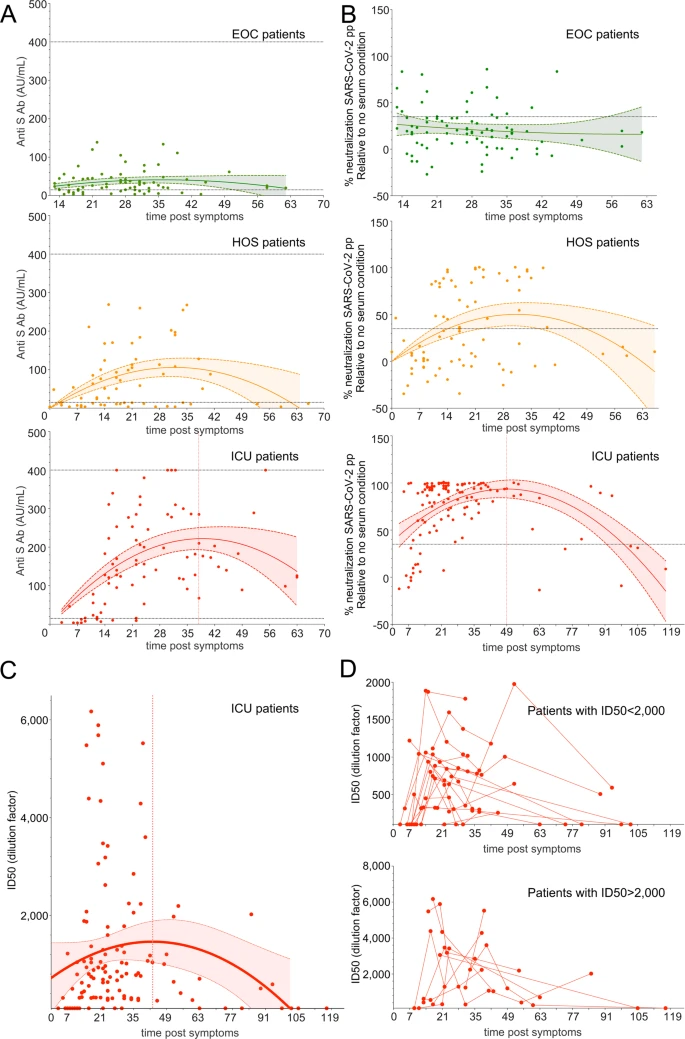
A 抗S IgGsによって評価された血清中和率は、サンプルが収集された症状後の日数に対してプロットされている。B SARS-CoV-2ppで評価した各血清サンプルの中和率を、サンプルを採取した症状後の日数に対してプロットした。線は 2 次多項式回帰から予想される平均値を示す;リボンは点単位の 95%信頼区間を示す。C SARS-CoV-2pp で評価した中和抗体価(ID50)を、サンプルが収集された症状後の日数に対してプロットしたもの。線は 2 次多項式回帰から予想される平均値を示す;リボンは点単位の 95%信頼区間を示す。D nAb価(ID50)が2000以下(上)またはそれ以上(下)のICU患者について表示された個々の動態。
nAb活性の動態についてさらに詳しく知るために、ICU患者の各血清サンプルのnAb力価(ID50)を計算したところ、ID50は比較的不均一で高く(2092±1724)一部の患者では6000までの値を示すことがわかった(図3C)。これらの結果から、中和活性の急激な低下も確認されたが、2次多項式関数を用いてモデル化した結果、試験した多項式の中で最も優れたモデルであることが判明した(図3C)。具体的には、発症60日後に採取された11の血清サンプルのうち、7人の患者は検出可能な中和活性を示さず、4人の患者は、最大値と最後のID50の間のID50中央値が4倍以上低下したnAbの力価が強く低下していた(中央値ID50max = 2700,中央値ID50final = 648.5)(図3D)。
SARS-CoV-2の交差中和は、代替コロナウイルスへの過去の感染によっては誘導されない
これまでの報告では、他のコロナウイルスに対する免疫が、固有のコロナウイルスに対して一定の保護を与える可能性が示唆されていた19 。そこで、SARS-CoV-2 に感染していない OC43,229E、NL63,HKU1 コロナウイルス感染者の血清検体(図 4A)を用いて、SARS-CoV-2 を交差中和する可能性を検討した。しかしながら、試験したサンプルのいずれも、検出のカットオフ値以上の中和活性を示さなかったことが判明した(図4B)これは、SARS-CoV-2と常在性コロナウイルスとの間に交差中和が存在しないことを示唆している。
図4 固有のコロナウイルスに感染した患者からの血清は、SARS-CoV-2に対する交差中和活性を有していない
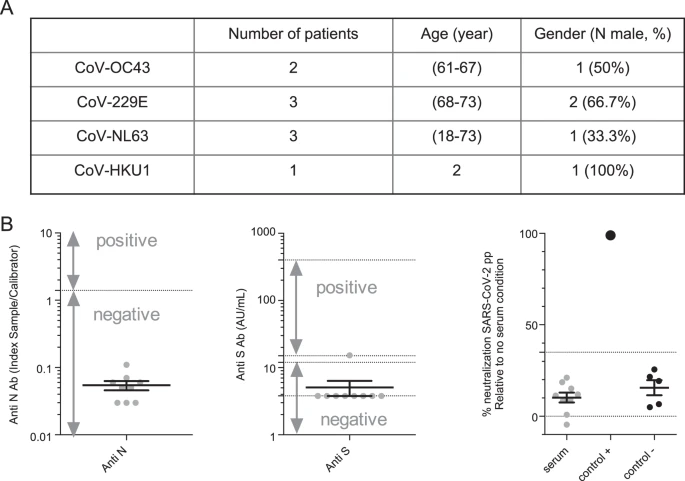
A 他のコロナウイルスに感染した患者からのサンプルの特徴。B 抗N(左)および抗S(中)SARS-CoV-2によって評価された血清転換、またはSARS-CoV-2pp(右)によって測定された中和。中和アッセイについては、市販の抗S抗体を陽性対照(対照+)として使用し、5種類のプレパンデミック血清サンプルを陰性対照(対照-)として使用した。
D614G置換はSARS-CoV-2中和に対する抵抗性とは関連していない
コロナウイルスの変異の程度を考えると、SARS-CoV-2の免疫逃避変異体の出現が懸念されてきた。特に、G614 スパイクタンパク質変異体が徐々に出現し、武漢株に当初存在していた D614 残基に取って代わり、現在では世界の分離株の 97%以上を占める支配的なパンデミック型となっている13 。D614G 変異が与える可能性のある中和のエスケープ表現型の可能性に対処するため、我々は SARS-CoV-2pp アッセイを使用した。しかし、D614G変異は、類似した中和プロファイルで示されるように、我々のコホートの血清検体のnAb活性に影響を与えないことがわかった(図5)。
図5 SARS-CoV-2スパイクの614位の残基は、nAbsの活性に影響を与えない
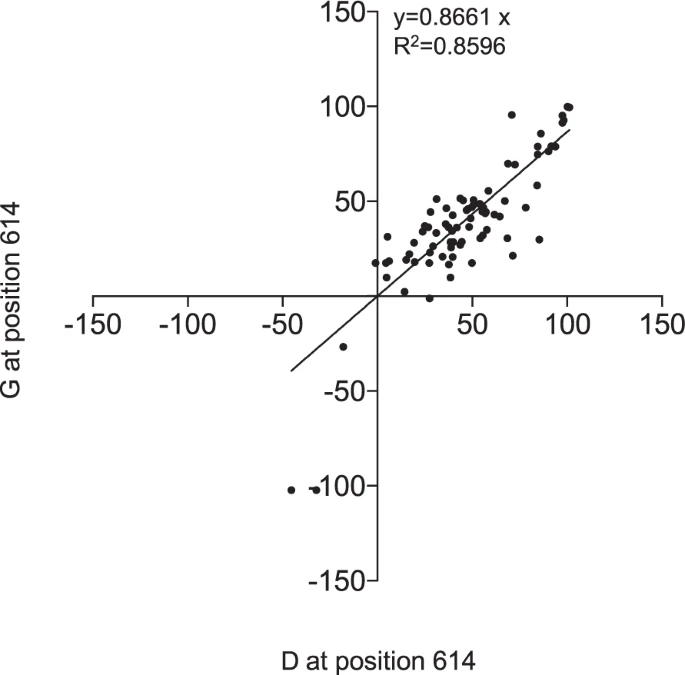
614の位置のGまたはDのいずれかを有するスパイクタンパク質を用いたSARS-CoV-2ppの中和の割合
議論
SARS-CoV-2に対する防御免疫反応の性質についての理解は現在のところ限られているが、細胞性免疫と体液性免疫の両方が関与している可能性が高い。ここでは、SARS-CoV-2感染者のコホートにおける体液性免疫反応の特徴を明らかにする。本研究で使用した血清検体は、特定の基準に基づく選択をせずに、ルーチンの臨床管理に従って収集した。これは統計的解釈を制限する可能性があるが、このコホートはCOVID-19患者の間での重症度の異なる形態の特に適切な画像を表しており、したがって、独自の縦断的研究を可能にしている。
ライブウイルスまたはSARS-CoV-2ppアッセイのいずれかを用いて、COVID-19の重症度が異なる患者の血清中のnAb反応を、ICUにいる患者だけでなく、より中等度の疾患形態を持つSARS-CoV-2陽性者も含めて、入院状態に応じて比較した。最近の報告では、COVID-19患者の血清の中和活性が評価されており、その結果には賛否両論がある。ある研究では、患者は急速にnAbsを発現すること21が示唆されているが、他の研究では、体液性反応22およびnAb活性22,23,24は、疾患の重症度を含むいくつかのパラメータと相関していることが示されており、その結果、かなりの数の軽度の症状およびASYではnAb活性が検出されないことが示されている25。対照的に、我々のコホートは140人の患者で構成されており、そのうち3分の1は発症後に複数回のサンプリングを行ったICU患者であった。これらの特徴により、nAb活性と疾患重症度、IgG反応、抗体レベルの動態との相関などの重要な問題に取り組むことができた。
ここでは、COVID-19患者における体液性反応の不均一性を確認した。年齢や性別などのパラメータはnAb活性と関連していないことがわかったが、最も軽症の患者では、多くの患者が頑健な中和活性を示さなかったことを示した(図1)。重要なことは、入院ユニットの状態で評価される重症度が、抗S IgG価と同様にnAbsレベルと強く相関していることである(図1および2)。これは、最も重症度の高い患者で最も強いT細胞シグナルが見られるという最近の観察結果と一致しており、SARS-CoV-2の発症におけるT細胞活性化の有益な効果と有害な効果についての疑問を投げかけている26。実際、他の研究28では、年齢と中和活性との間に中程度の相関関係が観察されている。それにもかかわらず、同じ疾患重症度グループ内で年齢がnAb活性と関連しているかどうかを調べたところ、相関関係は認められず、したがって、疾患重症度が患者の中和活性を説明する主な因子であることを示唆している。最後に、ADEはCOVID-19の最も重篤な症例を説明する潜在的なメカニズムとして提案されている29,30。しかしながら、我々の実験ではADEは観察されなかったが、これはADEが我々の患者が経験した重篤な症例に関与しているわけでも、SARS-CoV-2以外のコロナウイルスの過去の感染によって引き起こされたわけでもないことを示唆しているかもしれない。
重要なことは、ほとんどのウイルス感染症では、高いnAb価は通常ウイルスクリアランスと関連しているが、頑健なnAb活性はCOVID-19では疾患進行に対する保護を与えていないようである。臨床的証拠の増加に伴い、31,32,33のように、疾患の重症度はウイルス負荷が高いことと相関しており、したがって抗体を誘導できる抗原の数が多いことが示されている。しかし、我々のコホートでは、ICU患者の初期ウイルス負荷が有意に高かったにもかかわらず、ウイルス負荷とnAb活性の間に相関関係は認められなかった(補足図4)。それにもかかわらず、我々の患者のサンプリング条件が相関関係の可能性を正確に分析できなかった可能性があることに注意すべきである。実際、RT-qPCR によるウイルス負荷の評価に使用された最初の鼻咽頭スワブは、異なる患者の臨床歴や異なる臨床医によって、感染発症後の異なる時期(我々の場合は 4 日間から 10 日間)に採取されたものであり、これが最初の qPCR 陽性サンプルの信頼性の低いウイルス負荷評価につながる可能性がある。実際、抗体は、防御的な結果と病理学的な結果の両方をもたらす可能性のある付加的な免疫機能を媒介している。さらに、COVID-19患者における体液性反応は、サイトカインおよびケモカインレベルと相関していることが示されている35 。これらは、本疾患の最も重篤な形態で見られる「サイトカインストーム」として知られる重篤な全身性炎症反応の主要な影響因子である36 。
また、血清転換とnAb活性の相関関係についても解析した(図2,3)。最初の報告では、血清中のIgG値の低さが重症化と関連していることが示されていたが、最近の多くの研究ではその逆のことが示されている38,39,40 。我々の研究では、抗Sおよび抗N IgGの両方のレベルがnAb価と相関していたが、抗S抗体との相関はより強く、これはおそらくSARS-CoV-2決定因子に対する抗体の多様性を反映していると思われる43。44 したがって、中和活性がその後の再感染に対する保護に関連しているとすれば、例えば酵素結合免疫吸着法による抗S IgG価の測定は、特に最も中等度の患者では中和活性が強く発現しにくいため、保護された患者と保護されていない患者を区別するのに有用であるかもしれない。我々のコホートでは、124 AU/mL以上の抗S抗体値を有する血清サンプルの95%がロバスト中和(90%以上の中和)と関連しており、抗S抗体測定は、抗N IgGアッセイではなく、nAb活性の評価として使用される可能性があることを示唆している。
本研究に参加した患者のほとんどについて、いくつかの連続したサンプルが利用可能であったため、我々はまた、nAbレベルの安定性の問題にも取り組んだ。SARS-CoV-2免疫はアカゲザルモデルでは防御的であり、少なくとも35日間は持続するようである45 。我々は、他の研究者が以前に示したように、ピークに達した後にnAb活性と抗S IgG価が低下する傾向を確認した46 。重要なことは、ICU患者の場合、我々の結果はnAb活性の持続性をより正確に推定することができるということである。我々のモデルでは、SARS-CoV-2のnAb活性は急速に消失する可能性が高く、4ヵ月以上は持続しないと予測している。明らかに、このような数学的モデルは慎重に検討されるべきであり、回復後のnAb活性の低下または安定性をよりよく予測するために、治療後期の患者(6ヵ月以上)からの血清を用いた結果が得られた場合には、再評価が必要である。それにもかかわらず、我々の結果は、患者における抗SARS-CoV-2抗体の急速な減少を示した先行研究40,47,および抗原特異的IgAおよびIgMの減少を反映したnAb活性の低下を示した最近の報告と一致している46。
全体的に、我々の結果は、SARS-CoV誘発性疾患とは対照的であり、nAbsが検出された期間は約270日間であり、ID50が100を超えていた51,52。したがって、SARS-CoV-2では、このようなnAb活性の低下が防御機能の欠如と関連しているのか、あるいは、潜在的な再感染が免疫メモリーを誘発し、より速く、より高いnAbs産生を誘導し、最終的には感染をより良く制御し、症状を軽減するのかどうかを判断する必要がある。SARS-CoV-2 nAbsの持続性を評価するためには、さらなる研究が必要である。
パンデミックが始まって以来、Sタンパク質の自然発生的な変異が報告されている。その中で、614位に1つの変異を持つ変異体(D614G)が、現在の支配的な循環ウイルスとなっている。20 SARS-CoV-2pp の中和活性を D614 および G614S と比較することで、この変異が中和抵抗性と関連していないことが確認された。
最後に、我々はまた、呼吸器疾患や腸疾患、神経疾患を含む成人の軽度の症状を引き起こす代替コロナウイルスに感染した患者からの 9 つの血清サンプルを分析した53 。興味深いことに、循環する Abs の交差反応性を調べたところ、9 つのサンプルのいずれも SARS-CoV-2 感染症に対して交差反応性のある nAbs を示さなかった。さらに、SARS-CoV-2の交差中和は、SARS-CoV患者の血清によって誘導される可能性があり、これは血清に依存すると思われるが、これら、2つのウイルス間の相同性が高いことによると考えられる56,57 。このように、我々の結果は、SARS-CoV-2と他の常在性ヒトコロナウイルスとの間に交差中和がないことを示しており、他のコロナウイルスへの過去の感染によって生じたnAbsや他の非nAbs6がSARS-CoV-2感染を防御しないことを示唆している。
