A Hypothesis for the Possible Role of Zinc in the Immunological Pathways Related to COVID-19 Infection
www.ncbi.nlm.nih.gov/pmc/articles/PMC7365859/
キーポイント
- 亜鉛欠乏症は一般的であり、重度の感染症と関連している場合がある。
- 亜鉛はウイルスに対するインターフェロン1型反応を高めるのに役立ち、多くの調節経路に参加している。
- 亜鉛のレベルが低いと、IL-6応答が高くなることと関連している。
- IL-6はCOVID-19感染による重症肺障害において重要な役割を果たしている。
- 亜鉛は、SARS-CoV RNAポリメラーゼを阻害し、従ってその複製能力を阻害する。
- 亜鉛は亜鉛イオノフォアであるため、抗マラリア薬の効力を高める可能性がある。
- COVID-19感染による死亡率の差は、174 IL-6遺伝子多型によってある程度説明される可能性がある。
亜鉛(Zn)は、鉄に次いで人体に豊富に存在する微量金属である。しかし、鉄とは異なり、専用の亜鉛貯蔵庫は存在しない(1)。亜鉛の機能は、触媒的、構造的、調節的に分類することができる(2)。例えば、重要な亜鉛金属酵素には、アルカリホスファターゼ、RNAポリメラーゼ、アルコール脱水素酵素などがある(3)。
亜鉛欠乏症は免疫系のアンバランスを引き起こす可能性があり、重度の欠乏症では感染症、皮膚障害、胃腸障害、体重減少、成長遅延、男性ホルモン分泌低下などの症状が現れやすくなる(4)。重度の亜鉛欠乏は稀であるが、軽度から中等度の亜鉛欠乏は世界的に一般的である(5)。
亜鉛はほとんどがアルブミン、α-2-マクログロブリン(A2M)、トランスフェリンなどのタンパク質と結合しているため、血漿中の遊離亜鉛濃度は非常に低くなっている。そのため、血漿中の亜鉛濃度は約1μg/mlと、体内総亜鉛の0.1%にしかならないが、それでも亜鉛の恒常性維持のための最も重要な貯蔵庫であり、「遊離」または「乏しい」亜鉛の動員を必要とする(6, 7)。運動学的研究では、肝臓やその他の組織内にある亜鉛の「機能性プール」は、体内の亜鉛のごく一部(10%)に過ぎず、血漿中の亜鉛と迅速に交換されていることが示唆されている(8、9)。
この機能性プールが枯渇すると、亜鉛欠乏症になる(8)。細胞内の亜鉛は、ジンコソームと呼ばれる亜鉛貯蔵小胞や核などの小器官に分布している。細胞質では、亜鉛は主にメタロチオネイン(MT)と呼ばれる亜鉛キレート性タンパク質と結合している。亜鉛の恒常性は、亜鉛の分布の正しいバランスであると理解されている。
内部の亜鉛の恒常性は、2つの金属輸送タンパク質ファミリーの協力的な活動によって調節されている。一方のファミリーは10個の溶質結合キャリア30(SLC30またはZnT)の輸出者で構成され、もう一方のファミリーは14個の溶質結合キャリア39(SLC39またはZIP)の輸入者で構成されている(10, 11)。例えば、体内のほとんどの不安定な亜鉛は、SLC39a4タンパク質を介して腸管上皮細胞に吸収され、過剰な亜鉛はSLC39a5を介して腎臓、腸を介して排泄される(12)。
現在、我々は、重度の急性呼吸窮迫症候群(ARDS)を引き起こす可能性のあるSARS-CoV-2と呼ばれる新規RNAコロナウイルスによるCOVID-19パンデミックを経験している(13)。2019年末に中国の武漢省で初めて検出され(14)、2020年3月11日にWHOはCOVID-19をパンデミックと認定した(15)。報告されている感染者の死亡率は国によって異なる(0.5~7.7%)が、以前はイタリアとスペインで、現在は米国、英国、ブラジルで最も注目されている(16~19)。
年齢、男性の性、糖尿病、心血管疾患、肥満などの慢性代謝性疾患の既往が感染の重症度と関連している(20)。特定の治療法はまだない。多くの薬剤が様々な成功を収めながら使用されているが、臨床試験でその有効性が実証されたものはない。例えば、クロロキンやヒドロキシクロロキンなどの抗マラリア薬、ロピナビル/リトナビルやレムデシビルなどの抗ウイルス薬、抗インターロイキン6(IL-6)受容体抗体としてのトシリズマブなどが挙げられる(21-24)。
レムデシビルは、症状発症から10日以内に治療を開始した臨床試験で良好な初期臨床成績を示している(25)。対照的に、中国で行われた重症COVID-19(低酸素症とX線写真で確認された肺炎)患者237人を対象とした二重盲検無作為化試験では、レムデシビルとプラセボを10日間投与した場合と比較して、臨床的改善までの期間に統計学的な差は見られないであった(改善までの期間中央値は21日 vs. 23日;改善のためのハザード比は1.23 [95% CI 0.87-1.75])。(26).
抗マラリア薬に関しても、混合した議論の余地のある結果が発表されている(27)。したがって、治療法について結論を出すには、より強固なデータが必要である。IL-1およびIL-6は、重度の肺炎症において重要な役割を果たし、急性呼吸窮迫症候群を引き起こし、患者の死亡につながる可能性がある(28, 29)。この経路は、重症急性呼吸器症候群(SARS)を引き起こすSARS-CoVおよび中東呼吸器症候群(MERS)を引き起こすMERS-CoVに関連していると考えられている(30)。
重症のSARS患者では、合併症を伴わないSARS患者と比較して、プロ炎症性サイトカイン(IL-1、IL-6、IL-12、インターフェロンγ(IFN-γ)、トランスフォーミング増殖因子-β)およびケモカイン(CCL2、CXCL9、CXCL10、およびIL-8)の血清中濃度が高いことが明らかになった(31)。樹状細胞およびマクロファージのMERS-CoV感染は、TNF-α、IL-6、CXCL-10、CCL-2、CCL-3、CCL-5、およびIL-8などのプロ炎症性サイトカインおよびケモカインの強力かつ持続的な産生をもたらす(32)。
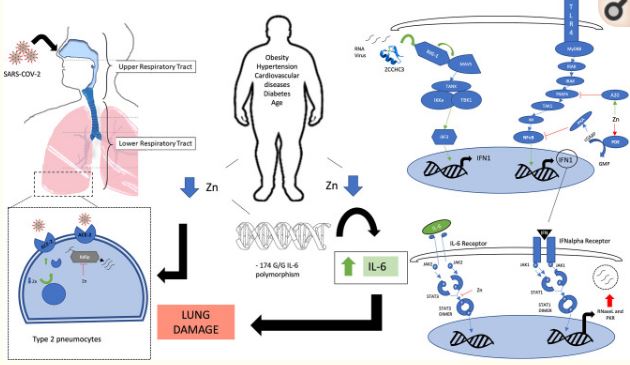
この論文の目的は、免疫系機能およびウイルス感染における亜鉛の役割、ならびにリスクの高い集団における亜鉛の欠乏の可能性についての推定される既存の証拠に基づき、COVID-19感染において亜鉛が果たすことができる重要な役割(図1に要約)を強調することである。

図1
凡例。様々なシグナル伝達経路における亜鉛の関与を示す模式図。緑の矢印:亜鉛を介した活性化。赤色のTバー矢印:亜鉛が介在する阻害。青色の矢印。活性化経路の流れ。肥満、心血管疾患、糖尿病、老化は亜鉛欠乏と関連している。-IL-6プロモーター遺伝子上の174 GG多型は、亜鉛によるホメオスタシス障害と肺障害の一因となるIL-6レベルの上昇と関連している。
亜鉛欠乏は、主に下気道を中心にSARS-COV-2に感染した2型肺炎球やその他の細胞におけるACE-2受容体活性を上昇させる可能性がある。亜鉛はRdRPを阻害し、ウイルスRNAの複製を阻害する。亜鉛指タンパク質ZCCHC3はウイルスRNAを感知し、RIG-1様受容体を介してカスケードを活性化し、その結果インターフェロン1型反応が増加する。
IFNタイプ1は、RNaseLやPKRなどの抗ウイルスタンパク質の合成を刺激する。亜鉛は、TRAF6下流の活性化を阻害するA20タンパク質を活性化し、PDEを阻害することにより、NF-κBを阻害するPKAを活性化するcGMPのレベルを増加させる結果となり、同じ種類の応答を調節するのに役立つ。
亜鉛はまた、STAT-3の二量体化を阻害し、IL-6受容体からの活性化したSTAT3シグナルを遮断する。
略語
ZCCHC3:ジンクフィンガーCCHCドメイン含有タンパク質3。RIG-1、レチノイン酸誘導性遺伝子I;MAVS、ミトコンドリア抗ウイルスシグナル伝達タンパク質;TANK、TRAFファミリーメンバー関連NF-κBアクチベーター;Iκkε、IκκBキナーゼε;TBK1、TANK結合キナーゼ1。IRF3、インターフェロン調節因子3;TLR、Toll様受容体;MyD88、骨髄分化一次応答蛋白質88;IRAK、インターロイキン-1受容体関連キナーゼ;TRAF-6、腫瘍壊死因子受容体関連因子6;TAK1。IKK、IκBキナーゼ;NFκB、核内因子κB;A20、亜鉛タンパク質;PDE、ホスホジエステラーゼ;cGMP、環状グアノシン一リン酸;GMP、グアノシン一リン酸;PKA、プロテインキナーゼA;INF-1、インターフェロン1型。JAK、ヤヌスキナーゼ;STAT、シグナル変換器および転写活性化因子;RNase L、リボヌクレアーゼL;PKR、RNA活性化プロテインキナーゼ;ACE-2、アンジオテンシン変換酵素2;RdRp、RNA依存性RNAポリメラーゼ。
亜鉛欠乏症は、世界の人口の最大17%に存在する可能性がある。特に高齢者は亜鉛欠乏とその悪影響のリスクが高い(33)。亜鉛の恒常性の障害は、糖尿病、肥満、心血管疾患などの代謝性疾患においても実証されている(34)。
ACE阻害薬、アンジオテンシン2受容体拮抗薬、サイアザイド系利尿薬など多くの降圧薬は亜鉛キレート剤である(35)。鉄やカルシウムも亜鉛の吸収を妨げる可能性がある(36)。米国食品栄養委員会は、成人男性に11mg/日、女性に8mg/日の摂取を推奨している(37)。カルシウムや鉄以外にも、フィチン酸塩、一部の食物繊維、リグニンなどの難消化性の植物性リガンドが亜鉛をキレートして吸収を阻害する。
血漿中亜鉛濃度の測定は、感度や特異性に限界があるにもかかわらず、亜鉛欠乏症の臨床検査として最も有用である(38)。また、血漿中の亜鉛濃度は、体内の恒常性により、食事からの摂取量が少なくても安定しており、欠乏が極めて長期化した場合にのみ血中で減少する(39)。
亜鉛を補充するための専用の貯蔵庫がないために、亜鉛の状態が悪くなると機能が障害される。恒常性は、細胞内の亜鉛濃度を一定に保ち、血漿中の亜鉛濃度を11~25μM(0.7~1.6mg/L)の基準範囲内に維持している(40)。
血漿中の亜鉛濃度が低い場合は、60mcg/dL未満(9.2μM未満)と定義されている(41)。亜鉛の摂取量が減少すると、最初はホメオスタシス機構により血漿中濃度が基準範囲内に維持されるが、欠乏が重度または長期化すると濃度が低下する。
しかし、血漿中亜鉛濃度は習慣的摂取量と適度に相関するが、亜鉛濃度は炎症性疾患状態や妊娠中に低下し、急性異化状態になると上昇するため、この検査の特異性にも限界がある(42)。軽度の疾患では、C反応性蛋白(CRP)レベルが15mg/Lの場合、亜鉛の10%の低下が観察される。重度の感染症では、CRP値が100~200mg/Lに達することがあり、亜鉛値の低下はさらに大きくなる(40~60%)(43)。
CRP値が正常であれば、血漿亜鉛測定の方が信頼性が高い。さらに、軽度の亜鉛欠乏症の患者では血漿中亜鉛濃度が正常である可能性があるため、この検査の感度には限界がある(44)。銅と亜鉛の比率は、亜鉛欠乏症の診断のための興味深いマーカーとなりうるが、後者は銅の吸収を増加させるからである(45)。信頼性を確保するためには、この比率は1.5以上でなければならない。
しかし、重症患者では、全身の炎症反応の影響を反映して銅のレベルが高い場合があり、実際のレベルを正確に表すことはできない(46)。亜鉛の栄養状態により敏感なマーカーは、アンジオテンシン変換酵素のApo/Holo活性の比である(47)。
亜鉛のレベルは好中球、リンパ球、または赤血球で測定することもできるが、これらのアッセイは一般的に感度が悪い(48, 49)。Ruz Mらは、実験的に制御された亜鉛枯渇中に血漿中濃度が変化しても、好中球中の亜鉛濃度は変化しないことを報告している(48)。
Metfahらは、リンパ球、顆粒球、血小板の亜鉛濃度が亜鉛欠乏後期にのみ有意に低下することを発見した(49)。興味深いことに、この研究では、亜鉛欠乏後期になっても血漿中の亜鉛濃度は変化しなかった。対照的に、彼らは、エクト-5′-ヌクレオチダーゼ(ほとんどの哺乳類細胞に存在する亜鉛依存性の不可欠な血漿酵素)の活性が、軽度の亜鉛欠乏期に有意に低下することを発見した。
好中球で測定した場合、亜鉛欠乏は、<42 mcg/1010細胞と定義される(49)。リンパ球で測定した場合、亜鉛欠乏は<50 mcg/1010細胞と定義される(49)。これらすべてを考慮に入れて、特に急性状態や軽度のグレードでは代表的ではないかもしれない、正常な基準レベルと比較して血漿中濃度が低いこと以外に、亜鉛欠乏のための信頼できる良い定義がないことを強調している。
免疫系経路における亜鉛の恒常性は複雑であり、亜鉛はプロ炎症性経路と調節性経路の両方に関与しており、多くのデータは前臨床試験管内試験(in vitro)研究から得られている。にもかかわらず、亜鉛の欠乏や過剰なレベルが適応免疫系や自然免疫系の機能不全につながることは明らかなようである。
亜鉛はリンパ球や他の白血球の増殖、分化、成熟、機能を制御する(6)。また、免疫反応を調節し、欠乏すると肺炎などの炎症性疾患や感染症にかかりやすくなる(50)。臨床試験では、硫酸亜鉛を20mg/日で5ヶ月間摂取すると、急性下気道感染症の罹患率がプラセボと比較して低下した(51)。
亜鉛は適応免疫系と自然免疫系の両方に不可欠である(52)。例えば、ウイルスや腫瘍に対する免疫反応を維持するために不可欠なナチュラルキラー(NK)細胞の機能は、亜鉛の低レベルによって影響を受ける(53)。さらに、亜鉛の補給は全血培養でのNK細胞数と生体内でのNK細胞活性を有意に増加させた(54、55)。
後者の研究では、血中亜鉛濃度が低いか、あるいは正常値に近い状態の被験者に亜鉛を補給すると、亜鉛イオンの濃度が上昇し、NK細胞活性が改善されただけでなく、血漿中のIL-6を調節することがわかった。亜鉛の恒常性は、リンパ球の形成とサイトカインの分泌に直接影響を与え、自然免疫系による刺激を間接的に変化させる(56)。
また、マクロファージにおける亜鉛の恒常性が制御されていないと、貪食が損なわれ、異常な炎症反応を引き起こすという証拠もある(57)。マウスを用いた研究では、亜鉛が欠乏した食事は、通常の食事で亜鉛を摂取した場合と比較して、農業用有機粉塵に曝露した後の気道炎症がより顕著になることと関連していた(58)。
これは、亜鉛欠乏環境に維持されたマクロファージが、NF-kB活性化の増加の結果、CXCL1およびIL-23産生の増加を示したことによって部分的に説明された。また、肺の亜鉛欠乏は、HIV-1感染が肺胞マクロファージの免疫機能を損ない、これらの個人における重度の肺感染を促進するメカニズムの一つである可能性がある(59)。
亜鉛はまた、ウイルスの認識にも役割を持っている。亜鉛指タンパク質ZCCHC3はRNAを結合し、RIG-IやMDA5などのレチノイン酸誘導性遺伝子-I(RIG-1)様受容体(RLR)を活性化することにより、細胞内RNAウイルスの検出を促進する(60)。この作用は、下流の抗ウイルス遺伝子の活性化によって媒介される抗ウイルス応答の活性化を引き金とする(61)。この過程で、TBK1 や IκK などのキナーゼは、インターフェロン調節転写因子 3 (IRF3) と NK-κB 阻害剤である IκB-αをさらにリン酸化し、IRF3 と NF-κB の活性化につながり、インターフェロンタイプ 1 のアップレギュレーションをもたらする (62, 63) (図 1 参照)。
インターフェロンα誘導シグナル伝達は、ウイルスRNAを分解し、その翻訳を阻害することが知られている抗ウイルスタンパク質(RNase LおよびPKR)のアップレギュレーションをもたらする(64)。亜鉛はまた、A20タンパク質の発現を介してNF-κBの活性化を抑制する効果を発揮する。A20は、腫瘍壊死因子受容体(TNFR)とトール様受容体(TLR)を介したNF-κB経路をネガティブに制御する亜鉛フィンガータンパク質である(65)。
さらに、亜鉛は環状ヌクレオチドホスホジエステラーゼ(PDE)の阻害剤として作用する。PDE が阻害されると、環状ヌクレオチド cGMP(環状グアノシン一リン酸)が上昇し、PKA(プロテインキナーゼ A)の活性化とそれに続く NF-κB の阻害をもたらする(66)。さらに、亜鉛の補給は、IL-1β、TNF-αの遺伝子発現を低下させ、NF-κBの活性化を阻害することにより、炎症性サイトカインをダウンレギュレートすることが示されている(67)。
栄養免疫とは、感染時に宿主生物が微量ミネラルを隔離し、病原体への利用が制限されるようにするプロセスである(1)。感染や炎症の間には、血清から臓器への亜鉛の一過性の移行があり、一時的に血清亜鉛濃度が低下するが、炎症反応が治まると正常化する(6、7)。このように、感染症への反応には十分な亜鉛のレベルが不可欠である。
亜鉛シグナルは、マウスの敗血症のポリ微生物モデルで示されているように、ZIP14による亜鉛の細胞内取り込みにより、敗血症の間、抗炎症反応を調節することにより、抗炎症的に作用する(68)。亜鉛欠乏は、マウスモデルにおける敗血症による炎症および死亡のリスク上昇と強く関連していた(69)。
この研究では、亜鉛欠乏の食事を与えられたマウスは、正常な食事を与えられたマウスと比較して血漿亜鉛濃度が50%低下しており、敗血症の文脈では生存率が10%と有意に低かった。上記の研究に基づいて、亜鉛の初期キレーションがインターフェロン1型(IFN-I)を媒介とした抗ウイルス反応の引き金になるという仮説が立てられる。
しかし、この反応を制御するためには、亜鉛の適切なレベルを確保する必要がある。なぜなら、亜鉛はこの経路の多くのポイントで阻害剤として参加しているからです(図1参照)。実際、SARS-CoV感染マウスを用いた研究では、早期のIFN-I反応が最適であることが示されている一方で、遅延したIFN-I反応はARDSと関連していることが示されている(70)。
IFN-1サブタイプは、SARSおよびMERSの治療のために、試験管内試験(in vitro)および生体内試験(in vivo)で、単独および他の抗ウイルス薬との併用で研究され、いくつかの有益な報告があったが、後にヒトでの転帰を改善することはできなかった(71-73)。にもかかわらず、SARS-CoV-2はIFNタイプ1に対してMERSやSARS-CoVよりも感受性が高いようであり、予防または治療としての使用も研究されている(74)。また、感染の初期段階で試験すべきであるという仮説もあるが、後期の抗IFNタイプ1治療は重症化した疾患の治療に有益である可能性がある(75)。
SARS-CoV-2感染が多数のIFN刺激遺伝子の発現を誘発し、これが不十分なIFN応答を誘発すると考えられるという証拠がある(76)。SARS-CoV-2のこの経路における亜鉛に関する具体的なデータはないが、亜鉛はIFN-α産生のアップレギュレーションとその抗ウイルス活性の増加を介して感染を制限する可能性がある(77、78)。後者の試験管内試験(in vitro)試験では、高齢者の白血球に15μMの亜鉛(生理的濃度)を補給したところ、若い被験者の白血球と同等の量のIFNが産生された。
私たちは、感染時の一過性の亜鉛欠乏は、亜鉛欠乏歴のある人の炎症亢進状態を引き起こす可能性があると仮説を立てました。また、亜鉛欠乏は味覚と嗅覚の喪失と関連しており、これは最近、このウイルスの感染に起因する症状である(79、80)。
私たちの考えでは、これは感染時に生じる一過性の急性亜鉛欠乏の結果である可能性がある。亜鉛欠乏は、味蕾細胞におけるタンパク質合成の低下、味蕾におけるアルカリホスファターゼ活性の低下、亜鉛含有唾液タンパク質の変化、味蕾の味孔領域の遮断、または中枢神経系の機能障害につながる可能性がある(81)。
IL-6は、SARS-CoV-2感染時の重篤な肺障害を誘発する上で重要であるように思われる。IL-6の持続的な上昇は、重度のCOVID-19患者に重なる可能性のあるマクロファージ活性化症候群(MAS)と同様に、重度の免疫介在性肺障害の引き金となると推測されている(82)。
このサイトカインストームが亜鉛レベルとどのように関連しているかについては、多くの証拠がある。第一に、IL-6はメタロチオネイン(MT)およびα-2-マクログロブリン(A2M)(両方とも亜鉛結合タンパク質)の発現を誘導し、亜鉛のバイオアベイラビリティを低下させる。
IL-6、MT、およびA2Mは加齢とともに増加し、亜鉛の利用可能性の低下は免疫産生に寄与する(83)。第二に、亜鉛は抗炎症要素として作用し、IL-6が介在するSTAT-3の活性化など、多くのプロ炎症性シグナル伝達経路をダウンレギュレートする(84)。
第三に、亜鉛欠乏高齢者では、IL-6産生が増加しているようである。さらに、食事中の亜鉛摂取量が少ない肥満患者では、亜鉛摂取量が多い患者と比較して、血漿および細胞内亜鉛濃度が低く、IL-1α、IL-1β、およびIL-6の遺伝子発現が上昇していることが示されている(85)。
この生体内試験(in vivo)試験では、10mgの純亜鉛補給は、健康な高齢者被験者の白血球からのIL-6放出を96.5%有意に減少させる結果となった。第四に、亜鉛の恒常性の低下に関連するIL-6遺伝子の多型が記載されている。位置-174にあるIL-6プロモーター遺伝子の一塩基多型(SNP)は、心血管疾患、アルツハイマー病、糖尿病、癌などのいくつかの加齢に関連した疾患で研究されている(86-88)。
亜鉛欠乏はTHP1細胞においてIL-6プロモーターの進行性脱メチル化を誘導し、これはIL-6発現の増加と相関している(89)。IL-6-174G/C遺伝子座における遺伝子変異は、IL-6産生および免疫応答の決定に関与している。
GG遺伝子型(C-と呼ばれる)を有する高齢者は、C+キャリアと比較して、より高いIL-6産生、障害されたK細胞の細胞毒性、MT遺伝子発現の増加、および低い亜鉛イオンの利用可能性のために、動脈硬化を発症するリスクが高い(90)。
例えば、65~85歳の高齢者では、C+多型はIL-6レベル0.88 pg/mlおよび亜鉛レベル82.2 μg/dlと関連していたのに対し、C-多型はIL-6レベル1.21 pg/mlおよび血漿亜鉛レベル77.5 μg/dlと関連しており、これらの差は統計学的に有意であった。
別の研究では、高齢者を対象とした生体内試験(in vivo)研究で示されたように、C+キャリアは、有意に高い血漿亜鉛レベル、低いMT産生、高い赤血球亜鉛レベル、および良好なNK細胞の細胞毒性を有していた(91)。
したがって、IL-6-174 GG多型を有する患者(C-キャリア)は、SARS-CoV-2による重篤な感染症を発症しやすく、その結果、亜鉛の恒常性の低下に関連したサイトカインストームを引き起こすIL-6レベルの上昇につながる可能性がある。
興味深いことに、この多型はイタリア(68.1%)やその他の地中海諸国の人々では、ドイツなどの北欧諸国(33.8%)と比較して2倍の頻度で見られる(91)。これは、3月21日現在、イタリアでは53,578人の確定症例と4,825人の死亡が確認されているのに対し、ドイツでは22,213人の症例と84人の死亡が確認されていることから、これらの国の死亡率の違いをある程度説明できるかもしれない(92)。
これまでのところ、ドイツの死亡率は5月初旬時点で4.10%とイタリア(13.61%)に比べて最も低くなっている。症例の早期発見と正確な隔離の違い、高齢者人口の割合の違いなど、他の要因も重要であった可能性が高い。
それにもかかわらず、COVID-19肺炎の発症や重症化の遺伝的感受性に関する研究が進められている(93、94)。パンデミックの病巣として知られている英国や米国などの他国では、この多型の有病率に関するデータはない。米国では約150万人の感染者がおり、86,000人以上が死亡しており、致死率は5.7%に達している(92)。
亜鉛はSAR-CoV RNAポリメラーゼを阻害する能力を示している(95)。Zn2+カチオン、特にZnイオノフォア・ピリチオンとの組み合わせは、SARS-CoV RNA依存性RNAポリメラーゼであるRdRPを阻害した。50μMの亜鉛レベルではRNA合成の50%以上の減少が観察されたが、500μMの亜鉛レベルでは5%未満の活性が維持された。
このことから、亜鉛はコロナウイルス疾患の抗ウイルス剤としての可能性があると考えられる。さらに、クロロキンおよびヒドロキシクロロキンは、他の特異的なメカニズムの中で、亜鉛イオノフォアとして作用し、亜鉛の細胞内への取り込みを促進するメカニズムであり、これらの化合物がウイルスの複製能力を阻害する効果を高める可能性がある(96、97)。
SARS-CoV-2およびSARS-CoVは、標的細胞に侵入するためにアンジオテンシン変換酵素2(ACE2)を必要とする。亜鉛への暴露は、ラット肺における組換えヒトACE-2活性を低下させた(98)。ACE-2 は亜鉛メタロペプチダーゼであり、活性部位で亜鉛結合ドメインとして機能する HEXXH モチーフを含む。
この試験管内試験(in vitro)試験では、100μMの亜鉛の存在下では、0または10μMの亜鉛と比較して、ラット肺およびrhACE-2において活性が有意に(p<0.05)減少した。1,000μMの亜鉛の存在下では、0、10および100μMの亜鉛と比較して、3つの調製物すべてにおいて活性がさらに低下した(p<0.05)。したがって、仮説的には、亜鉛欠乏は、ACE-2活性の増加により、SARS-CoV-2との結合を促進し、標的細胞のSARS-CoV-2感染を促進する可能性がある。
結論として、世界は新型コロナウイルスによるパンデミックに直面しており、一部の国では病気の負担が大きくなっている。この感染症は、肥満、高血圧、糖尿病などの様々な慢性合併症を持つ高齢者により深刻な影響を与えることが知られている。
亜鉛は免疫力の調節に関与することが知られている。このような状態に亜鉛が関与していると考えられる生物学的メカニズムが存在し、図1にまとめた。亜鉛の補給は、単独で、あるいは現在活発な感染症の治療に使用されている薬剤の補助剤として、感染時の重篤な免疫反応の調節における多くの重要な因子に効果があるため、有益である可能性がある。
亜鉛の補給は、COVID-19により重度の肺炎を発症した亜鉛欠乏症のリスクが高い人々のための新たな治療法となる可能性がある。亜鉛の状態や恒常性がSARS-CoV-2感染によって引き起こされる重症化の病態にどのように関与しているかをさらに調査するのに十分な証拠があり、臨床試験で積極的な治療法としての亜鉛の潜在的な役割が評価されるべきであると考えている。