Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8762167/
Front Genet. 2021; 12: 781597.
2022年1月3日オンライン公開

要旨
幹細胞は、再生能力と多方向の分化能を有し、疾患治療や基礎医学研究において重要な役割を担っている。尿由来幹細胞(USC)は、間葉系ストローマ細胞(MSC)と同様の生物学的特性(倍加時間、免疫表現型など)を持つ、新しく発見されたタイプの幹細胞である。
USCは非侵襲的であり、排尿から容易に取得でき、安定的に培養できる。この分野の進歩に基づき、USCとその分泌物はますます理想的な供給源として浮上してきている。USCは、細胞免疫系、酸化ストレス、血行再建、アポトーシス、オートファジーにおいて調節的な役割を果たすと考えられる。
本総説では、組織再生や様々な疾患治療におけるUSCの応用を要約している。さらに、その限界を分析することで、USCを用いた個別化治療を推進するため、より実現性の高い治療戦略の開発を期待する。
キーワード:尿由来幹細胞、多分化能、分子機構、疾患治療、創薬、組織工学
はじめに
胚性幹細胞(ESC)、成体幹細胞(ASC)、人工多能性幹細胞(iPSC)などの幹細胞は、組織の恒常性の維持や再生、組織の修復や反応の促進に関与するため、ますます研究のホットスポットとして浮上している(Daley, 2015; Dayem et al.)幹細胞研究において著しい進歩が見られるものの、ESCの応用は倫理的な問題や腫瘍形成の問題からまだ制限されている。それにもかかわらず、ASCsが徐々に注目を集めるようになったのは、疾患病原体に関する我々の理解を広げたからである。間葉系幹細胞(MSC)や造血系幹細胞(HSC)など、複数の種類のASCsが同定されている。中でもMSCは、ヒト骨髄(Bakerら、2015)、脂肪組織(Maziniら、2020)、尿(Liuら、2021)から分離可能な重要なタイプのASCである。骨髄由来間葉系幹細胞(BMSC)、脂肪組織由来幹細胞(ADSC)、尿由来幹細胞(USC)は、いずれも自己複製能と多方向分化能を有することが実証されており、機能性骨、筋肉、神経、内皮組織など対応する組織を再生する(Zhang et al.)ADSCs、BMSCs、USCの中でも、USCはより高い増殖率と血管形成能を示し、より優れた脂肪形成、筋原性、神経原性、内皮分化能を高い効率で有することが注目されており、さらに、USCの採取は有利に非侵襲的で安価である(Kangら、2015;Wuら、2018)。したがって、USCの研究は大きな価値を持つ可能性がある。
USCは、Zhangら(2008)によって初めて同定され、その自己応用は幹細胞研究における新たなブレークスルーを意味する。USCは、尿から分離したMSCsから強い増殖能力を示し、多方向の分化が可能である。圧倒的多数のASC(BMSCやADSCなど)が侵襲的で痛みを伴う採取手順を必要とする一方で、USCは遠心分離により尿から直接分離して培養液に植え付けることができ、シンプルで安価な非侵襲的手順となっており、ドナーにとって問題となり得る(Brown et al.、2019年)。また、テロメラーゼ活性が高く、テロメアが長いため、1つの細胞が2-3日で5-7個の細胞クローン/100ml尿を形成し、その後個別に多数のUSCに拡大することがわかった研究がある(Bharadwaj et al.、2013;Lang et al.、2013)。USCは、皮膚の再生や創傷治癒の促進、骨粗鬆症の減衰など、幅広く応用することができる(Chen et al.)さらに、USCは中胚葉分化能を有し、骨芽細胞(OB)または脂質形成細胞に分化することができる(Kimら、2020a)。USCは大きな可能性を秘めており、様々な組織の修復や臓器機能の維持のためにドナー特異的な自己細胞を産生することができ、それによって既存の治療法の欠点や不足を補うことができるのである。例えば、臓器不全患者に対する現在の治療法である薬物療法(Feng et al., 2020)や一時的な置換療法(Dalal, 2015)は、客観的な要因によって制限されている。特に臓器移植では、臓器の供給源が限られていることに加え、その後、免疫拒絶反応を防ぐために免疫抑制剤による長期治療が必要となるため、致命的な合併症を引き起こす可能性がある。さらに、自家組織移植は、免疫拒絶反応のない状態で利用されるのが一般的である。一般に、USCは臨床細胞治療において幅広い応用の可能性を持っている。
同様に、ほとんどの研究で、USCはパラクライン機構を介して治療効果を発揮することが示されており、それはエキソソームやマイクロベシクルなどの細胞外小胞(EVs)によって活性化される可能性があるとされている。Jiangらは、最初に約50~100nmの大きさの球状小胞を見つけた後、USCからエクソソームを抽出した(Jiangら、2016)。その後、Liuらは、これらのエクソソームが、成長因子(GF)およびトランスフォーミング成長因子-β1(TGF-β1)を産生することにより、血管新生を促進し、細胞の生存を促進する可能性を見出した(LiuおよびWu、2020年)。研究により、USC移植と比較して、USC-EV移植は同等またはそれ以上の治療効果があり、これらの細胞は元の細胞の免疫特権的な特性を有していることが示されている。さらに、USC-EVは保存・管理が容易であり、腫瘍形成のリスクも低い。USC-EV治療は、その有効性、利便性、安全性から、優れた戦略である(Basu and Ludlow, 2016)。さらに、USC由来の人工多能性幹細胞(USC-iPSC)が最近注目の研究トピックとなっている。これらの細胞は、多能性遺伝子SOX2、OCT4、NANOG、およびCRIPTO/TDGF1の高い発現によって示されるように、レトロウイルス、mRNAトランスフェクション、およびセンダイウイルスによって再プログラムされている(Wangら、2017a;Caoら、2018;Kimら、2020b)。これまで、USC-iPSCは、主に内分泌系(Guo et al., 2017a; Guo et al., 2017b)や消化器系(Niemietz et al., 2016)において、迅速に増殖し、収率が高く、免疫拒絶反応の少ない多くの細胞型に効率よく分化することが報告されている。さらに、USC-iPSCは、疾患細胞と同じ遺伝子を持つ細胞を無制限に提供する能力に基づいて、疾患モデルの確立に使用できる可能性がある(Fus-Kujawaら、2021年)。しかし、iPSCは遺伝的不安定性と自己複製能に特徴があり、特に未分化多能性幹細胞が体内で腫瘍を形成することが懸念されている。この問題に対し、Ben-Davidらは、ステアロイル-CoAデサチュラーゼ1を標的とする低分子の使用を提案した。この分子は未分化なiPSC/ESCの死を選択的に誘導することができ、安全性が向上した有効な治療戦略となる可能性がある。しかし、USC-iPSCを使用するリスクに関する現在の研究は限られており、今後の研究の焦点になる可能性がある(Ben-Davidら、2013年、Barrecaら、2020年)。将来的には、USC-iPSCを用いた治療がヒトに恩恵をもたらす可能性がある。
USCは、その生物学的特性が明らかにされて以来、容易に抽出できることが示され、強い増殖特性とin vitroでの多系統分化能を有する経済的で便利かつ安全な細胞源と見なされている。ここでは、USCに関する最新の研究成果や、様々な疾患に対する治療効果について紹介する。
USCの単離と培養
USCの抽出
USCは、通常の遠心分離によって単離され、不純物は徐々に除去された。Tayhanらは、健康な若年成人の尿を空気分離し、凍結保存したものが、新鮮なUSCの抽出に最適なサンプルであると述べている。初期の研究では、糖尿病患者からUSCを抽出できないと報告するものもあったが(Tayhanら、2017)、最新の研究では、確かにこれらの患者からうまく抽出できるものの、再生能力が著しく低下しているため、治療に使用できないことが確認されている(Xiongら、2019a)。そのため、適切なサンプル選択がUSC抽出の前提になる。適切なサンプルを採取した後、ペニシリンやストレプトマイシンを添加してコンタミネーションを低減させる。室温で、400×gで10分間遠心分離することで、USCを単離することができる。その後、上清を捨て、サンプルをPBSで2回洗浄し、再懸濁する。尿中には様々な種類の細胞が含まれているため、分離後に分離した成分を同定する必要がある。国際細胞治療学会(ISCT)では、以下のマーカーによってMSCを識別することを提案している。1) 細胞がプラスチック製の培養瓶に接着できること、2) 細胞集団の少なくとも95%が、CD105、CD73、CD90を含む特定の表面抗原を発現し、CD45、CD34、CD14、CD11b、CD79α、CD19、HLA-II抗原を発現しないこと、3) 適切な条件下でOB、軟骨芽細胞、脂肪細胞に分化できること(Dominici et al., 2006).USCはMSCの基準を満たしているため、単離されたUSCは、CD29、CD44、CD54、CD73、CD90、CD166、STRO-1などの類似した典型的な表面マーカーを発現することがある(Bharadwajら、2013; Liら、2020; Xiangら、2020)。さらに、周皮細胞(CD146)(Bharadwajら、2013)、上皮(E-カドヘリン、クローディン1、オクルディン)、線維芽細胞(ビメンチン、フィブロネクチン)、腎上皮(L1CAM、NR3C2)(Kimら、2020b)マーカーはUSCで発現している。
USCの培養
USCの培養に最も頻繁に用いられる培地は、ケラチノサイト無血清培地(KSFM、50μg/L塩基性線維芽細胞増殖因子、1%L-グルタミン、5μg/L上皮増殖因子、1%ペニシリン)と前駆細胞培養液(75% DMEM、25% F-12、10%牛胎仔血清、0. 4 mg/L コルチゾール、10 μg/L インスリン、5 μg/L トランスフェリン、2 × 10-9 mol/L トリヨードサイロニン、10 μg/L proepidermal growth factor、1.8 × 10-4 mol/L アデニン、1% ペニシリン、1% L-グルタミン)を用いた。USCは付着性で、通常5-7日目にクローンを形成し始め、10日目にコンフルエンスに達する(Langら、2013;Burdeyronら、2020)。ある研究では、新鮮な尿細胞クローニングの全体的な成功率は約83%であり、USCの平均人口倍加時間は46-49時間であると報告されている(Lang et al.、2013)。USCは需要が高く、供給が限られており、試験管内での培養条件の改善や培養期間の短縮などの戦略により、課題を改善することができる。例えば、Chunらは、染色体安定性と多系統分化能を維持しながら、採取したUSCの拡大を可能にする最適化アプローチとして、細胞外マトリックス(ECM)タンパク質(コラーゲンI型)と5%O2低酸素による再構成条件の使用を提案した(Chunら、2016)。ECMタンパク質であるゼラチンは、細胞培養皿のコーティング材料として使用された(Bharadwajら、2013)。最近の研究では、マトリゲル、フラボノイド、Y-27632(rho-associated protein kinase(ROCK)阻害剤)を活用することで、USCの分離効率、収量、コロニー形成能、分化能を促進できることが報告された。マトリゲル培養群は、ゼラチンコートシャーレ群に比べ、5日後のコロニー数が2〜3倍であった。また、Y-27632処理後14日間培養した細胞数は、ゼラチンコートシャーレで培養した細胞数と比較して約40倍に増加した。全体として、Y-27632とマトリゲルは、単離されたUSCの最も高い収率を提供した(Kimら、2020a)。細胞融合率が80-90%に達した時点で、2-3日おきに1:2または1:3の割合で継代した。第4世代および第10世代の細胞は小石のような形態を示すと報告され(Wu et al., 2018)、他の研究では石状(Kang et al., 2015)または粒状(Lang et al., 2013; Zhang et al., 2021)であると説明された。しかし、移植前に分化した細胞を大量に生産するためには、USCをin vitroで最大限に拡大する必要があることが多く、その結果、継代を繰り返すと細胞が老化してしまう(Halleyら、1988)。Kangらは、USCを24ウェルプレートに500cells/cm2の密度で播種し、継代回数の増加とともに増殖能力が徐々に低下することを見出した(Kang et al.、2015年)。Liuらは、in vitroの初期継代(≦p3)で使用した未分化USCを成長因子を含むhp-HAゲルと混合し、生体内に皮下移植したところ、生存率、生着能、血管・神経・筋原性分化能が向上した(Liuら、 2020a)。
USCの基礎的なメカニズム
免疫系を制御する
現在までに、いくつかの研究で、USCが免疫系の調節に影響を与えることが分かっている。Wuらは、培養USCにコスティミュレーション分子とMHC-IIマーカーがないことは、USCの免疫原性が低いため、レシピエントの免疫系による認識から逃れられることを示していることを発見した。また、USCをヒト末梢血単核細胞(PBMC)と共培養すると、免疫調節サイトカイン(IL-6やIL-8など)や免疫調節ケモカイン(MCP-1など)のUSC発現量が有意に増加することが分かった。サイトカイン(RANTES、GRO-α、GM-CSFなど)の分泌は、USCが良好な免疫調節特性を有することを示す(Wuら、2021年)。Zhouらは、フィトヘマグルチニン(PHA)で刺激したヒトCD4+ T細胞とUSCを共培養し、CD4+ T細胞の増殖が用量依存的に阻害され、IFN-γ、T-bet、IL-17AおよびRORCのmRNAレベルが著しく減少することを観察した。USCは、CD4+ T細胞の活性化およびTh1/Th17免疫反応を調節することができる(Zhouら、2020)。さらに、USCはミエロペルオキシダーゼ(MPO)活性と組織内のMPO+細胞数を減少させ、好中球の浸潤が減少していることを示している。そのため、デキストラン硫酸ナトリウムまたは2,4,6-トリニトロベンゼンスルホン酸で誘発した炎症性腸疾患モデルマウスでは、USCを投与すると炎症性因子の発現が著しく低下し、それによって炎症反応が抑えられ、マウスの生存率が改善した(Zhou et al.、2020年)。同様に、KangらはUSCをPBMCと共培養し、USCによって誘導されるPBMC増殖に対して用量依存的な抑制効果を観察した。リンパ球の増殖は、USCの数が増えるにつれてさらに抑制された(Kang et al., 2015)。さらに、Choiらは、USCのHLA(ヒト白血球抗原)-DRの発現量が低く、免疫原性が抑制されていることを見出した(Choiら、2017)。HLA-DRは、MHCクラスII細胞の表面受容体で、抗原の認識、提示、免疫応答、調節に重要な役割を担っている。クラスII HLAが発現しないことで、同種移植片は抗原提示免疫系細胞の認識から逃れることができ、したがって、基本的に免疫拒絶のリスクはなく、移植失敗、晩期拒絶、移植片対宿主病(GVHD)などの重度合併症は減少する(Choiら、2017; Kotら、2019)。上記の研究の結果はすべて、USCが免疫反応を負に制御し、この免疫調節作用が炎症を抑える効率的な方法であることを示唆している。その基礎となる様々なメカニズムを図1にまとめた。
図1 USCとその分泌物の制御機構
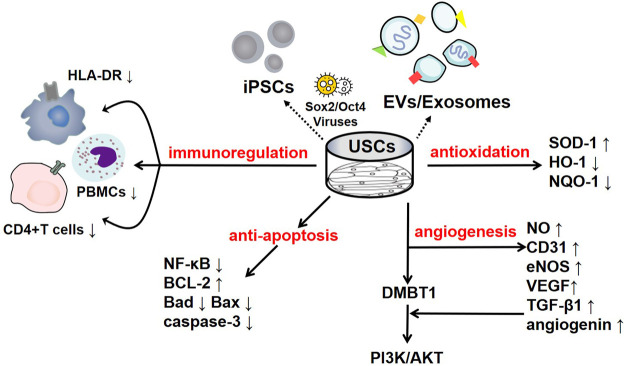
エキソソーム、細胞外小胞、USC-iPSCなどのUSCとその分泌物は、疾患病原体において重要な役割を担っている。USCは、負の免疫調節機能を発揮し、SOD-1レベルの上昇とHO-1レベルの低下によって示されるように、抗酸化剤として機能する。また、USCは、p62レベルの増加、LC3-IIとBeclin1レベルの減少によって特徴付けられるように、抗オートファジー効果を発揮する。さらに、USCは、VEGF、アンジオジェニン、PI3K/AKT経路の活性化を介して、血管新生を促進する。興味深いことに、アポトーシスに対するUSCの効果は、アポトーシス蛋白質Baxのレベルの増加と抗アポトーシス蛋白質Bcl-2のレベルの減少を示すことから、まだ議論のあるところである
酸化ストレスの調節
酸化ストレスは、がん、心血管疾患、神経障害、呼吸器疾患、腎臓疾患、慢性炎症、老化の促進など、さまざまな疾患を引き起こす有害なプロセスである(Pizzino et al.、2017)。刺激を受けると、体内では活性酸素種(ROS)や活性窒素種(RNS)などのフリーラジカルが多く生成され、酸化恒常性や抗酸化機構が乱れ、酸化ストレスにつながる(Pizzino et al.、2017年)。USCが体内の酸化ストレスの調節に及ぼす影響は非常に大きい。フリーラジカルによる組織損傷を抑制できるスーパーオキシドジスムターゼ(SOD-1)は、ミトコンドリア酸化活性の評価において重要な抗酸化物質と考えられており、マロンジアルデヒド(MDA)は酸化ストレスの重要なマーカーと考えられている(Marrocco et al.)Liらは、USC由来エクソソーム(USC-Exos)がSODの活性を高め、MDA含量を減少させることで酸化ストレスを低減し、ヒト腎皮質/近位尿細管細胞(HK2)を低酸素-再酸素化(H/R)誘発ダメージから保護することを発見した(Li et al.、2020)。Xiongらは、糖尿病性腎症(DN)モデルでUSCを処理すると、その増加がDNの進行を促進するニコチンアミドアデニンジヌクレオチドリン酸(NADPH)酸化酵素レベルの明らかなダウンレギュレーションにより腎線維化の進行が遅くなると報告した(Xiongら、2020年)。同様に、Zhangらは、慢性腎臓病(CKD)のUSC投与ラットでSOD-1のレベルが上昇していることを発見した(Zhangら、2020a)。さらに、USCの抗酸化作用は、間質性膀胱炎において観察されており、ヘムオキシゲナーゼ(HO)-1およびNADPHキニン酸化還元酵素(NQO)-1を含む酸化ストレス関連指標の顕著なレベル低下として現れる(Li et al.、2017年)。これまでの研究により、USCは細胞内の酸化ストレス障害を緩和し、腎臓疾患に対して一定の治療効果を発揮することが明らかになっている。
血管新生活性の増強
血管新生は、重度の虚血・低酸素にさらされた組織(創傷治癒、心筋虚血、脳虚血、癌など)の修復・再生に関わる重要なプロセスであり、内皮細胞(EC)の増殖と移動が介在する(Kargozarら、2020年)。血行再建療法を受けるまでの時間が長くなると、内皮機能障害のリスクが顕著に上昇する。したがって、迅速な再灌流療法の臨床的検討は、患者の予後を改善するための優れたアプローチである。
内皮マーカーとして、CD31は血管の密度を評価するために広く用いられている。Zhaoらは、USC移植後に低用量ストレプトゾトシン(MLD-STZ)で治療したマウスの膵島でCD31レベルが劇的に上昇することを発見し、USCが膵島構造の再構築に役立つことを示している(Zhaoら、2018年)。さらに、miR-10、miR-21、およびmiR-30などのUSCによって提供される血管新生マイクロRNAは、CD31および内皮一酸化窒素合成酵素(eNOS)の発現増強によって示されるように、糖尿病勃起不全(DED)のラットの血管新生増殖に関与することがわかっている(Ouyang et al.、2019年)。USC-ポリカプロラクトン/ゼラチン処理した創傷では、微小血管密度がコントロールと比較して増加し、この刺激効果は血管内皮増殖因子(VEGF)およびTGF-β1によって促され、USCによって放出されるパラクリン因子が血管新生において重要な役割を果たすという説得力のある証拠が提供された(Fu et al.、2014年)。Jiangらは、USC-ExosがVEGF、TGF-β1、およびアンジオジェニンの発現レベルを増加させることによって血管新生を促進し得ると結論付けた(Jiangら、2016年)。同様に、USC-Exosではdeleted in malignant brain tumour 1(DMBT1)タンパク質が濃縮されており、DMBT1はVEGF、一酸化窒素(NO)およびアンジオジェニンの分泌を増加させることによってPI3K/ACT経路を活性化する血管新生のプロモーターとして機能することが証明されている(Karar and Maity, 2011; Chen et al.,2018a)。Chenらは、ヒト微小血管内皮細胞をUSC-Exosに曝露すると、線維芽細胞や毛細血管様構造の塊などの創傷治癒関連細胞の増殖が活性化すること、DMBT1の発現を抑制すると、VEGF-AとAktリン酸化の低レベルによって明示されるようにUSC-Exosの機能が顕著に抑制されることを示している(Chen et al.、2018a)。このように、USCは明らかに血管新生に関与している。
アポトーシスを制御する
アポトーシスは、ホメオスタシスを維持し、規則的な細胞周期を制御するために、明確なアポトーシス小体の形成を伴うプログラムされた細胞死プロセスである。しかし、過剰なアポトーシスは、組織機能をさらに損ない、その結果、より深刻な病態を引き起こす可能性がある(Xu et al.、2019)。したがって、アポトーシスを抑制することは、損なわれた組織を救済することとみなされる。NF-κB経路やBax/Bcl-2経路などの複数のシグナル伝達経路や、切断型カスパーゼ3やメタロプロテアーゼ1(TIMP1)などのアポトーシス関連タンパク質が関与している。
Bcl-2/Bax 経路は、内因性アポトーシス経路の重要な構成要素である。アポトーシス経路が活性化された後、細胞はプロアポトーシス蛋白質Baxを発現してチトクロムC(Cyt C)の細胞質への放出を促進し、これがカスパーゼカスケードを開始してアポトーシスに至るのである。Sunらは、急性腎不全(AKI)モデルにおいて、USCがプロアポトーシス蛋白であるBaxとカスパーゼ3の発現を低下させ、アンチアポトーシス蛋白であるBcl-2の発現を上昇させることを強調した。対照群のものと比較して、シスプラチンによって誘導されたNRK-52E細胞の腎機能および組織学的損傷が有意に改善され、腎尿細管上皮細胞の増殖が有意に増加した(Sun et al, 2019)。同様に、間質性膀胱炎モデルにおいて、USCによる治療は、カスパーゼ-3とBaxのレベルを著しく低下させ、Bcl-2のレベルを顕著に上昇させることによってアポトーシスレベルを低下させ、アポトーシス核はより少なく観察された(Li et al.)さらに、コンドロイチナーゼABC(chABC)と組み合わせたUSCは、脊髄損傷のラットに投与すると、高いBaxと低いBcl-2レベルを持つ神経細胞のアポトーシスを抑制できる(Li and Wu,2017).ChABCは、コンドロイチン硫酸プロテオグリカンのグリコサミノグリカン側鎖を分解して機能し、グリア瘢痕再生の阻害を改善する。
USCとその分泌物は、アポトーシスの制御に関与している。Jiangらは、高グルコースにさらされた後、糖尿病ラットのポドサイトおよび尿細管上皮細胞が損傷を受け、カスパーゼ3を過剰発現することを発見した。それにもかかわらず、USC-Exosはカスパーゼ3の過剰発現を抑制し、アポトーシスを阻害することによってポドサイトおよび腎尿細管上皮細胞を保護した(Jiangら、2016年)。さらに重要なことに、これらの著者らは、フォローアップ実験で、ヒトポドサイトのアポトーシスを改善するUSC-Exosの役割を確認した(Xiongら、2020年)。TIMP1は、マトリックスメタロプロテアーゼ(MMP)の天然阻害剤である。組換えヒトTIMP1タンパク質は、PI3KおよびJNKシグナル伝達経路を活性化することにより、アポトーシスを抑制した。Chenらは、TIMP1がUSC-EVに高度に濃縮されており、OBと内皮細胞の抗アポトーシス作用を増強し、その結果、保護的な役割を果たすことを発見した(Guoら、2006;Chenら、2020)。さらに、USC-Exosによって送達されたmiR-146a-5pは、翻訳後発現を介してインターロイキン-1受容体関連キナーゼ1(IRAK1)の発現を阻害し、NF-κB P65核局在を著しく減少させて、IRAK1-INF-κBシグナル経路を阻害すると報告された(Li et al., 2020)。同様に、USC-Exosで運ばれた豊富なmiR-216a-5pは、ヒト近位尿細管上皮細胞(HK-2)に移行し、ホスファターゼおよびテンシンホモログ(PTEN)のサイレンシングおよびAktリン酸化の活性化をさらに促進し、それによってHK-2細胞をアポトーシスから保護することが示された(Zhang et al.、2020年b)。様々な基礎的なメカニズムは、図1にまとめられている。
USCの応用例
腎臓疾患
慢性腎臓病
腎臓病とその合併症は、高い入院率や生活の質の低下につながる重要な要因とされ、患者に大きな負担を与えている。CKDの世界有病率は11~13%、世界死亡率は4.6%を占め、CKDは2017年の死因の第12位であった(Hill et al.2016; GBD Chronic Kidney Disease Collaboration, 2020)。腎臓組織特異的幹細胞であるUSCは、腎臓組織の修復に最適であると考えられ、CKDの治療法として期待されている。Zhangらは、USCの移植が、その強い増殖能とフィブリンマトリックス形成を抑え、腎臓の炎症を抑制する能力により、ラットCKDモデルにおいてネフロン数を保護し、腎機能を有意に改善することを見いだした。したがって、USCは臨床において腎機能を改善し、CKDによる組織構造の損傷を防ぐ可能性がある(Zhang et al., 2020a)。
腎再生
血液透析のコストが高く、腎臓の供給源が不足しているため、腎再生は腎不全の治療の可能性と有効な手段であると考えられている。しかし、腎臓は再生が最も困難な臓器の一つであり、これまでの幹細胞戦略も失敗している。そこで、腎臓由来で入手が容易で安全なことから、研究者はUSCが腎臓の組織再生を促進できるかどうかを明らかにしようと試みてきた。
そこで、USCが腎臓組織の修復に積極的な役割を果たすことを確認したが、腎臓組織を再生する能力については疑問が残る。Choiらは、ヒト腎臓分化培地を2週間使用したところ、幹細胞マーカー(SSEA4)の発現が減少し、腎臓系統特異的マーカー(PAX2、WT1、Cadherin-6)の発現が増加したことから、USCが有意に腎臓細胞系統の分化能を持っていることが示唆されたと述べている。また、USCはVEGFやPDGF-BBなどの成長因子を分泌することができ、組織学的異常を誘発しないことから、生体内での安全性が示唆された。したがって、USCは腎臓のスペクトラム分化能に優れ、入手しやすく、安全性が高いことから、腎臓再生の有望な治療法となる可能性がある。しかし、in vitro実験の限界から、腎臓組織様の形態は観察されておらず、その後のin vivo実験による確認が必要であり、今後の研究の焦点となる。このように、現在までのところ、腎組織再生におけるUSCの有用性は実証されていない(Choi et al.、2017)。
急性腎不全
AKIは、尿細管損傷と急激な腎機能低下を特徴とする重要な臨床疾患である。現時点では、完全に回復する方法はない(Guo et al.、2019)。AKIは入院患者の約20%に発生し、腎移植を行わなければ死亡率が50%に達することもある(Levey and James, 2017)。したがって、代替療法は、AKI患者の治療と予後を改善するための鍵となる。研究により、USCは腎臓の炎症を抑制し、腎機能および組織学的損傷を有意に改善できることが示されており、AKIの治療における可能性を示唆し、新たな臨床治療戦略を表している。Tianらは虚血性AKIのラットモデルを作成し、USC投与群では抗炎症因子(IL-10およびTGF-β1)の発現レベルが上昇し、炎症性因子(INF-γおよびIL-1β)の発現レベルが低下したことを見出し、USCが優れた抗炎症効果を発揮することを示した(Tianら、2017)。Sunらは、USCがシスプラチン誘発AKIモデルにおける腎機能障害を緩和し、それは血中尿素窒素(BUN)および血清クレアチニン(SCr)レベルの低下、組織学および超微細構造の改善によって示されると結論づけた。In vitroでは、シスプラチン誘発NRK-52E細胞とUSCを共培養し、対照群の細胞よりも高い生存率と低いアポトーシス率を示した(Sun et al.、2019)。
糖尿病性腎症DNは、特にDN患者の数が2025年までに30億人に達すると予想されていることから、末期腎疾患の主な原因として浮上している(Xiongら、2020年)。研究により、USCはDN患者のポドサイトを保護し、腎組織の線維化を改善しながらアポトーシスを抑制することができることが示されている。Jiangらは、STZ誘発ラットモデルを調査し、その尿量と尿中アルブミン濃度の著しい増加、メサンギウムの膨張の緩和、骨形成タンパク質7(BMP-7)などのポドサイトの生存因子の発現のダウンレギュレーションを見いだした。一方、USC-Exosを投与するとこれらの作用が著しく減弱したことから、USC-Exosはポドサイトおよび内皮細胞の生存に非常に重要であることが示された(Jiangら、2016)。その後、Duanらは、ポドサイト表面マーカータンパク質であるネフリンのアップレギュレーション、糸球体平滑筋特異的タンパク質(α-SMA)およびアポトーシスタンパク質(BaxおよびCaspase-3)のダウンレギュレーションによって示されるように、USC-Exosは、高グルコース誘発VEGF-Aの発現を抑制して、ポドサイトのアポトーシスを阻害するmicroRNA-16-5pを分泌できると提唱した。さらに、USC-Exosの静脈内注射後にmicroRNA-16-5pが過剰発現し、糖尿病ラットモデルでポドサイトを保護した可能性がある(Duanら、2019年)。さらに、Xiongらは、BUNおよびSCrレベルの顕著な低下、腎組織の線維性過形成の改善、およびα-SMAの発現低下によって示されるように、USCが腎間質線維化から保護し、腎保護効果を有することを観察した(Xiongら、2020年)。
膀胱の病気
膀胱再建
感染症、癌、外傷、炎症、異所性損傷はすべて膀胱機能不全を引き起こし、尿を効果的に貯めたり空にしたりする能力が低下する。根治的膀胱切除術後の尿道再建の最良の方法は回腸膀胱形成術または新膀胱である(Serrano-Arocaら、2018年)。しかし、消化管組織などを用いた膀胱再建は、代謝異常や慢性尿路感染症などの一連の後遺症や合併症を生じ、患者のQOLに大きな影響を与えるため、膀胱再建は依然として困難である。そのため、組織工学は膀胱再建の代替法として期待されているが、現状では臨床で利用できるものではなく、さらなる検討が必要である。
Leeらは、塩基性線維芽細胞増殖因子(bFGF)の特性(間葉系細胞の増殖とECMの産生に好ましい微小環境を提供する)を利用して、ラット部分膀胱切除モデルを研究し、USCとヘパリン固定化bFGF負荷スキャフォールドの相乗効果を見出し、膀胱容量の増加、コンプライアンス、または炎症と組織の再生が低下することによって実証されたという。これらの著者らは、この新規複合バイオマテリアルは膀胱再建のための有望な治療戦略を表し、損傷組織の構造的および機能的修復の可能性を提供するが、血管形成および神経化などの問題が残っており、臨床適用前に解決しなければならないと提案した(Lee et al.、2015)。Liらは、プロタミン/リポポリサッカライド誘発間質性膀胱炎の雌ラットを用いた実験を行い、USCが酸化ストレス、炎症反応、アポトーシスを抑制し、膀胱機能再建の修復効果を持つことを明らかにした(Li et al., 2017)。IC対照群の膀胱ではIL-6やTNFαの低下、肥満細胞浸潤の減少などの炎症関連因子が観察されたが、IC+USC群では顕著に改善された。間質性膀胱炎など、ヒトの疾患を完全に再現できる誘導ラットモデルではないが、これらの知見は前向きな臨床試験の確かな根拠となる。
過活動膀胱と低活動膀胱 尿意切迫感や頻回の夜間頻尿として現れる過活動膀胱(OAB)は、侵襲的なボツリヌス毒素や神経調節・再建手術で治療することが多い(Robinson and Cardozo, 2019)。大コンダクタンス電圧およびCa2+活性化K+(BK)チャネルは、膜を過分極することによって性的興奮性および膀胱平滑筋の収縮力を低減する有効性に基づいて、OABの優れた治療候補として注目されている(Li et al.、2019年)。興味深いことに、幹細胞は、細胞増殖に関与すると考えられる多種多様なイオンチャネルを有している。Wangらは、USCにおけるBKチャネルの過剰発現が、細胞増殖(G1/S期)およびアポトーシスを調節することができると提案した。これらの著者らは、BKチャネルアンタゴニストのイベリオトキシンを適用すると、USCのアポトーシス率が上昇し、一方、BKアゴニストのNS1619で処理すると減少が観察された(Wang et al.、2017b)。これらの結果は確かに刺激的ではあるが、in vitroの実験では、必ずしもOABモデルでの模擬実験と同じ効果を明らかにしたわけではない。したがって、彼らの研究は、USCに対するBKチャネルの効果のみを検証したものであり、USCの相互作用に関する実験データは不足している。また、USCがBKチャネルの効果を高める「ベクター」として機能し、その結果、OABの治療法として有用であるかどうかは、まだ不明である。
興味深いことに、過活動膀胱(UAB)に対するUSCの作用が研究されている。UABは、膀胱出口閉塞やストレス性尿失禁(SUI)などの重篤な合併症を伴う複雑な泌尿器科疾患である。泌尿器系のペースメーカー細胞である間質性カハール様細胞(ICC-LC)は、UABにおいて減少傾向を示しており(Fengら、2017)、したがって、自然小胞収縮を満足に調整する理想的な治療として浮上してきた(Liuら、2017a; Koら、2017)。外来遺伝子過分極活性化環状ヌクレオチドゲート(HCN4)修飾を有するレンチウイルスベクターをトランスフェクトすることによって、SunらはUSCのICC-LCへの方向性分化を非効率的に誘導し、「米粒」様細胞から複数の枝を有する紡錘形細胞への形態変化、ICC表面マーカーc-Kitの高い発現、可視自動分極電流がもたらされるようになった。このように、HCN4の過剰発現は、USCにおいてICC-LC様の表現型を予備的に作り出した。さらなる研究により、UABの治療において成功したUSC分化の機能が明らかになる可能性がある(Sunら、2020)。
尿道疾患
ストレス性尿失禁
尿失禁(UI)とは、不随意に尿道から尿が漏れてしまうことだ。UIの中で最も一般的なSUIは、尿道括約筋や骨盤底筋の機能障害によって不随意に尿が失われることで起こる。SUIの有病率は、50歳以上の女性で10~40%である(Capobiancoら、2018年)。
USC、マイクロビーズ、およびコラーゲンゲルタイプ1の混合物をマウスに注入した後、筋原分化能の改善、および血行再建、神経支配、および組織再生の強化が観察され、SUIにおけるこの戦略の活用の可能性を強調した(Liu et al.、2013年)。膣バルーン膨張によるSUIラットモデルを確立することにより、Wuらは、ウロダイナミックパラメータの改善、恥骨筋組織の回復、および細胞外調節タンパク質キナーゼのリン酸化による筋衛星細胞の増殖および分化の活性化によって示されるように、USC-ExosがSUI治療に役割を果たすことを発見した(Wuら、2019年)。したがって、USCはSUIに対する新しい実現可能な治療法である可能性があり、さらなる探求が望まれる。
尿路再建
尿の毒性作用は、通常膀胱生検で得られる尿路上皮細胞で分離することができ、これは侵襲的でドナーにダメージを与える可能性がある。しかし、現代の研究では、非侵襲的で無制限なUSCの性質が、非侵襲的な尿路再建に果たす役割の可能性を示している。したがって、USC由来の内皮細胞、尿路上皮、機能的平滑筋細胞は、それぞれ尿路粘膜、尿道壁、血管の確立に使用できる(Abbasら、2020年)。
Zhaoらはまず、血管基底膜と間質ECMの両方からなり、微多孔性播種細胞構造として機能する血管細胞外マトリックス(VECM)を改良した手法で作製し、VEGFと類似するその形質から、VECMが血管新生に関与する可能性が高いことを明らかにした。そして、TGF-β1やmiR-199a-5pなどの因子を含む誘導培地を用いて、USCを尿路上皮型および機能的収縮性平滑筋型に分化させた。最後に、これらの細胞とVECMを組み合わせ、2ヶ月後のラット尿道欠損モデルにおいて、対照群が不連続な上皮細胞の1層と少数の平滑筋束しか示さなかったのに対し、無傷で多層の尿路上皮とラメラ密結合平滑筋を構築することに成功した。このような再生尿管の引張強度および破断強度が満足できるものであれば、組織工学的移植片は将来的に長節尿管欠損の治療に適用されるかもしれない(Zhaoら、2019年)。Liuらは、ウサギの尿道欠損モデルの小腸粘膜下層(SIS)にUSCを播種し、対照群ウサギ(SISのみを受け取り、USCを受け取らない)と比較して、これらのウサギは尿道口径の改善、尿路上皮再生速度の増加、平滑筋含有量の増加、および血管密度の増加を示した(Liuら、2017年b)。Wanらは、6人の健康な成人から得たUSCを尿路上皮細胞に分化させることに成功し、得られた細胞は、表現型的にネイティブな尿路上皮と同等であり、機能的には、そのバリア機能と超微細構造に基づくタイトジャンクションと同等であった(Wan et al.,2018)。同様に、Yangらは、PDGF-BBおよびTGF-β1に予め暴露したウサギUSCを、上皮成長因子(EGF)に暴露することにより、α-SMAを発現する平滑筋細胞のみならず、AE1/AE3およびE-cadherinなどの尿路上皮特異的タンパク質を発現する尿路上皮細胞にも分化させた(Yang et al.、2018年)。本論文の著者らはさらなる実験を行わなかったが、USCによって効率的に分化したこれら2種類の細胞は、下部尿路の組織再生に利用できると考える理由がある。
糖尿病
糖尿病は、膵臓β細胞の破壊とインスリン抵抗性を特徴とし、死因の第9位としてよく知られている。2018年に約4億5100万人が糖尿病と診断され、500万人がその複数の併存疾患により死亡している。”また、2018年以降500万人がその複数の併存疾患により死亡している(Amanat et al., 2020; Lu and Zhao, 2020)。”。膵島移植や膵臓β細胞の置換は実用的な治癒戦略として機能するかもしれないが、既存のデータはUSCの適用性を支持し、糖尿病の治療のための新たな戦略としている。
研究では、単離されたUSCがインスリン産生β細胞に分化し(Hwangら、2019)、その生存と膵島血管新生を促進する(Zhaoら、2018)ことが確認されており、これは糖尿病の治療に適している。USCはインスリン産生細胞に変化し、インスリンとグルカゴンのmRNAとタンパク質を発現し、グルコース刺激に応答してインスリンを分泌することができる。その比較的豊富な供給源のため、USCから分化した機能的なインスリン産生細胞を再構築することは、臓器移植を行うよりも優れている(Hwangら、2019年)。したがって、USC移植により膵島血管が再生された後、MLD-STZ投与マウスでは耐糖能および膵島形態の改善とインスリン含量の向上が観察され、USCが膵島の再血行再建を促進することによりβ細胞の生存に寄与することが推察される。さらに、高用量のSTZを投与したUSC投与マウスでは、血糖値の改善が観察された(Zhaoら、2018)。意外なことに、Dongらは、USCの尾静脈注射を週6回行っても、II型糖尿病ラットの空腹時グルコース値を顕著に低下させないことを示した(Dongら、2016)。同様に、Ouyangらは、糖尿病性EDに対する効果を調べるためにUSCをスポンジに1回注射した後、USCは血糖値に大きな影響を及ぼさないことを発見した(Ouyangら、2014年)。USCを調査した他の研究では、糖尿病動物の耐糖能が改善されたことを考えると、これらの結果は矛盾しているように思われる。様々なアプローチの中でも、USCの膵臓内注射は最も効率的なアプローチである可能性があり、静脈内注射は肺毛細血管に捕捉されるリスクがあるため血糖値の改善効果は限定的である(Dongら、2016年)。いくつかの推測を経て、相反するデータから、注射の量と経路が治療に重要な役割を果たすことが示された。
糖尿病の合併症は、糖尿病性心筋症、腎臓病、神経障害、網膜症、膀胱病など、深刻な問題であり、生命を脅かすことさえある(Cole and Florez, 2020)。USCは多方向の分化とパラクライン機能により、糖尿病による他の組織の喪失を抑える効果があると考えられている。Dongらは、USCをラットに注射したところ、膵臓と腎臓に少量のUSCが見つかっただけで、心臓と膀胱にはUSCが観察されなかったという。さらに、これらの著者らは、USCがパラクリンシグナル機構を介して細胞のアポトーシスを抑制し、線維化指数を低下させ、それによって左心室機能および心筋リモデリングを改善し、糸球体機能を救済し、解離性収縮力を増加させると結論付けた(Dong et al, 2016)。まとめると、USCは糖尿病とその合併症の治療のための有望な新しい実現可能な戦略である可能性がある。
消化器系疾患
細胞ベースの治療法である肝細胞移植(HCT)は、適切なドナーがいない患者の先天性代謝疾患や急性および慢性肝不全の治療に用いることができる(Anderson and Zarrinpar, 2018)。Huらは、少数のUSCが肝前駆細胞との同時培養後に肝細胞に分化することを見出し、USCがHCTのための代替自己幹細胞源となり得ることを示した(Huら、2020年)。さらに、急性肝損傷モデルへのUSCの移植は、アラニンアミノトランスフェラーゼ(ALT)やアスパラギン酸アミノトランスフェラーゼ(AST)などの血清マーカーレベルを改善し、病的変化を一部改善したことから、USCは急性肝損傷後の肝機能を一部回復できることを示している(Hu et al.、2020年)。低酸素のプレコンディショニング戦略は、生体内の移植細胞の適応に影響を与える可能性がある。低酸素前処理後、慢性肝線維化マウスモデルにおいて、オートファジーの誘導によりUSCの肝臓回復効率がわずかに向上することが報告されている(Hu et al.、2020)。また、低酸素前処理後のUSCではC-X-Cモチーフケモカイン(CXC)受容体4(CXCR4)の発現が著しく上昇し、その後、損傷肝組織に高レベルで発現する(CXC)リガンド12(CXCL12)(細胞輸送とホーミングに重要なケモカイン)と相互作用し、USCの増殖、コロニー形成、移動を促進する(Hu et al., 2021)。さらに、低酸素前処理後にUSCと肝細胞の細胞融合率が上昇し、これらの多血性幹細胞は肝臓再生に関与している可能性がある(Hu et al., 2021)。これらの知見はすべて、末期肝疾患患者におけるUSCの治療効果向上における低酸素プレコンディショニングの価値を確認するものである。
消化器系におけるUSCを調査する研究は限られているが、既存の研究に基づいて、そのメカニズムを合理的に推論することができる。上述したように、USCは負の免疫制御に関与することができる。消化管は人体最大の免疫器官であり、多数の免疫細胞、腸内細菌およびその代謝産物が存在し、免疫恒常性を変化させることがよく知られている。一方、腸内フローラの変化は、このバランスを崩し、一連の炎症反応を引き起こす(Pickardら、2017)。したがって、USCがクローン病や潰瘍性大腸炎などの炎症性腸疾患の治療に無視できない役割を果たすと考えるのは妥当なことだ。さらに、USCは血管新生に非常に重要である。したがって、動脈硬化を有する高齢者に多く見られる腸間膜動脈狭窄または閉塞による腸壁虚血に基づく血管リモデリングによって、虚血性腸疾患が根本的に治癒する可能性がある。これらの仮説を検証するためには、さらに多くの実験が必要である(Table 1)。
表1 身体システムの様々な疾患に対するUSCベースの治療法
| 病気について | モデル | メカニズム | 観察記録 | |
|---|---|---|---|---|
| 腎臓疾患 | 慢性腎臓病 | 慢性腎臓病(CKD)モデルラット | 抗酸化ストレスと抗線維化活性 | 糸球体硬化と萎縮性尿細管が減少し、SCrとGFRが改善したZhangら(2020a)。 |
| 腎臓移植 | ユーエスシー | SSEA4レベルの低下と腎臓分化関連マーカーの漸増。 | 腎臓細胞系列分化能の評価Choiら(2017年) | |
| 急性腎不全 | 虚血性AKIモデルラット | USCベースの治療 | インターロイキン-10とTGF-β1のレベルが上昇し、インターフェロン-γとIL-1βのレベルが低下Tian et al. | |
| シスプラチンによるAKIモデル | USC処理(in vivo);シスプラチン誘導NRK-52E細胞とUSCの共培養(in vitro)。 | BUNおよびSCr値の低下、in vitroでの高い細胞生存率および低いアポトーシスSunら(2019) | ||
| 糖尿病性腎症 | STZ誘発ラットモデル | USC-Exo処理 | 尿量とアルブミンの増加、ポドサイト生存因子BMP-7のダウンレギュレーションJiangら(2016) | |
| USC-Exosで処理したポドサイト | USC-ExosとmicroRNA-16-5pの相乗効果 | VEGFAを介してポッドサイトを保護するDuanら(2019年) | ||
| 腎臓組織 | USC-targeted治療 | BUNとSCrの低下、線維性過形成の改善、α-SMAの発現低下Xiongら(2020) | ||
| 膀胱の病気 | 膀胱の再建 | 膀胱部分切除ラットモデル | ヘパリン固定化塩基性線維芽細胞増殖因子担持スキャフォールド | 膀胱容量、コンプライアンスの上昇、または炎症と組織再生の減少Leeら(2015)。 |
| 過活動膀胱 | USCにおける大コンダクタンス電圧とCa2+活性化K+ (BK)チャネル | USCにおけるBKチャネルの過剰発現 | BKチャネルアンタゴニストのイベリオトキシンはUSCのアポトーシスを増加させ、USCのアポトーシスはBKアゴニストのNS1619による処理で減少したWangら(2017b) | |
| 膀胱の機能低下 | USCのICC-LC様表現型の予備知識 | 外因性遺伝子修飾を施したレンチウイルスベクターのトランスフェクションによるUSCのICC-LCへの分化 | c-Kitの高発現、自動脱分極電流Sunら(2020) | |
| 尿路系疾患 | ストレス性尿失禁 | マウス | USC、マイクロビーズ、コラーゲンゲルタイプ1の注入 | 筋分化の促進、血管新生と神経支配の強化、組織再生Liu et al. |
| SUIラットモデル | USC-Exosをリン酸化した細胞外制御タンパク質キナーゼで処理する | ウロダイナミクスパラメータの改善、恥骨筋組織の回復Wuら(2019年) | ||
| 尿路再建 | USC;組織工学的移植片 | TGF-β1やmiR-199a-5pなどの成分を含む培地を誘導する。 | USCの尿路上皮および機能的収縮性平滑筋への分化Zhaoら(2019)。 | |
| 尿道欠損ウサギモデル | 小腸粘膜下層へのUSCの播種 | 尿道口径の改善、尿路上皮再生の促進、平滑筋量の増加Liuら(2017b) | ||
| 健康な成人から採取したUSC | USCの尿路上皮細胞への分化誘導 | 表現型的にも機能的にもネイティブな尿膜に匹敵する構造Wanら(2018) | ||
| ウサギのUSC | PDGF-BBおよびTGF-β1への曝露 | α-SMA、尿路上皮特異的タンパク質(AE1/AE3、E-カドヘリン)の高発現Yangら(2018)。 | ||
| 糖尿病 | ユーエスシー | インスリン産生細胞への変換 | 膵臓の転写因子Pdx1、インスリン、グルカゴンのmRNAレベルが高いHwang et al. | |
| 高用量STZを投与したマウスのUSCを移植した場合 | 膵島血管再生を促進するUSC移植 | 耐糖能と膵島形態の改善、インスリン含量の増強、血糖値の改善Zhaoら(2018)。 | ||
| II型糖尿病ラット | USCの尾静脈注射を週6回行う。 | 空腹時血糖値を顕著に低下させなかったDongら(2016) | ||
| マウス | USCをスポンジに単回注入 | 血糖値に有意な影響を及ぼさなかったOuyangら(2014)。 | ||
| 消化器系疾患 | 肝細胞移植 | 慢性肝線維化マウスモデル | オートファジー、増殖、コロニー形成、移動、細胞融合の促進 | 肝臓回収効率の向上Huら(2020)、Huら(2021) |
| 神経系疾患 | ニューロン新生 | マウス脳 | ハイドロゲル足場へのUSCの播種とラット脳への移植 | 病変部位で大きな増殖速度で生き残り、ニューロン様細胞へ分化Guan et al. |
| ユーエスシー | ラミニンと血小板由来成長因子-BBの組み合わせ | 神経細胞マーカー(MAP2、NFM、NeuN)レベルの上昇Kimら(2018)。 | ||
| 化学物質のみによる誘導プロトコルのUSC | ISX9、I-BET、RAを誘導し、USCの神経細胞への転換を改善。 | 神経細胞特異的マーカー(Tuj1、Map2、Tau)の増加、電気生理学的特性の改善Liu et al (2020b) | ||
| 脊髄損傷 | 脊髄損傷ラットモデル | 神経成長因子、脳由来神経栄養因子の発現量上昇 | ラットの運動機能の改善Li and Wu(2017)、Chen et al(2018b)。 | |
| 虚血性脳卒中 | 虚血性脳卒中モデルラット | USC-Exo注入;脳室下帯でEdU+/Nestin+細胞数の増加。 | 神経障害の軽減、梗塞体積の減少Lingら(2020年)。 | |
| 酸素・グルコース欠乏/再酸素処理したNSCs | USC-Exos;エクソソームマイクロRNA-26a | ヒストン脱アセチル化酵素6(HDAC6)抑制の神経原性作用を発揮Lingら(2020)。 | ||
| 運動器系疾患 | 骨粗鬆症 | 卵巣摘出ラットモデル | USC-EV;コラーゲン・トリプルヘリックス・リピート含有1(CTHRC1)とオステオプロテジェリン(OPG)タンパク質によって媒介される。 | 骨量の増加、骨粗鬆症の治療に有効Chenら(2019)。 |
| 骨芽細胞性骨形成を促進するUSC-EVの治療法 | 骨芽細胞形成関連mRNA(オステオカルシン、Alp、Runx2)が高いChenら(2019)。 | |||
| 筋再生 | マウス | USCは骨格筋の再生を促進する | 特定の骨格筋系細胞の転写物やmyf5、myoD、myosinなどのタンパク質マーカーChen et al. | |
| ユーエスシー | USCと成長因子の組み合わせ;ヒアルロン-ヘパリンハイドロゲルスカフォールド | 筋細胞生存率の向上Liuら(2020a) | ||
| 虚血により後肢を痛めたマウス | USC-EVの移植;血管新生 | HMEC-1およびC2C12細胞増殖、筋肉再生Zhuら(2018年) | ||
| 皮膚再生と創傷治癒 | ウサギの全層皮膚欠損モデル | 生体適合性ポリカプロラクトン/ゼラチンナノファイバー膜足場材の使用法 | 創傷収縮、皮膚付属器再生、再上皮化、新生血管の改善Fuら(2014) | |
| ヒト臍帯静脈内皮細胞(HUVEC) | HUVECsの増殖、運動性、チューブ形成能を有意に向上させたFu et al. | |||
| 内皮細胞、全層摘出創傷 | パラクリン効果 | 内皮細胞の増殖改善、線維芽細胞の分化促進、vWF、コラーゲン、フィブロネクチンのレベル上昇Zhangら(2018年) | ||
| ラット全層皮膚創傷モデル | EAhy926細胞の増殖と生存率 | コラーゲン沈着と血管新生の促進Caoら(2019) | ||
| 低酸素環境下におけるUSCの小型SISスキャフォールドへの播種 | VEGF、コラーゲン、弾性線維の分泌を増加させたsZhangら(2020c) | |||
| ストレプトゾトシン誘発糖尿病マウス | DMBT1の高発現 | 血行再建とコラーゲン沈着を加速させるChenら(2018a) | ||
| 歯周組織工学 | ヒト歯根膜幹細胞(PDLSCs) | USCの非接触共培養、PDLSCsの増殖および骨芽細胞・骨片細胞への分化の改善 | コラーゲン層の密度、セメント生成タンパク質のレベル、ALP活性の増加Yang et al. | |
| USC由来のECM | 増殖能、骨形成分化能、血管新生能の向上Xiong et al (2019b) | |||
| 勃起不全 | 両側性海綿状神経損傷(CNI)モデルラット | USCを注入、細胞アポトーシスの割合が低い | ICPレベルおよびICP/MAP比を顕著に増加、海綿体の平滑筋とコラーゲンの比率を増加Chenら(2018c) | |
| 色素上皮由来因子(PEDF)で修飾されたUSC;抗アポトーシス | 勃起機能を有する被験者の神経およびECに対して保護作用を発揮したYangら(2016年) | |||
| ストレプトゾトシン注射の雄ラットモデル | USC-EVによる治療 | 内皮の発現量と平滑筋の含有量が増加し、ICPレベルとICP/MAP比が増加Ouyang et al (2019) | ||
| DEDラット | USC-EV;治療 | 内皮の発現量と平滑筋の含有量が増加し、ICPレベルとICP/MAP比が増加Zhou et al (2019) | ||
神経系疾患
移植可能なヒト神経細胞が存在せず、神経細胞増殖の技術的手段が不十分なため、脊髄損傷、急性脳虚血、神経変性疾患による神経細胞アポトーシスの臨床治療には課題が残っている(Fricker et al.、2018年)。USCのニューロンへの分化能は、ニューロンの再生に大きな希望をもたらすが、その増殖と分化を高めることが緊急に求められている。USCは、神経細胞の再生医療分野において重要な要素であることが証明されている。また、疾患モデリングに有用な非侵襲的細胞源として、USCは高い増殖能と分化能を持ち、神経疾患モデリングに大きな可能性を持っている(Shi and Cheung, 2021)。
Guanらは、USCをハイドロゲル足場に播種し、ラット脳に移植した後、USCが優れた増殖速度で病変部位で生存できるだけでなく、神経表現型関連タンパク質を発現するニューロン様細胞へと分化できることを発見した(Guanら、2014年)。Kimらの研究では、ラミニンと血小板由来成長因子-BBの組み合わせは、MAP2、NFM、NeuNなどのニューロンマーカーのレベルの上昇によって示されるように、USCの分化能に相乗効果をもたらした(Kimら、 2018)。さらに、Liuらは、神経細胞分化誘導剤ISX9、非神経細胞遺伝子の破壊剤I-BET、およびビタミンA1の代謝物(すなわちRA)を含む化学物質のみの誘導プロトコルを使用し、この処理によって、ニューロン特異的マーカーTuj1、Map2、Tauおよびその電気生理学的特性の検出に基づいてUSCのニューロン細胞への転換が改善することを観察した(Liuら、 2020b)。明らかに、USCはニューロン新生に役立っている。
疾患に対するUSCの治療効果について、Chenらは、下肢の機能的損傷を評価するために、USCとchABCを組み合わせてラットの障害脊髄に移植し、両群とも運動機能の著しい改善を示し、これは神経GFおよび脳由来神経栄養因子の発現上昇に起因した(Li and Wu, 2017; Chen et al, 2018b)。注目すべきは、虚血性脳卒中モデルラットにおいて、Lingらは、USC-Exosの注入が、梗塞体積の減少および神経新生の促進によって示されるように、神経障害を減弱し、神経細胞の回復を促進し得ることを実証したことだ。成体神経幹細胞(NSCs)が主に存在する脳室下帯では、EdU+/Nestin+細胞の増加が観察された(Lingら、2020年)。さらに、酸素・グルコース欠乏/再酸素処理したNSCsをin vitroモデルとして、USC-ExosがmicroRNA-26aを転送してヒストン脱アセチル化酵素6(HDAC6)mRNAの分解を誘導し、HDAC6 mRNAの翻訳を阻害することにより、NSCsの自己複製と分化を増加させられることを著者らは発見した(Ling et al., 2020)。USC-Exosのin vivoでのproneurogenic効果は、miR-26a/HDAC6軸の役割に関連している可能性があるが、検証のためにはさらなる研究が必要である。結論として、USCは神経細胞の増殖と分化を促進することができ、神経細胞のアポトーシスに関連する疾患の治療に新たなアイデアを提供することができる。
運動器系疾患
骨粗鬆症
骨粗鬆症は、骨密度の低下と骨強度の低下を特徴とし、骨折のリスクを高める全身性の骨疾患であり、その発症機序はOBのアポトーシスと破骨細胞(OC)の増殖に起因するとされている(Miller, 2016)。USCが分泌するEVは、様々な損傷した実質組織の治癒を促進することができるため、研究者は、骨粗鬆症の治療にそれらを使用しようとしている(Riazifar et al.、2017)。
Chenらは、USC-EVが骨形成を促進し、骨粗鬆症の発症を予防する可能性があると推測している。この仮説を調べるために、彼らは年齢、性別、健康状態の異なる異種ラットモデルを用いて、USC-EVがコラーゲントリプルヘリウムリピート含有1(CTHRC1)および骨タンパク質(OPG)タンパク質を発現・仲介し、それによって骨形成を促進し、骨形成を阻害することを確認した。これらのタンパク質がどのようにUSC-EVに仕分けられ、その後レシピエント細胞によって再利用されるかはまだ不明であり、骨粗鬆症の予防におけるその有効性はさらなる調査が必要である(Chen et al.、2019)。USCの増殖およびOBへの分化能力は、骨粗鬆症の治療だけでなく、大きな分節性骨欠損の修復にも利用できる(Liuら、2021年)。顕著な骨形成能に加えて、USCはin vivoでBMSCsと同様の軟骨修復効果を有し、軟骨再生のための幹細胞代替物として使用することができ、臨床転換のための強力なプラットフォームを提供する(Sunら、2021)。一部の研究者は、USCが骨粗鬆症の新たな治療選択肢となる可能性を指摘している。
筋肉の再生
骨格筋は、人体で最も大きな器官の一つである。健康で完全な骨格筋は、人間の健康や生活の質に決定的な影響を与える。筋肉の損傷や再生のアンバランスは、疾患の発生や発症につながる。筋衛星幹細胞(MuSCs)は、筋肉再生の主要な源だが、その機能は時間の経過とともに徐々に低下していく。そのため、代替療法が早急に求められている(Yamakawa et al.、2020)。USCは筋芽細胞分化の可能性を持ち、myf5、myoD、ミオシンなどの特定の骨格筋系譜転写物やタンパク質マーカーを発現することから、骨格筋再生の重要な候補となり得る(Chen et al.)
筋分化培地で培養したUSCをマウスの前脛骨筋に移植したところ、骨格筋系譜細胞マーカーが安定的に発現していることが確認され、USCが骨格筋再生に関与していることが示唆された(Chen et al.、2017)。試験管内でのUSCからの長期的な筋転換は常に高い細胞死と低い分化をもたらすため、研究者は、筋原性関連IGF1、HGF、PDGF-BBなどの様々なGFを含むヒアルロン-ヘパリンヒドロゲルに初代USCを適用して、生体内での生存率を改善する新規方法を探求してきた。細胞生存率の上昇と筋原性および内皮細胞マーカーの発現により、筋組織工学におけるUSCとGFの併用効果が明らかになった(Liuら、2020a)。虚血に苦しむマウス後肢にUSC-EVを移植した後、著しく高いレベルの血管新生、HMEC-1およびC2C12細胞増殖、および筋肉再生がZhuらによって観察された(2018)。したがって、彼らの成果は、将来的に後肢虚血傷害を減弱させるための新規治療法を示唆するものである。
その他の疾患
皮膚再生と創傷治癒 適切な皮膚組織足場は創傷治癒を促進するが、適切な足場材料の欠如は皮膚組織工学の障害である。これまでのデータから、USCといくつかの新規バイオマテリアルを組み合わせることで、創傷治癒プロセスの重要な部分である新生血管形成を促進できることが分かっている。その結果、多方向の分化能を持つUSCは、創傷、潰瘍、火傷、炎症による広範囲の皮膚損傷の治癒を促進するための人工皮膚組織構築の重要な戦略となってきた。
Fuたちは、生体適合性のあるポリカプロラクトン/ゼラチンナノファイバー膜を創傷修復の足場として作製し、ヒト皮膚組織と同様の機械的強度を有することを示した。次に、これらの複合メッシュにUSCを播種した。PCL/GT膜のみで処理したウサギの全層皮膚欠損モデルと比較して、USC-PCL/GT処理後は創傷治癒が著しく促進され、創傷収縮の顕著な改善、肉芽組織の厚さ、皮膚付属器(毛包など)の再生、再上皮化および新血管の迅速化、コラーゲンレベルおよび毛細管密度の高さが明らかになった(Fu et al., 2014). In vitroの実験では、USC調整培地でヒト臍帯静脈内皮細胞(HUVEC)を培養した後、HUVECの増殖、運動性、チューブ形成能力が著しく向上したことが観察された(Fu et al.)バイオグラスは、生体活性珪酸塩の一種で、生体の骨や軟組織に直接接続して損傷を修復する特殊なガラスである。バイオガラスはUSCからVEGFとbFGFの分泌をアップレギュレートすることができる。この生成物はバイオガラス活性化USCと呼ばれ、内皮細胞や線維芽細胞の創傷治癒能力を高めることが可能である。Zhangらは、この性質を利用して、バイオガラスと組み合わせたUSCを厚さ一杯の創傷に適用し、USCとレシピエント細胞の間のパラクライン効果を活性化することにより、創傷治癒を促進できることを確認した。この効果は、内皮細胞増殖および線維芽細胞への筋線維芽細胞分化の改善、VEGFおよびbFGFレベルの上昇、毛細管様ネットワーク形成およびvWF、コラーゲンおよびフィブロネクチンのレベル上昇として現れた(Zhangら、2018)。Caoらは、USCを生体材料、すなわち表面構造化バクテリアセルロース(S-BC)と組み合わせることにより、USCがEAhy926細胞(HUVECの一種)の増殖と生存を促進し、その相乗効果によりラット創傷閉鎖の評価時にコラーゲン沈着と血管新生が加速することを発見した(Caoら、2019年)。学者たちは、組織または細胞を低酸素に繰り返し短期間曝露することを含む低酸素環境から生じる損傷の予防および治療のために、低酸素プレコンディショニングと名付けられた新規のアイデアを提供しており、低酸素プレコンディショニングは低酸素に対する耐性を改善することができる。この方法は、移植された幹細胞の生存率や増殖率を向上させることがよく知られている。さらに、低酸素前処理において、軟組織修復に広く用いられているSIS足場に播種したUSCは、VEGF、bFGF、コラーゲン、弾性線維の分泌を高め、マウスモデルにおける全層皮膚創傷治癒を促進できる(Zhangら、2020c)。さらに、Chenらは、USC-ExosがSTZ誘発糖尿病ラットの軟組織創傷修復に血行再建の促進やコラーゲン沈着などの有益な効果を有し、これらの効果は血管新生タンパク質DMBT1の高い発現に起因する可能性があると報告している(Chenら、2018a)。USCを用いたスキンステントは、皮膚の創傷治癒を促進する新しい方法であると考えられるが、まだ臨床治療には用いられていない。
歯周組織工学 ヒト歯根膜幹細胞(PDLSCs)は、歯周組織再生の重要な材料と考えられており、歯周炎や歯肉炎などの疾患の治療に利用することができる。PDLSCsは、現在の臨床治療戦略に影響を与える完全な歯周組織再生ができないという欠点がほとんどない。しかし、PDLSCの数は限られているため、細胞の増殖や分化を促進する戦略の開発が現在の最重要課題となっている。
USCの非接触型共培養において、コラーゲン層の緻密化、セメント生成タンパク質セメントムタンパク質1(CEMP1)のレベル上昇、アルカリホスファターゼ(ALP)活性、ラント関連転写因子2(RUNX2)およびオステオカルシン(OCN)によって示される、PDLSCsの増殖および骨芽細胞/セメント芽細胞分化が改善されたという証拠がある(Yangら、2020年)。さらに、Xiongらは、USC由来のECMが、ネイティブPDLSCと比較して、PDLSCの増殖、骨形成分化能、血管新生を増強することを見出した(Xiongら、2019b)。これらの結果は、USCがPDLSCsとの骨形成反応の共促進に最も適した基質である可能性を示しているが、まだ臨床への応用は進んでいない。
勃起不全
糖尿病など多くの危険因子を伴う勃起不全の有病率は、年齢を問わず平均30%といわれている。生活の質が低下するため、これらの患者はしばしば高コストの陰茎プロテーゼ移植を受け、体幹線維化などの苦痛な合併症を引き起こす(Yafi et al.)多くの研究により、USCがEDの治療において重要な役割を果たすことが示されている。
USCは、勃起機能を改善し、神経を保護し、線維化を抑え、海綿体組織における細胞のアポトーシスを抑制することによって、海綿体の内皮構造を修復することができる(Chenら、2018c)。Yangらによって行われた実験では、色素上皮由来因子(PEDF)で修飾されたUSCは、抗アポトーシス作用と合わせて神経およびECの保護作用を発揮することによって、海綿体神経損傷(CNI)のラットの勃起機能を改善した(Yangら、2016)。Ouyangらによって報告された観察によると、USC-EVは、STZ注射によって確立された雄ラットモデルにおいて内皮発現および平滑筋含有量を増加させることによって糖尿病性勃起不全(DED)を改善する(Ouyangら、 2019)。同様に、Zhangらは、オートファジー活性の増加がDEDモデルにおける海綿体内皮細胞の機能改善に関連していることを明らかにし、オートファジーの逆転がDEDの新しい治療ターゲットとなる可能性を示唆した(Zhouら、2019年)。ただし、USCによるEDの改善はラットなどの動物実験に基づくものであり、検証のためにはさらなる臨床研究が必要である。
現在の課題
USCの持つ大きな可能性とは裏腹に、克服すべき課題も残されている。実験に使用する細胞が遺伝的背景の異なる個体に由来する場合、その多様性が実験再現性に影響を与える可能性がある(Ji et al.)尿ドナーの年齢、性別、健康状態は、幹細胞の増殖や多能性に影響を与える可能性があり、例えば、若くて健康な人の尿から得られたUSCは、増殖や様々な系統への分化能力が高いが(Tayhan et al.、2017)、糖尿病の患者からのUSCは再生能力が著しく低下する(Xiong et al.、2019a)。
上記のように、USCは多方向の分化能を有するが、BMSCと比較して骨形成および軟骨形成の分化能が低下していることから、その指向性分化効率を改善する戦略が早急に必要とされている(Jiら、2017a;Wuら、2018)。さらに、USCの分化はほとんどがin vitroで実証されており、in vivoでの分化能をさらに検討する必要がある。遺伝子改変、薬物前処理、共培養などの前処理を行うことで、USCのin vivoでの分化能を高めることができる(Hu et al.、2020年)。さらに、Dongらは、USCがラット膵臓のPDX1陽性細胞に分化することを示唆した(Dongら、2016年)。しかし、2018年、Zhaoらは、USCがSTZ誘発糖尿病マウスの軽度から中等度の損傷によって誘発されるアポトーシスからβ細胞を保護することができることを明らかにした;しかし、これらの細胞はすでに死んだβ細胞を置き換えることはできなかった(Zhaoら、2018)。これらの2つの矛盾する結果は依然として議論の余地があり、さらなる実験的証拠を必要とする。
USCを正式に臨床に適用する前に、標準化された製品を入手し、保管と輸送、in vitro増幅、投与と投薬、および細胞のホーミングを最適化する必要がある。さらに、基礎的な細胞治療の治癒効果を向上させ、細胞治療プロトコルを最適化しなければならない。
安全性と有効性についても考慮する必要がある。最近の研究では、尿は細胞毒性が強いため、USCなどの移植細胞やそれに対応する足場の増殖・分化が尿路で再構築される危険性が示唆されている(Abbasら、2020年)。
USCから再プログラムされたiPSCは、再プログラム過程に伴うゲノム不安定性とエピジェネティックメモリーの影響を受け、in vitroでの異常な分化をもたらし、疾患モデルや臨床応用にさえ影響を与える(Jiら、2017b)。テラトーマ形成は、iPSC移植の主要な副作用である(Parrottaら、2019年)。
USC由来のエクソソームは、生物活性の長期維持、低免疫原性、腫瘍形成の促進がないという利点を有する新規無細胞治療戦略を代表するものである。とはいえ、in vivoでエクソソームを特異的に標識し追跡することは、依然として困難である(Li et al.)
結論
全体として、USCとその分泌因子は、免疫制御、酸化ストレス調節、再灌流、細胞アポトーシスおよびオートファジーにおいて役割を担っている。これらのメカニズムにより、USCは組織工学や個別化治療戦略において大きな可能性を秘めており、泌尿器系、神経系、運動器系、生殖内分泌系、消化器系など、様々な疾患に対して治療効果を発揮することが期待される。現在、いくつかの課題があるが、今後の研究により、既存の問題の解決策が見出され、応用範囲が拡大することが期待される。
利益相反について
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
