Contents
- アルツハイマー病 53の発症因子
- 1. APPβ切断を減少させる
- 2. APPγ切断を減らす
- 3. APPα切断を増加させる
- 4. カスパーゼ6切断を減少させる
- 5. カスパーゼ3切断を減少させる
- 6. アミロイドβオリゴマー化を減らす
- 7. ネプリライシンを増やす
- 8.インスリン分解酵素(IDE)を増やす
- 9.アミロイドβのミクログリアクリアランスを増加させる
- 10.オートファジーの活性
- 11. BDNFを増加させる
- 12. 神経成長因子(NGF)を増加させる
- 13. ネトリン1、ADNPを増やす
- 14.血管作動性腸管ペプチド(VIP) を増やす
- 15. ホモシステインを減少させる
- 16.PP2A活性を高める
- 17. リン酸化タウタンパク質を減らす
- 18. 食作用指数を増加させる
- 19. インスリン感受性を高め最適化
- 20.レプチン感受性を高める
- 21.軸索輸送を改善
- 22. ミトコンドリア機能、生合成の増強
- 23. 酸化的損傷を軽減し活性酸素種を最適化
- 24. コリン作動性神経伝達を高める
- 25. シナプトブラスティックを増やす
- 26. シナプトクラスティックを減らす
- 27. LTP(長期増強)を改善
- 28. エストラジオールの最適化
- 29. プロゲステロンの最適化
- 30. E2/P4の比率の最適化
- 31. fT3,fT4の最適化
- 32. TSHの最適化
- 33. プレグネノロンの最適化
- 34. テストステロンの最適化
- 35. コルチゾールの最適化
- 36. DHEAを増強する
- 37. インスリン分泌、シグナリングの最適化
- 38. PPARγの活性化
- 39. 炎症を減少させる
- 40. レゾルビンを増加させる
- 41. デトックス、解毒
- 42.脳血流を改善する
- 43. cAMPを増やす
- 44. 還元型グルタチオン(GSH)を増やす
- 45. シナプスの材料を供与
- 46.すべての金属を最適化する
- 47. GABAを増加させる
- 48. ビタミンDシグナリングを増やす
- 49. SirT1を増やす
- 50. NF-kBを阻害
- 51. テロメアの長さを増やす
- 52.グリア性瘢痕を減少させる
- 53. 幹細胞を介した脳の修復
- その他
われわれの研究所では、少なくとも36の発症因子が大多数の人のアルツハイマー病の要因として同定されている。おそらく36以上の因子がまだいくつかあるだろうが、それほど多くはないはずだ。発症因子が100に達することがないのは確かだ。
36の発症因子をどのように理解し対処していくべきかについて、プリオニックループは極めて実際的な意義をもつ。
※プリオニックループ=分子メカニズムによる恒常性または抗恒常性フィードバック
プリオニックループには閾値があり、閾値に達することでAPP(アミロイド前駆体タンパク質)のバランスを保ちアルツハイマー病の代謝障害に対抗することができる。そのため36のすべての穴をふさぐ必要はない。一旦十分に穴を塞げば、残りの穴から雨が降り注ぐことはない。
残念ながら各個人が36の穴のうちどれだけの穴をふさげばよいか簡単に測定する手段は見いだせていない。各個人の遺伝子や生化学的検査の数値によって、その穴の種類も異なれば大きさも異なる。したがって、とにかく改善するまで、できる限り多くのプロトコルを実行することが最善の方法であろう。
最終的に脳のシナプス障害経路が増強されアルツハイマー病を発症するのか、もしくはシナプス保存経路を強化することで認知機能の低下を逆転させ脳の健康を維持するのか、
少なくとも、この36の要因によってはっきりと決定づけられる。「The End of Alzheimer’s」 より
アルツハイマー病 53の発症因子
- Reduce APPβ-cleavage
- Reduce γ-cleavage
- Increase α-cleavage
- Reduce caspase-6 cleavage
- Reduce caspase-3 cleavage
- Prevent amyloid-beta oligomerization
- Increase neprilysin
- Increase IDE (insulin-degrading enzyme)
- Increase microglial clearance of Amyloid-β
- Increase autophagy
- Increase BDNF (brain-derived neurotrophic factor)
- Increase NGF (nerve growth factor)
- Increase netrin-1 and ADNP (activity-dependent neuroprotective protein)
- Increase VIP (vasoactive intestinal peptide)
- Reduce homocysteine
- Increase PP2A (protein phosphatase 2A) activity
- Reduce phospho-tau
- Increase phagocytosis index
- Increase insulin sensitivity
- Enhance leptin sensitivity
- Improve axoplasmic transport
- Enhance mitochondrial function and biogenesis
- Reduce oxidative damage and optimize ROS (reactive oxygen species) production
- Enhance cholinergic neurotransmission
- Increase synaptoblastic signaling
- Reduce synaptoclastic signaling
- Improve LTP (long-term potentiation)
- Optimize estradiol
- Optimize progesterone
- Optimize E2:P (estradiol to progesterone) ratio
- Optimize free T3 and free T4
- Optimize TSH (thyroid-stimulating hormone)
- Optimize pregnenolone
- Optimize testosterone
- Optimize cortisol
- Optimize DHEA (dehydroepiandrosterone)
- Optimize insulin secretion and signaling
- Activate PPAR-γ (peroxisome proliferator-activated receptor gamma)
- Reduce inflammation
- Increase resolvins
- Enhance detoxification
- Improve vascularization
- Increase cAMP (cyclic adenosine monophosphate)
- increase glutathione
- Provide synaptic components
- Optimize all metals
- Increase GABA (gamma-aminobutyric-acid)
- Increase vitamin D signaling
- Increase Sirt1 (silent information regulator T1)
- Reduce NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cell)
- Increase telomere length
- Reduce glial scarring
- Enhance stem-cell-mediated brain repair
1. APPβ切断を減少させる
アミロイド前駆体タンパク質(APP)の2つの切断経路が存在する
- 非アミロイド形成経路であるαセクレターゼ経路
- アミロイド形成経路であるβセクレターゼ経路
アルツハイマー病における老人斑を形成するアミロイドβ40、アミロイドββ42の産生には、まず最初に細胞外でβセクレターゼによって切り出される必要がある。

2. APPγ切断を減らす
アミロイドβ40およびアミロイドβ42は、細胞外においてまず最初にβセクレターゼによって切り出され、後に細胞内でγセクレターゼによって切り出されることで産生される。[R]
γセクレターゼ切断モデル

www.ncbi.nlm.nih.gov/pmc/articles/PMC3857966/
3. APPα切断を増加させる
en.wikipedia.org/wiki/Alpha_secretase
αセクレターゼは、アミロイドβの中央部分に相当するAPPを切断するため、アミロイドβを産生することができない。その代わりにsAPPαを細胞外に放出する。
sAPPαは神経保護特性を有すると推定されており、αセクレターゼ切断の促進はアミロイドβ産生の阻害と神経保護の2つの作用によりアルツハイマー病に対抗しえる。[R]
残りのAPPをγセクレターゼが切断することで、無毒性のp3ペプチドが放出される。
αセクレターゼプロセシングは構成的に調整されて切断が行われる。
4. カスパーゼ6切断を減少させる
カスパーゼとは
哺乳動物のカスパーゼは1から14まで見つかっており、まとめてカスパーゼファミリーと呼ばれる。
ほとんどのカスパーゼはプログラム細胞死であるアポトーシスの誘導に関与している。
カスパーゼは大きく以下の2つタイプが存在する。
- イニシエーター・カスパーゼ(アポトーシスの誘導の初期に関わる)
- エフェクター・カスパーゼ(アポトーシスの実行そのものに関わる)
カスパーゼ6はエフェクター・カスパーゼに分類される。
カスパーゼ6
en.wikipedia.org/wiki/Caspase_6
カスパーゼ6は炎症およびプログラム細胞死に関与するカスパーゼタンパク質ファミリーに属するシステインプロテアーゼであり、エフェクターカスパーゼに分類される。
家族性アルツハイマー病の脳においてカスパーゼ-6活性化が豊富である。
若年者(45歳未満)の脳ではカスパーゼ6は検出されない。
タウカスパーゼ6は、全般的な認知機能スコアと逆相関し、アルツハイマー病重症度とも相関する。

5. カスパーゼ3切断を減少させる
アルツハイマー病患者の異常カスパーゼ
アポトーシスと関連するカスパーゼがアルツハイマー病の進行性神経細胞死に寄与することがこれまでの研究で示されてきている。
アルツハイマー病患者の死後の脳組織では、イニシエーターカスパーゼであるカスパーゼ8,9ならびにエフェクターカスパーゼであるカスパーゼ3,6の異常な発現が報告されている。
カスパーゼ3
カスパーゼ3の活性化は、アポトーシス細胞死をもたらす生化学カスケードの最終段階にあると考えられている。
カスパーゼ3はアルツハイマー病初期段階に関与
アミロイドβペプチドはタウのカスパーゼ切断につながる。カスパーゼ3で切断されたC末端断片が細胞内で毒性をもつことも示されている。
カスパーゼ3はアルツハイマー病進行初期の神経変性事象である可能性があり、カスパーゼ3はアルツハイマー病の初期のバイオマーカとして使用できるかもしれない。[R]

www.sciencedirect.com/science/article/pii/S0166223612001154
6. アミロイドβオリゴマー化を減らす
アミロイドβオリゴマーとは、アミロイドβの単量体が重合した可溶性の凝集体。
最近の研究では、可溶性オリゴマーが最も有毒なアミロイドの形態であると信じられている。
7. ネプリライシンを増やす
ネプリライシンはメタロプロテアーゼ13(M13)ファミリーの亜鉛メタロプロテアーゼのメンバー。
ネプリライシンは細胞外酵素であり、細胞外の多くの生理学的に関連するペプチドを切断して不活性化することによりペプチドホメオスタシスの維持に貢献する。ネプリライシンの活性は、高血圧、鎮痛、癌、アルツハイマー病などの病因に関与する。
アミロイドβペプチド分解酵素ネプリライシン
ネプリライシンは、アミロイドβペプチド分解酵素であり、健康な人の脳内では、ネプリライシンによりアミロイドβの平衡状態が保たれている。
ネプリライシンの過剰発現は脳にアミロイドβペプチドの蓄積を妨げ、アミロイドβのクリアランスを加速させることでアルツハイマー病の発症を遅らせる可能性がある。[R]
ネプリライシンの過剰発現による抗認知症効果
ADマウスモデルの実験ではネプリライシンの過剰発現により、アミロイドβペプチドレベルの減少、アミロイドβの負荷、酸化ストレス、炎症の緩和、そして空間的な認知機能を改善させ、記憶障害を50%低下させた。
アルツハイマー病の初期段階では、ネプリライシンレベルの回復が、疾患の進行または予防を軽減するための有効な戦略であることを示唆している。[R][R]
8.インスリン分解酵素(IDE)を増やす
インスリン分解酵素(IDE)の多彩な機能
インスリン分解酵素/Insulin-degrading enzyme(IDE)は、インスリン代謝に関与する酵素として発見された。
そのため、これまでの研究もほとんどが糖尿病の発症に関するものとして調査されている。
しかし、アミロイドβ、アミリン、グルカゴンなどのポリペプリドを分解する能力が見出されたことから、この酵素の多機能性の役割が浮かび上がってきた。
最近の研究では、IDEが
- 熱ショックタンパク質
- ユビキチンプロテアソーム系の調節
- タンパク質の代謝サイクル
- 細胞ホメオスタシス
- アミロイドタンパク質の切断
- 酸化したタンパク質のユビキチン化
などにおいて主要な役割を果たしている可能性があることが示唆されている。
IDEの酵素活性は金属レベルからの影響を受けることから、金属ホメオスタシス(メタロホメオスタシス)における役割も示唆されている。[R]
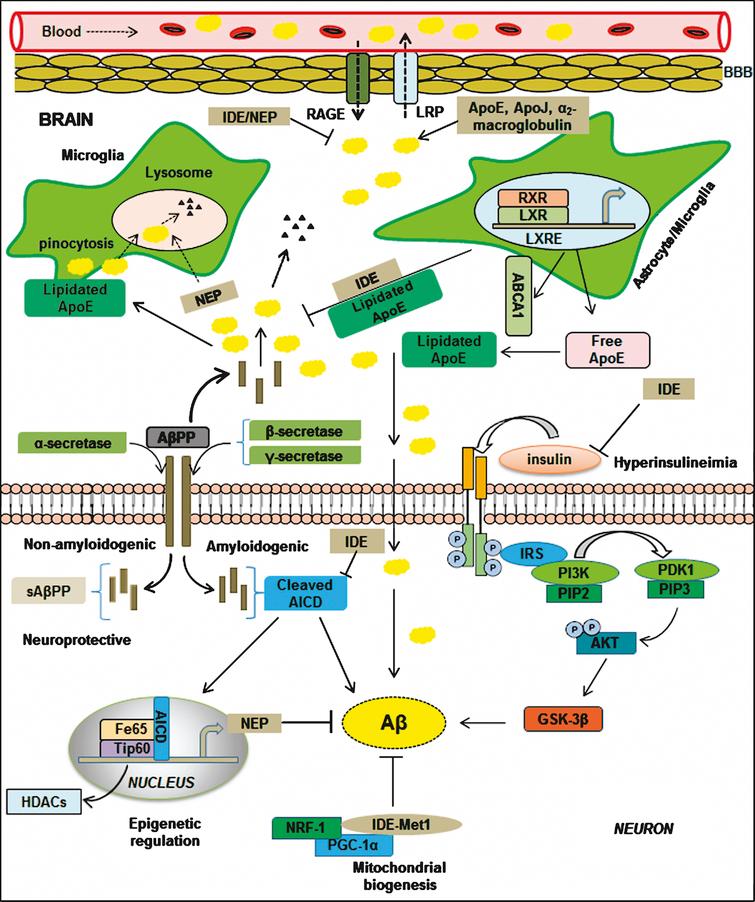
content.iospress.com/articles/journal-of-alzheimers-disease/jad150379
9.アミロイドβのミクログリアクリアランスを増加させる
アミロイドβは脳内において平衡バランスを保っており、アルツハイマー病の発症はアミロイドβの恒常性が崩壊することによって生じるという仮説が存在する。
ミクログリアの食作用によるアミロイドβ原繊維、可溶性アミロイドβのクリアランス(排出)を媒介することが報告されている[R]
毒にも薬にもなるミクログリアの活性
アルツハイマー病初期においては、ミクログリアは活性化され修復作用をもつということは十分に確立されている。一方で、グリア細胞の活性化は特定のサイトカイン、活性酸素種などの前炎症性サイトカインの分泌を促進することにより有害な影響を与えうる。
グリア細胞の調節不全によりアミロイドのクリアランスに失敗すると、ミクログリアの過剰活性はアミロイドβの蓄積にも寄与しうる。[R]

www.ncbi.nlm.nih.gov/pmc/articles/PMC3580295/
10.オートファジーの活性
- 異常なタンパク質を分解して蓄積を防ぐ
- 過剰に合成されたタンパク質の分解
- 栄養飢餓などによりタンパク質をリサイクルしてアミノ酸を供給
- 細胞質内に侵入した病原微生物の排除
など、生体の恒常性維持に関与する。
3つの主要なオートファジー
- マクロオートファジー
- シャペロン介在性オートファジー
- マイクロオートファジー
神経変性疾患におけるオートファジー
アルツハイマー病、ALD、家族性パーキンソン病などの疾患では、オートファジー経路に異常が生じており、疾患の発症機序に多くの影響を与えている。
オートファジーがタウ凝集体、アミロイドβの蓄積と関連して、アルツハイマー病の進行に対する保護因子として機能するこれまで実証されてきている。
オートファジーの複雑なネットワーク
オートファジーは基盤的な180のタンパク質候補の相互作用により複雑にオートファジーネットワークが築かれていることがわかってきた。
神経変性疾患におけるオートファジー経路への介入としてmTORが第一世代の標的として知られているが、それよりもより多くの薬物標的が必要となる可能性がある。
アルツハイマー病
現在の研究では、アルツハイマー病におけるオートファジーの役割には議論の余地があるが、多くの研究が、オートファジーのアップレギュレーションによるアミロイドβおよびアミロイドβ発現の低下を報告しており、いくつかの研究ではアルツハイマー病の病因にオートファジーが関与していることを報告している。[R]
アルツハイマー病の初期段階のおいての、オートファジー誘導剤は新しい有効な治療を提供する可能性がある。対照的に、アルツハイマー病後期においてオートファジーを活性化させることは、アミロイドβ産生の加速により疾患の重症度を高める可能性がある。
11. BDNFを増加させる
脳由来神経因子(BDNF)を増加させる
en.wikipedia.org/wiki/Brain-derived_neurotrophic_factor
概要
BDNFは、中枢神経系や末梢神経系のニューロンに作用して、ニューロンの生存維持のサポート、成長を促進し、新しいニューロンやシナプスに分化することを促す神経栄養因子。
BDNFは、脳の中では、海馬、大脳皮質、大脳基底核で活性化されている。網膜、運動ニューロン、腎臓、唾液腺、前立腺にも作用する。
アルツハイマー病患者の低いBDNF
アルツハイマー病患者の脳の組織中のBDNFは低下しているが、原因は不明である。
BDNFの神経保護効果
BDNFはアルツハイマー病のβアミロイド蛋白の毒性に対して、保護的役割を果たすことが研究で示されている。

12. 神経成長因子(NGF)を増加させる
神経成長因子NGFはBDNFと並んで、認知症患者、アルツハイマー病患者にとって重要な神経栄養因子のひとつ。
認知症、アルツハイマー病患者にとってのNGFの直接的な重要性は、NGFがニューロンの軸索の成長、維持し、また軸索をコーティングしているミエリン鞘を修復することにある。
アルツハイマー病の直接的な障害の起因は、海馬のミエリン鞘が脱落しそれが広がっていくものという仮説がある。
NGFが作用する脳の前脳基底部は、アルツハイマー病患者の脳でミエリン鞘が脱落し激しく障害を受ける場所でもあるため、何か関連があるのではないかとされていた。
高齢者においても海馬のNGFは低下しているとされている。
![]() 神経成長因子 NGFを増やす7つのアプローチ (認知症・アルツハイマー)
神経成長因子 NGFを増やす7つのアプローチ (認知症・アルツハイマー)
13. ネトリン1、ADNPを増やす
ネトリン-1
ネトリン-1は、脊髄の腹側領域、神経上皮細胞、体性中胚葉、膵臓、心筋を含む神経系の部位に見出される。
主な役割は、分岐構造の軸索ガイダンス、ニューロンの移動、形態形成など。
ネトリン-1遺伝子変異を有するマウスは、前脳および脊髄交連軸索を欠損していることが観察される。

ADNPを増加させる
Activity-dependent neuroprotector homeobox protein
活動依存性神経保護因子ホメオボックスタンパク質
en.wikipedia.org/wiki/ADNP_(gene)
ADNPはアストロサイトから放出される神経細胞保護作用をもつ生理活性タンパク質で、主に小脳、海馬、大脳白質で発現しており、脳の発達、自食作用に必要、認知機能と関連する。
14.血管作動性腸管ペプチド(VIP) を増やす
概要
VIPは腸、膵臓、視交叉上核など、多くの組織にて産生されるホルモンで血管拡張作用をもつ。
VIPは発見された当初腸ホルモンとして分類されていたが、過去30年間の研究から、中枢神経、末梢神経系において神経伝達物質として作用することが実証されてきた。脳の多くの領域で発現しており、特に大脳皮質、海馬、扁桃体、視床下部において高度に発現している。[R]
15. ホモシステインを減少させる
概要
ホモシステインは、メチオニン代謝サイクルでアミノ酸メチオニンからシステインを生合成する際に必須の中間代謝物(含硫アミノ酸)。
ホモシステインは毒性作用をもち、血中の高いホモシステイン濃度は、心血管疾患の危険因子として知られている。血管内皮細胞へも影響があるため、血管と関与する血管性認知症の危険因子としても考えられている。

www.ncbi.nlm.nih.gov/pubmed/27973419
高ホモシステインによるアルツハイマー病リスク
高ホモシステインは血管性認知症だけでなく、アルツハイマー病の危険因子としても、これまで多くの研究が行われてきた。ホモシステインレベルが14μMより高いと、アルツハイマー病の発症リスクはほぼ倍増する。[R]
相反する証拠もあり、ホモシステインがアルツハイマー病のリスク因子であるのか、単なるバイオマーカーにすぎないのかは依然として議論の余地がある。[R]
16.PP2A活性を高める
プロテインホスファターゼ2A(PP2A)
PP2Aは、すべてのSer/Thrホスファターゼの中で最も広い特異性を示し、真核細胞に広く一般的に存在するヘテロ三量体タンパク質。
主に代謝調節、シグナル伝達、DNA複製・転写、細胞増殖などの広い細胞機能に関与しており、PP2Aの機能低下はアルツハイマー病と関連する。
アルツハイマー病におけるPP2A
PP2Aの機能不全は、タウの過剰リン酸化、アミロイド形成およびシナプス欠損に関連している。
PP2Aの調節因子およびPP2A触媒活性の変化、サブユニットの発現、メチル化および/またはリン酸化が、アルツハイマー病患者の脳領域で生じていることが報告されている。
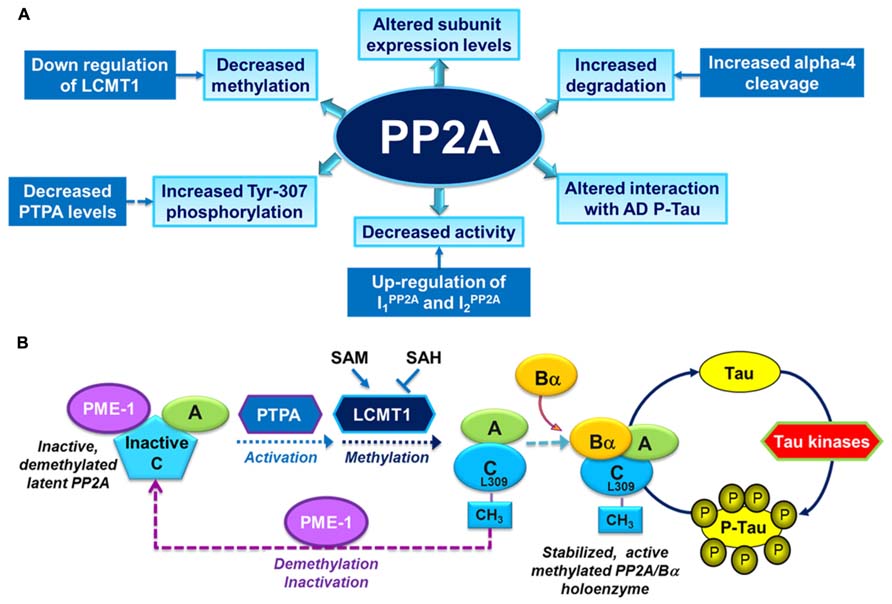
17. リン酸化タウタンパク質を減らす
アルツハイマー病におけるタウタンパク質の病態生理学的役割は、実はまだよく理解されていない。タウ凝集体の形成と沈着がアルツハイマー病の重大な事象であることが、これまでの大量の関連研究から示唆されている。
タウの過剰リン酸化
タウは健常者の脳においてもある程度リン酸化されるが、アルツハイマー病の初期段階でタウが凝集する前に過剰にリン酸化される。アルツハイマー病の進行期には、タウのほとんどのリン酸化部位がリン酸化され、病理学的タウ凝集体は、生理学的タウよりも3倍高くリン酸化される。
生理学的な応答からの逸脱
アルツハイマー病初期において起こる過剰リン酸化は、非生理学的な作用が生じたというよりも生理学的な応答の過大な結果を反映している可能性がある。
タウの過剰リン酸化は、おそらくタウプロテインキナーゼとタウホスファターゼ活性の間の不均衡から生じる。
神経原線維変化の形成にはタウの過剰リン酸化が大きく影響を与えると考えられている。
タウ凝集の多段階プロセス
生理学的に機能しているタウが病理学的タウの凝集物に変化するには、多段階のプロセスが必要であると考えられている。
微小管からのタウの脱離には、タウのリン酸化、アミロイド毒性、酸化ストレス、など多くのメカニズムによって促進される。
18. 食作用指数を増加させる
食作用(ファゴサイトーシス)
食作用とは、体内に侵入した病原微生物を排除するための、重要な生体防御機構のひとつ。
一般的には単球やマクロファージ、好中球、などの細胞が、死んだ細胞やバクテリア、ウイルス、寄生虫などのような大きな対象物を取り込み分解する過程をさす。封じ込められた後、そのままリソソームと合体しそれらを加水分解酵素によって消化され細胞質に放出される。
ミクログリアの食作用
ミクログリアは食作用のクリアランスを促進することで、脳の保護者として機能する。アルツハイマー病においては、ミクログリアの食作用(貪食作用)がアミロイドβのクリアランスを促進し、複数の機序によりアミロイドの沈着を減少させることが強く示唆されている。[R]
グリア細胞の炎症応答
一方で、グリア細胞は、アルツハイマー病、パーキンソン病と関連するアミロイドβ、αシヌクレイン、ニューロメラニン、プリオンタンパク質などによって炎症誘発性のグリア応答を引き起こすことが考えられる。
グリア細胞はこれらの物質を取り込んで、効率的に分解するための機構を有していないことがあり、過負荷により炎症応答が増加し食作用の低下につながる可能性がある。[R]
アミロイドβ原繊維によるグリア炎症性応答
アミロイドβ原繊維は可溶性オリゴマーよりも低毒性であることが示されているが、アミロイドβの原繊維形態がグリア炎症性応答を引き起こし二次的に神経毒性を引き起こす可能性がある。
アミロイドβオリゴマーによる食作用の妨害
アミロイドβオリゴマーが強力な炎症応答を誘導し、続いてミクログリアの食作用およびアミロイドβ原繊維のクリアランスを妨害する。[R]
ミクログリアによるタウの伝播
ミクログリアはタウ病理の伝播にも密接に関与していることも示されている。(ミクログリアがタウ病理に寄与するの原因が、病理学的タウを食作用しないことによってなのか、またはタウ病態を悪化させる因子を放出することによってなのかは不明のままである。)[R]
グリア炎症応答によるαシヌクレインの蓄積
アストロサイトのαシヌクレイン暴露は、用量依存的に炎症応答を引き起こす。グリア細胞の食作用により細胞内へ蓄積し炎症が増大することが示唆される。[R]
アストロサイトの食作用
アストロサイトがアミロイドβ42に結合して分解することで、ADマウスのアミロイドβレベルを低下させる。[R]
19. インスリン感受性を高め最適化
![]() インスリン感受性、インスリン分泌、インスリンシグナル伝達の最適化
インスリン感受性、インスリン分泌、インスリンシグナル伝達の最適化
20.レプチン感受性を高める
レプチンは、全身の脂肪細胞で作られ、視床下部内で作用することで食欲を抑制し、体脂肪を減少させる脂肪蓄積の調節ホルモンとして知られている。
しかし、レプチンの作用部位は視床下部だけではなく、また食欲だけがレプチンの生物学的効果ではないことが明らかになってきている。
レプチンは、脳の多くの領域に作用する多面性をもつホルモンであり、食欲、モチベーション、学習、記憶、認知機能、神経保護、生殖、成長、代謝、エネルギー消費など多くの影響を与える。
21.軸索輸送を改善
軸索輸送(軸索原形質輸送)を改善
軸索輸送とは、神経細胞の軸索の中で神経伝達物質やタンパク質などを移動する機能のこと。アルツハイマー病を含め多くの神経変性疾患は、軸索輸送の突然変異と関連している。
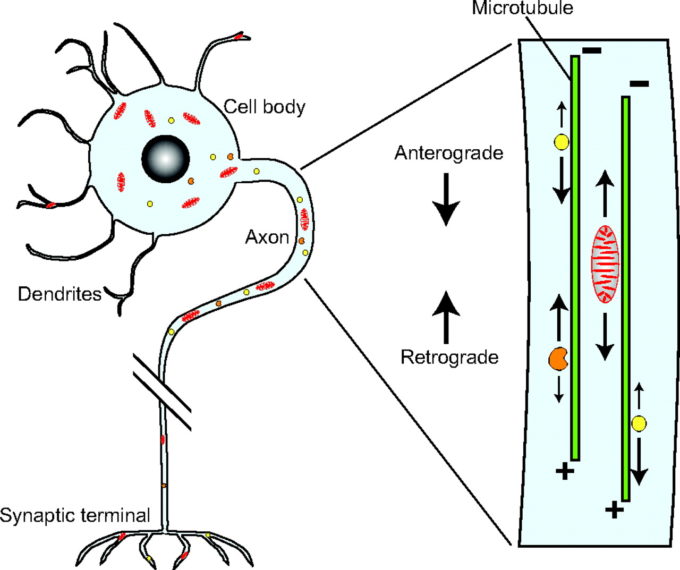
22. ミトコンドリア機能、生合成の増強
神経細胞ミトコンドリアの役割
神経細胞のミトコンドリアはATP産生、細胞内Ca2+シグナリング、活性酸素の生成などに加えて、神経伝達、シナプス可塑性、神経幹細胞の調節などといった重要な役割にも関わる。[R][R]
神経細胞におけるミトコンドリアの重要性
脳は体重の2%の重さに過ぎないが、酸素消費は20%を占める。これは主にニューロンのエネルギー(活動電位の生成に必要なイオン勾配の維持)に用いられる。
そのため脳内の細胞(細胞体、樹上突起、軸索、シナプス末端)は高い代謝速度を有し、酸素とエネルギーの供給が安定的に維持されることを強く必要とする。
ミトコンドリアはそのエネルギー供給に直接的に関わるため、ミトコンドリア機能が変化すると神経細胞の生存と機能に大きな影響を与えうる。[R]
ミトコンドリアカスケード仮説
2004年にアルツハイマー病の「ミトコンドリアカスケード仮説」が提案された。加齢によるアルツハイマー病リスクの増加は、アミロイドカスケード仮説では説明がつきにくことなどの背景のもと誕生した。[R]
この仮説によるとミトコンドリア機能は遺伝子をベースラインとし、年齢とともに衰え、環境因子によってその影響が決定される。最終的にミトコンドリア機能の顕著な低下がアルツハイマー病に特異的な病理をもたらすというもの。
23. 酸化的損傷を軽減し活性酸素種を最適化
アルツハイマー病の主要な神経変性要因として考えられているアミロイドβオリゴマーは、酸化ストレスによって始まり増強される。
体内では酸化物質と抗酸化酵素が拮抗しあうことで、正常なヒトの代謝が支えられている。
アルツハイマー病患者の体内では抗酸化酵素が減少することで、活性酸素の一種であるフリーラジカルが優勢となって拮抗関係が崩れている可能性がある。
酸化ストレスはこの不均衡により引き起こされる。
活性酸素に弱い脳
脳は高い酸素消費率によって多くの活性酸素を生成する臓器。
また脳は酸化されやすい脂質を主要な材料として構成されていることから、活性酸素の影響を著しく受けやすい。
特に脳の膜リン脂質はフリーラジカルに脆弱な多価不飽和脂肪酸で構成されており、アルツハイマー病患者の脳において脂質過酸化反応の増加により変性が見出される。[R][R]
24. コリン作動性神経伝達を高める
コリン作動性とは、神経伝達因子の一つであるアセチルコリンを放出するコリン作動性ニューロンの総称。コリン作動性ニューロンは、中枢神経系に広く分布しており、その中でもよく研究されているのが前脳基底部および脳幹にある投射ニューロンで、睡眠からの覚醒や視覚における働きが知られている。
ja.wikipedia.org/wiki/アセチルコリン受容体
25. シナプトブラスティックを増やす
シナプス発芽シグナル伝達を増やす
APP依存性受容体仮説
APPは分子スイッチの役割を果たしており、APPの切断のされ方によってシナプスの維持と破壊のバランス(恒常性)が保たれることによってシナプス可塑性が維持される、ブレデセン博士によって提唱された仮説
シナプトブラスティック
シナプトブラスティク/synaptoblastic(シナプス発芽シグナル伝達)とは、APP依存性受容体仮説においてシナプスの維持に傾く機能をさす。アルツハイマー病ではこのAPPの維持と破壊のバランスが崩れており、シナプトブラスティック・シグナルを増加させる因子を増加させる必要がある。
トロピセトロン
トロピセトロンは、スクリーニングにおいて同定された、栄養性の神経突起伸長ペプチドsAPPαと抗栄養性神経突起沈着ペプチドAβとの比を増加させる候補。
トロピセトロンは、同一の用量で直接比較したところ、aAPPα/アミロイドβ42比率のより大きな改善を示し、ADマウスのAPP不均衡を逆転させた。
www.ncbi.nlm.nih.gov/pubmed/24389031/
ランダム化比較試験 精神分裂症患者へのトロピセトロン治療による認知機能の改善
www.ncbi.nlm.nih.gov/pubmed/22952075/
26. シナプトクラスティックを減らす
シナプトクラスティック/synaptoclastic(シナプス発芽シグナル伝達)とは、APP受容体仮説において、シナプスの破壊に傾ける機能をさす。
アルツハイマー病ではこのAPPの維持と破壊のバランスが崩れており、フィードバックループにより過剰となっているシナプトクラスティック・シグナル伝達を減少させる必要がある。
27. LTP(長期増強)を改善
長期増強(LTP)とは、神経細胞を同時刺激することにより神経細胞間の信号伝達効率が持続的に向上する現象のこと。海馬の記憶形成の基本的な仕組み。
神経細胞はシナプス結合を介して信号伝達しており、記憶はこのシナプスに貯えられていると信じられており、長期増強は学習と記憶の根底にある主要な細胞学的メカニズムの1つであると広く考えられている。
LTP増強
- ベルベリン
- Rリポ酸
- メラトニン
- ルテオリン
- パナックスジンセン
- アシュワガンダ
- フィセチン
- グリシン
- フォルスコリン
- タウリン
28. エストラジオールの最適化
女性の卵巣で作られる女性ホルモンでエストロン(E1)、エストラジオール(E2)、エストリオール(E3)、エステロール(E4)とあるエストロゲンのうちのひとつ。
エストラジオールはエストロゲンの中でもっとも強い生理活性をもつ。
29. プロゲステロンの最適化
プロゲステロンは主に女性の卵巣、男性の精巣および副腎皮質によって合成されるステロイドホルモン。一般的には男性よりも女性のプロゲステロンレベルが高い。
プロゲステロン受容体は成長中の脳および成人脳に広く分布している。
30. E2/P4の比率の最適化
E2/P4、エストラジオールとプロゲステロンの比率
エストラジオールとプロゲステロンは脳の保護効果をもち、認知機能の改善に有益性がある。そして分子レベルでのバランスを保ち、アルツハイマー病をコントロールする。そのためエストロゲンは、アルツハイマー病の潜在的な治療方法となる可能性をもつ。
一方でエストロゲン投与(HRT)は、プロゲステロンのバランスを失うことで、子宮癌、乳癌の可能性を高める可能性がある。
31. fT3,fT4の最適化
T3、T4は甲状腺から分泌され、ほぼすべての細胞に作用して細胞の代謝率を上昇させる働きを持つホルモン。
タンパク質合成、炭水化物、脂質代謝の調節、成長ホルモンとの相互作用、神経の成熟を調節、アドレナリンなどのカテコールアミンの感受性を高め、ビタミンの代謝を刺激する。
甲状腺ホルモンは多くの認知機能低下を抱える人々で、準最適にある。主に活動する甲状腺ホルモンはT3。しかし、一般的にはT3へと変換されたりされなかったりすることのあるT4が治療対象となる。
32. TSHの最適化
TSH(甲状腺刺激ホルモン)の最適化
ja.wikipedia.org/wiki/甲状腺刺激ホルモン
下垂体前葉から分泌され,
ヒトの認知能力を維持する上で、正常な甲状腺機能は不可欠であり、甲状腺機能と認知機能の関係は数十年にわたって研究がなされており、TSHとMCI(軽度認知障害)の逆相関は一貫して実証されてきた。[R]
33. プレグネノロンの最適化
グランドマザーホルモンと呼ばれ、エストロゲン、テストステロン、コルチゾールなどあらゆるホルモンの元となるマスターステロイド。
老化、アルツハイマー病と関連して記憶低下の原因となる因子のひとつ。
プレグネノロンは認知機能障害、特にアルツハイマー病において脳の可塑性と関わる。
プレグネノロンが海馬神経新生の調節において、神経ステロイドの役割を果たしている。
プレグネノロン硫酸の脳内濃度と認知能力には有意な相関がある。
リコード法3型では、血清プレグネノロンの低値が示唆されている。
34. テストステロンの最適化
テストステロンはアルツハイマー病のβアミロイドペプチドのニューロン分泌を減少させる。
閉経後の女性においてもテストステロンは低下するため、エストロゲン補充療法にアンドロゲンを加えることによって女性のアルツハイマー病の発症をより強く防ぐ可能性がある。
www.ncbi.nlm.nih.gov/pmc/articles/PMC15568/
35. コルチゾールの最適化
アルツハイマー病患者の抹消および中枢中枢神経系のコルチゾールレベルの上昇が報告されており、視床下部 – 脳下垂体 – 副腎(HPA)軸の機能不全を反映する可能性がある。
脳の高いコルチゾール濃度の暴露、疾患の進行および認知低下を加速させる可能性がある。
ベースラインの高いCSFコルチゾールレベルは、MCIからアルツハイマー病への進行の速い臨床的悪化および認知低下と関連していた。
これらの知見は、HPA軸調節不全がMCI段階で起こり、疾患の進行および認知低下を加速させる可能性があることを示唆している。[R]
36. DHEAを増強する
DHEA(デヒドロエピアンドロステロン)
DHEA-Sの産生は副腎に加えて脳内でも合成され、脳の機能、発達に関わる役割をもつことが示唆されている。
DHEAは血漿よりも脳内で高い濃度を保ち、個人差があることがわかっている。またDHEA-Sも脳内でDHEAから合成されている可能性がある。
脳において、DHEA-Sは一般にGABA-A受容体に非競合的アンタゴニストとして作用する。DHEA-SはNMDA受容体のポジティブなアロステリックモジュレーターとして作用する可能性がある。
低濃度のDHEA-Sの低濃度は神経保護性でありえるが、高濃度のDHEAは神経保護効果をもつこともあれば神経毒性ともなりうる。
DHEA-Sの神経新生および可塑性への役割は、BDNFレベルへの影響をおよぼすことによる。

37. インスリン分泌、シグナリングの最適化
アルツハイマー病におけるインスリン
インスリンシグナル伝達と関連するタンパク質は、海馬や側頭葉などアルツハイマー病と関連する多くの脳領域で検出されている。
インスリンシグナル伝達はアルツハイマー病患者の脳組織で損なわれており、インスリン作用の改善がアルツハイマー病の認知機能改善のための治療標的として浮上している。
![]() インスリン感受性、インスリン分泌、インスリンシグナル伝達の最適化
インスリン感受性、インスリン分泌、インスリンシグナル伝達の最適化
38. PPARγの活性化
(peroxisome proliferator-activated receptor gamma)
核内受容体PPARγは、脂肪細胞分化のマスターレギュレーターとして知られ、脂質代謝を調整することで摂取した脂肪を消費したり蓄えたりといった制御を行う
また、グルコース代謝としても重要な役割をもち、2型糖尿病治療薬(チリアゾン誘導体)の標的として知られる。
アルツハイマー病、多発性硬化症、筋萎縮性側索硬化症、パーキンソン病などの神経変性疾患ではPPARγの機能低下が知られており、PPARγを標的にしたアルツハイマー病治療への検討や研究がいくつかある。(糖尿病薬ピオグリタゾンなど)
PPARの作用により末梢マクロファージおよびヒト自己免疫疾患のいくつかのモデルにおける炎症反応を抑制できるという研究が存在する。
非ステロイド性抗炎症薬(NSAID)が、アルツハイマー病の発症を遅延させ、アルツハイマー病を発症リスクを低減する可能性があると考えられているが、NASIDはPPARγも直接的に活性化することから、NSAIDのアルツハイマー病保護効果はPPARγの活性が関連している仮説も提案されている。[R]
39. 炎症を減少させる
炎症関連のアルツハイマー病基礎研究
現在炎症がアルツハイマー病を引き起こす要因となる証拠は基礎研究から提出されており、臨床研究においてはまだ決定的ではない。ただし抗炎症薬であるNSAIDsが、アルツハイマー病の発症と進行を遅らせる可能性があることは示されている。[R]
他の炎症とは異なるアルツハイマー病の炎症メカニズム
だが、アルツハイマー病と関連する炎症に関しては、多くの誤解や間違いがなされている。
リンパ球や単球の関与によって中枢神経系内から炎症が生じるという多発性硬化症や中枢神経系炎症性障害において生じる炎症メカニズムは、アルツハイマー病の炎症についてはあてはまらない。
アルツハイマー病の発症過程においてどのように炎症が生じるのか、完全な解明はされておらずいくつかの未解決問題も残っている。
アルツハイマー病炎症因子の複雑な相互作用
アルツハイマー病の炎症研究は、サイトカイン、補体、ケモカイン、成長因子、酸化ストレス、ミクログリア活性化、アストロサイトの反応性、または他の特異的な領域のグループに、それぞれ区画化されている。
おそらく、もっとも重要な点は、これらが高度なレベルにおいて相互作用しており、お互いが分離して炎症が生じることはありそうにないということにある。[R]
40. レゾルビンを増加させる
レゾルビンとは、人体内でω-3脂肪酸のエイコサペンタエン酸とドコサヘキサエン酸から作られる化合物。特にアスピリンの存在下で、シクロオキシゲナーゼ-2により作られる。
実験的な証拠から、レゾルビンは炎症細胞や炎症化学物質の生成と輸送を阻害することで細胞の炎症を抑えることが示唆されている。
その他にも、炎症痛の軽減等、治療上の効果を持つ生理作用が報告されている。
レゾルビンD1
オメガ3脂肪酸サプリメント
軽度認知症患者のオメガ3脂肪酸サプリメントの摂取は、アミロイドβの食作用を増やし、レゾルビンD1を増加させる。[R]
レゾルビンD1、D2はDHAに含まれる
![]() 抗炎症性脂質メディエーター(SPM)の神経保護効果/Specialized pro-resolving lipid mediator
抗炎症性脂質メディエーター(SPM)の神経保護効果/Specialized pro-resolving lipid mediator
41. デトックス、解毒
デトックスする上でのヒントは、あなたがどこで毒性に曝露したか、その歴史を知ることから始まる。
「アルツハイマー病 真実と終焉」より
非常に多くの毒性が認知機能の低下に関与しており、デトックスの実行はおそらくReCODEの中でもっとも難しいプロトコル。幸いにも食事によるデトックスに関しては、多くの治療方法が存在する。
関連記事
![]() CIRS(慢性炎症反応症候群)カビ毒治療プロトコル 14ステージ
CIRS(慢性炎症反応症候群)カビ毒治療プロトコル 14ステージ
リコード法 毒素に関する問診票
- 知覚麻痺、無感覚症がありますか?あるとしたら、何度ありましたか?
- 水銀を多く含むマグロやメカジキ、サメなどの魚を食べていますか?どれくらい?
- 自宅や車、職場がカビ毒で汚染されていますか?
- 加工食品、オーガニックではない食品を食べていますか?
- 何か薬を摂っていますか?
- PPIs、胃液が口内に逆流したりしますか?
- お酒、アルコールをどれくらい飲みますか?
- 化粧をしますか?ヘアスプレーや制汗剤を使いますか?
- どれくらい汗をかきますか?(毒を除去する重要な経路)
- 便秘はありますか?(腸管運動は毒を除去するもうひとつの経路)
- 一日に少なくとも1リットルの浄水を飲みますか?
42.脳血流を改善する
43. cAMPを増やす
サイクリックAMP(環状アデノシン一リン酸)およびサイクリックGMP(環状グアノシン一リン酸)は、細胞の情報伝達においてセカンドメッセンジャーとしての役割をもつ重要な親水性環状ヌクレオチド。
cAMPおよびcGMPはいずれも、脳においてより顕著に存在し、脳内で生じる多様な生物学的応答に関与する。
役割
ニューロンの活動の制御、代謝プロセスの制御、化学的および電気的シグナル伝達カスケードを容易にする。
また、イオンチャネルおよびいくつかのプロテインキナーゼの活性化もする。
cAMPとcAMPの増加により脳の神経回路のシグナル伝達が改善を示す可能性がある。
44. 還元型グルタチオン(GSH)を増やす
グルタチオンのアルツハイマー病と関連する効果・作用機序
- 解毒
- ミトコンドリア機能を高める
- 酸化ストレスからの保護
- 水銀、有害金属からの保護
- アルコールからの保護
- 有機汚染物質(POPs)からの保護
45. シナプスの材料を供与
シナプス形成に必要な3つの栄養素
- ウリジン
- DHA
- EPA
www.ncbi.nlm.nih.gov/pubmed/29031899
シナプス形成に影響を与える栄養素の組み合わせ
- ウリジン
- オメガ3脂肪酸(DHA)
- コリン
www.ncbi.nlm.nih.gov/pubmed/24763080
栄養素を用いたアルツハイマー病のシナプス機能障害治療
ドコサヘキサエン酸、エイコサペンタエン酸、コリン、リン脂質、葉酸、ビタミンB12、B6、C、E、セレン
www.ncbi.nlm.nih.gov/pubmed/23985420
ウリジン・DHA
シナプス形成は、ウリジンおよびDHA(脳ホスファチドの循環前駆体)の経口投与によって増強される。[R]
ウリジンとDHAを与えることにより、リン脂質およびシナプスタンパク質の合成を促進することにより、シナプス形成を制御するニューロンプログラムが誘発される可能性がある。
食品中(DNAの中)に含まれるウリジンは生物学的に利用が難しい。食品で摂取するDHA、コリンの量では、シナプス形成を促進するのに必要十分な血中濃度を維持することは難しいかも。
マグネシウム
マグネシウムスレオネートによる脳内のマグネシウム濃度上昇により、シナプスの損失を防ぎ、ADマウスの認知障害を逆転させた。[R]
DHA・アスピリン
アルツハイマーの疾患は、シナプス障害?
DHAとアスピリンの摂取が、アルツハイマー病の進行を遅くする可能性がある。[R]
46.すべての金属を最適化する
バイオメタル(生体金属)、有害金属の蓄積は、アルツハイマー病、パーキンソン病、ハンチントン病を含む多くの神経変性疾患に関与し共通する特徴でもある。
金属バランスの不均衡による神経毒性には以下の要因と関連しており、カスケード作用により細胞アポトーシス、神経変性を引き起こす。[R]
- 酵素活性の低下
- 中枢神経系でのタンパク質凝集
- 中枢神経系での酸化ストレスの増加
バイオメタル
有害金属
47. GABAを増加させる
GABAは中枢神経系における主要な抑制性神経伝達物質。
GABA作動系の機能不全が認知障害に寄与していることが示されており、アルツハイマー病の重篤な症例ではGABAレベルの有意な低下が報告されている。
48. ビタミンDシグナリングを増やす
メタアナリシス アルツハイマー病患者の低血性ビタミンD濃度[R]
一般的には良くないとされる紫外線B波もビタミンD合成に必要
午前10時から午後3時の日光で、少なくとも週に2回、5分から30分の間、日焼け止めクリームなしで、顔、手足、背中への日光浴で、十分な量のビタミンDが体内で生合成される。
49. SirT1を増やす
サーチュイン
サーチュイン(SIR)は、加齢関連疾患において有益な効果を示すNAD +依存性酵素。
哺乳動物の食物摂取と飢餓の適応を助けるストレス応答タンパク質でもある。
サーチュインは異なる酵素活性と機能からSirT1から7までが分類されている。
SirT1
SirT1は、アルツハイマー病において広く研究されている唯一のサーチュイン。
これまでの研究でSirT1はカロリー制限に対する適応応答に媒介することが示されている。
www.ncbi.nlm.nih.gov/pubmed/20226541/
アルツハイマー病に対するSirt1の保護効果
- グルコース産生(肝臓)
- 脂肪酸酸化(肝臓)
- コレステロール調節(肝臓)
- アディポカインレギュレーション(WAT)
- インスリン分泌(膵臓β細胞)
- 神経保護(脳)
- 細胞分化の調節
- ストレス耐性&アポトーシス制御
- カロリー制限のためのメディエーター
50. NF-kBを阻害
NF-κBは炎症、ストレス応答、感染応答、免疫応答、細胞分化、増殖、細胞死などにおいて中心的役割を果たす転写因子のひとつ。複雑なシグナル伝達経路のネットワークによって、非常に多様な因子からの刺激を集約的に受ける。
外因的には、ストレスや、重金属、紫外線、酸化LDL、さらには細菌やウイルス、電離放射線にも応答して活性され多種多様な遺伝子を制御する。
51. テロメアの長さを増やす
これまでの臨床研究のデータでは、短いテロメア長は自己免疫疾患、代謝性疾患、癌、脳卒中、神経変性疾患を含む多くの疾患の発症となる可能性が示唆されている。[R][R]
52.グリア性瘢痕を減少させる
グリア性瘢痕(神経膠瘢痕)とは、脳の損傷部にみられる治癒瘢痕巣。グリア瘢痕は損傷時に血液の炎症成分が、中枢神経などの健康な組織に伝播するのを防ぐ役割をもつ。
しかし、グリア瘢痕は軸索を再生するための第一障壁としても働く。軸索の成長は、グリア瘢痕で突然止まり、軸索の終末はジストロフィー(栄養失調による萎縮)を示す。
血液脳関門の破壊および、血清成分の中枢神経系へのリークはグリア瘢痕形成に大きく関与している。IL-1、TGF-β、血液由来の炎症因子などが潜在的な誘引ともなっている。
53. 幹細胞を介した脳の修復
外因性幹細胞による脳の修復(幹細胞移植)
幹細胞によるアルツハイマー病治療の基礎的メカニズム[R]
- 移植細胞による神経栄養因子放出によるパラクリン効果
- 移植細胞による免疫調節効果
- 移植細胞による罹患細胞の置換
- 内因性細胞の増殖
アルツハイマー病患者へのヒト臍帯由来MSC試験 安全性の評価
アルツハイマー病患者へのヒト臍帯血由来間葉系幹細胞移植 有効試験
成長因子による神経前駆細胞の活性
成長因子の投与により、神経前駆細胞の活性化が増強され、脳組織の新しい形成および脳卒中モデルマウスの機能回復に寄与することが実証されている。[R]
BDNF
ADマウスの神経幹細胞移植による海馬シナプスの増強および認知機能の改善は、BDNFによって媒介される。[R]
免疫応答の神経幹細胞への影響
神経幹細胞は、中枢神経系の発達および修復に主要な役割を果たす。免疫応答はその神経幹細胞の機能に影響をおよぼす役割をもつ変数の候補のひとつとして浮上している。
幹細胞の脳への投入により脳がニューラルネットワークの再生の基質として幹細胞を効率的に利用する可能性は低い。
障害を受けた中枢神経系内の内因的な阻害要因を積極的に克服する介入を行わなければ、ニューロンを新たに置き換えて生成することは困難であろう。[R]

ミクログリア活性による免疫シグナル
ミクログリアは多数の免疫メディエーターを産生する。この産生された免疫シグナルが神経幹細胞の活性を混乱させることが多くの研究により示されている。[R][R][R][R][R][R]
慢性ストレス
慢性ストレスは、神経幹細胞媒介の海馬神経新生を阻害する。[R]

