Contents
18F-FDG brain PET hypometabolism in patients with long COVID
www.ncbi.nlm.nih.gov/pmc/articles/PMC7837643/
2021年1月26日
要旨
目的
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の世界的なパンデミックに関連して、COVID-19から明らかに回復した後に機能的な訴えを報告する患者がいる。この臨床症状は “long COVID “と呼ばれている。本研究では,生物学的にSARS-CoV-2感染が確認され,初感染から少なくとも3週間後に機能的愁訴が持続した同センターのLong-COVID患者を対象に,18F-FDG脳PETを用いたレトロスペクティブ解析を行った。
方法
Long-COVID35名の患者のPETスキャンを全脳ボクセル解析を用いて比較し、脳代謝低下を特徴づけるために、年齢と性別をコントロールした44名の健常者のローカルデータベースと比較した。この代謝プロファイルの個々の関連性を評価し、患者と健常者を分類した。最後に、PET異常値を患者の特徴や機能的愁訴と比較して探索的に検討した。
結果
健常者と比較して、Long-COVID患者では、嗅覚回を含む両側の直回・眼窩回、扁桃体と海馬を含む右側頭葉(右視床まで伸びている)両側の橋/髄質脳幹、両側の小脳(p-voxel < 0.001 補正なし、p-cluster < 0.05 FWE 補正あり)で代謝低下が認められた。これらの代謝クラスターは、患者と健常者を区別するために高い識別力を持っていた(100%正しい識別)。これらの代謝低下の集団は、より多くの機能的愁訴(脳幹クラスターおよび小脳クラスター)と有意に関連しており、すべてが特定の症状(低汗症/無汗症、記憶/認知障害、疼痛および不眠症)の発生と関連していた(p<0.05)。より予備的な分析では、嗅覚回を含む前頭前野クラスターの代謝は、高血圧に対してACE薬による治療を受けた7人の患者では悪化し(p = 0.032)感染段階で経鼻脱炭酸スプレーを使用した3人の患者では改善していた(p < 0.001)。
結論
本研究では、生物学的にSARS-CoV-2が確認されたLong-COVID患者において、最初の感染症状から3週間以上経過しても機能的な訴えが持続する脳PET低代謝のプロファイルを明らかにした。これらの代謝低下は患者の症状と関連しており、これらの患者を特定し、潜在的に追跡するためのバイオマーカーとしての価値がある。また、嗅覚回を含む前頭前野の代謝低下は、高血圧患者ではACE薬と関連していると考えられ、鼻腔内の脱炭酸スプレーを使用している患者では嗅覚領域の代謝が改善していることから、嗅覚領域のゲートウェイとしてACE受容体が関与している可能性が示唆された。
キーワード 18F-FDG、PET、SARS-CoV-2,COVID-19,無呼吸、ストレス、不定愁訴、記憶力、疲労、アンジオテンシン変換酵素、Long-COVID、自律神経失調症
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染症が世界的にパンデミックしている中、COVID-19から明らかに回復した後の機能的愁訴として、疲労、呼吸困難、低呼吸・無呼吸、嚥下障害・老年期障害、記憶・認知障害、睡眠変化、疼痛症候群などが報告されている患者がいる[1-3]。この臨床症状は “long COVID “と呼ばれており、研究が急務である[4, 5]。この疾患は,嗅球からのSARS-CoV-2の神経刺激に伴う脳の炎症と関連している可能性が示唆されている[6, 7].この点に関して、我々は以前、SARS-CoV-2感染が確定診断された2人の患者の臨床例を報告している。このように、18F-FDG PETの代謝低下は、Long-COVIDの脳の定量的バイオマーカーとなりうることが示唆された[8-10]。
ここでは、生物学的にSARS-CoV-2感染が確認され、初感染から少なくとも3週間後に機能的愁訴が持続した同センターのLong-COVID患者を対象に、18F-FDG脳PETのレトロスペクティブ解析を行った。我々は、Long-COVID患者における持続的な機能的愁訴は脳の機能的病変と関連しており、この病変は18F-FDG PETを用いて同定できるという仮説を立てた。これに関連して、PETスキャンを全脳ボクセルベースの解析を用いて、年齢と性別をコントロールした健常者のローカルデータベースと比較し、脳代謝低下を特徴付けた。この代謝プロファイルの個々の関連性を評価し、患者と健常者を分類した。最後に、より予備的な方法として、PET異常は患者の特徴や機能的な訴えと探索的に相関していた。
研究方法
対象者
2020年5月18日から 2020年9月30日までの間に、Long-COVIDを有する連続した45人の患者を、以下の基準で当センターにレトロスペクティブに組み入れた。SARS-CoV-2感染が確認された18歳以上の成人で、持続的な疲労のためにpost-COVIDの医学的評価を受け、神経学的原因の可能性のある機能的愁訴(呼吸困難、低呼吸/無呼吸、味覚障害/老年期障害、記憶/認知障害、不眠、疼痛)のために18F-FDG脳PETを初回感染から少なくとも3週間後に実施している(W3+)。このW3+のLong-COVIDの定義は、フランス患者協会の定義と一致している(https://www.apresj20.fr/)。CT または MRI で脳病変を認めた患者は除外した(SARS-CoV-2 感染に伴う脳症・脳炎を認めた患者 2 例、後窩奇形を認めた患者 1 例)。SARS-CoV-2感染が確定診断されていない患者、当センターでフォローアップを受けていない患者、SARS-CoV-2感染以前に神経学的・精神医学的な前歴や症状があった患者も除外した。確定症例の定義は,臨床的特徴(発熱,咳嗽,頭痛,鼻炎,咽頭炎,腰痛,筋肉痛,関節痛,下痢,下痢,低呼吸,嚥下障害のうちの1つまたは複数の項目)と,症状発生時のrt-PCRまたは同一微生物科での血清検査(ELISAまたは免疫測定)による生物学的検査が陽性であった場合とした。その結果、脳病変を有する3人の患者(合計10人)に加えて7人の患者が除外され、最終的に35人の患者が解析対象となった。
以下の変数を収集した。年齢、性別、初期症状で定義されたSARS-CoV-2感染0日目、PET検査の実施日(同じ医師による放射性医薬品投与前の問診で得られた主観的愁訴の臨床評価との併用)BMI(body mass index)。糖尿病状態(y/n)高血圧(y/n)現在の喫煙状態(y/n)集中治療室入院(y/n)機械換気(y/n)C反応性蛋白の初期値、初期臨床一般状態(NEWSスコア、下記参照)初期CT肺重症度スコア(2つのグレードを使用。正常/小 vs 中/重症の2つのグレードを使用)ヒドロキシクロロキンによる治療(y/n)抗生物質による治療(y/n)アンジオテンシン変換酵素を標的とした治療(ACE阻害薬、アンジオテンシンII受容体拮抗薬を含むACE薬)鼻用脱炭酸スプレーによる初期治療(y/n)主観的愁訴(以下の各症状についてW3+時のy/n)。呼吸困難、低呼吸・無呼吸、geusia・ageusia、記憶・認知愁訴、不眠、疼痛)W3+時の心的外傷後ストレス障害(PTSD)チェックリストスケール(PCLS)スコア。これらの項目のうち7.3%についてはデータが欠落していた。より詳細には、一般状態の臨床的重症度は、年齢、呼吸数、酸素飽和度、補助酸素、収縮期血圧、心拍数、意識、体温から得られるスコアを含む、COVID-19患者に適応した全国早期警戒スコア(NEWS)[11]を用いて評価された。合計スコアは、低(スコア1~4)中(スコア5~6)または高(スコア7以上)のリスク等級を提供する。
本データ収集は、フランスおよび欧州の規定に基づくインフォームドコンセント以外の倫理的承認要件はなく、レトロスペクティブなものであった。本研究は、GPDR(一般データ保護規則)の要件を尊重しており、以下の参照番号で登録されている。PADS20-296 に登録されている。
神経学的/精神医学的症状や前歴を持たず、脳のMRIが正常で、当院の診療科で18F-FDG脳PETを受けた健常者44人を、60人の被験者を含む以前のプロジェクトから選び、SARS-CoV-2患者(患者55.06歳±11.22歳 vs 健常者55.11歳±14.07歳、女性の患者57.1% vs 健常者56.8%、p値>0.9)と年齢および性別を一致させた。この健常対照者の局所PETデータベースは、SARS-CoV-2発生前に収集された。
18F-FDG PETイメージングおよび処理
18F-FDG脳PETスキャンは、欧州のガイドラインに準拠した取得プロトコルを用いて、安静時、空腹時、血糖値が正常に制御された空腹時、少なくとも4時間、PET/CT統合カメラGeneral Electric社(Waukesha, WI)を使用して、注射後30分に15分ごとに150MBqを静脈内投与した後に取得された。画像は、順序付き部分集合期待値最大化アルゴリズムを用いて192×192の行列で再構成し、CT伝染スキャンを用いて減衰を補正した。
全脳統計解析はSPM8ソフトウェア(Wellcome Department of Cognitive Neurology, University College, London, UK)を用いてボクセルレベルで行い、まず、年齢と性別を共変量とした健常者との比較を行い、患者の代謝低下のクラスターを同定した。次に、この代謝低下プロファイルの分類関連性を特定し(Long-COVID患者と健常者の間で)さらに探索的かつ予備的な方法で、クラスターの代謝値と、機能的愁訴や治療法を含む人口統計学的、臨床的、生物学的、放射線学的データとの間の平均的な差異や相関関係を探索した(下記参照)。詳細には、PET画像をモントリオール神経研究所(MNI)のアトラスに空間的に正規化した。得られたボクセルの寸法は2×2×2×2mmであった。次に、画像は、回状解剖学の個々のバリエーションをぼかし、S/N比を高めるために、ガウシアンフィルタ(半値最大で8mmの全幅)で平滑化された。解析は、白質と脳脊髄液を除いた大脳皮質全体、嗅球、視床と基底核、脳幹、小脳を含む、PickAtlas(https://www.nitrc.org/projects/wfu_pickatlas/)のマスクによって制限された。各PET検査では、全世界の代謝量が同じになるように比例スケーリングを行った。
統計解析
カテゴリ変数は数値とパーセンテージで、連続変数は平均値±SD(標準偏差)で示した。量的値の正規性は、Shapiro非正規性検定と視覚的正規性検証によって決定した。すべての値は正規分布に従った。差の有意性は、連続変数とカテゴリカル変数の間のStudentのt検定によって決定された。相関は、連続変数間のピアソンの検定によって決定された。カイ二乗検定は,サブグループ標本が厳密に5よりも高い場合には,カテゴリカル変数間で実行され,そうでない場合にはフィッシャーの厳密検定によって行われた。これらのさまざまな検定は,仮説(下記参照)に応じて両側検定または片側検定であった。統計分析は、SPSS Statistics for Windows, Version 21.0を用いて行った。Armonk, NY: IBM CorpおよびRバージョン4.0.2を用いて行った。
SPM(T) PETマップは、補正されていない高さの閾値(ボクセルレベルの有意性)がp < 0.001であり、クラスタレベルでの多重比較については、ファミリーワイズエラー(FWE)率を使用して、補正されたp値< 0.05で補正して得られた。FWE法を用いてボクセルに対して補正したp値<0.05のより制約の多い閾値での有意な所見は、二次的に指定した。代謝クラスターの値は、Long-COVIDを持つ患者と健常者を比較して見つけ、MARSBAR(http://marsbar.sourceforge.net/)を用いて領域の平均値を用いて個人レベルで抽出した。各クラスターの代謝値の片側スチューデント検定を患者と健常者の比較に適用し、Zスコアで示した。これらの代謝クラスターに基づいて、多変量分散分析(Wilks lambda)を行い、患者と健常者を個別に分類した。最後に、患者から得られた代謝クラスターを、他の収集データと比較して探索的に行った(多重比較のための補正なし)。詳細には、すべての連続変数(年齢、BMI、CRP、NEWSスコア、PCLSスコア、および最初の症状から 18F-FDG PETスキャンまでの遅延日数)を、ピアソン検定を用いて、クラスタの代謝値と相関させた。各クラスターの代謝値の平均差を、性別、W3+の愁訴の有無(呼吸困難、低汗・無呼吸、発汗・発汗障害、記憶・認知障害、疼痛、不眠症に分けて)糖尿病の状態に応じてStudentのt検定を用いて検定した。高血圧の状態/ACE薬(高血圧の患者はすべてACE薬で治療されていたので、我々のグループでも同じ値)集中治療室への入院歴、機械的人工呼吸の必要性、CT肺重症度スコア、初期治療(経鼻脱炭酸スプレー、ヒドロキシクロロキン、抗生物質)。これらの解析の統計的閾値は,メタボリズム低下と臨床的,生物学的,放射線学的異常とを結びつける仮説についてはp<0.05で片側,関係の方向性についての仮説(年齢,性別,遅延,経鼻脱炭酸スプレーの使用,現在の喫煙状況)がない場合には2側であった。
結果
Long-COVIDを有する患者の臨床的特徴
Long-COVIDを有する35人の含まれた患者の臨床的特徴を表11に詳述した。患者の平均年齢は55.06歳±11.22歳で、女性が57%(20/35)であった。注目すべきは、患者の29%が糖尿病(10/34)21%が高血圧(7/33)6%のみが活動的喫煙者(2/34)であった。感染症診断時のNEWS臨床スコアの中央値は4であり、低リスクグレードに相当し、39%の患者が集中治療室への入院を必要とし(12/31)16%の患者が機械的人工呼吸(5/31)を必要としていた。この段階では、CTスキャンを受けた30人中16人(53%)に中等度または重度の肺病変が認められ、71%の患者でCRP値が5mmol/L以上であった(20/28)。35人の患者(欠損データなし)のうち、86%が抗生物質による治療を受けており(30/35)74%がヒドロキシクロロキンによる治療を受けていた(26/35)。高血圧の患者(7/33)はすべてACEを標的とする薬剤で治療された(我々のサンプルではこれら、2つの変数について同じ値)。最後に、28 例中 3 例(11%)の患者が感染期に鼻腔内脱炭酸スプレーを使用した。全身性コルチコイドの投与を受けた患者はいなかった。
表1 Long-COVID患者さんの特徴
| 変数 | N 1 | 平均(SD)またはn(%) |
|---|---|---|
| 年齢 | 35 | 55.06(11.22) |
| セックス | 35 | |
| 女性 | 20(57) | |
| 男性 | 15(43) | |
| BMI | 35 | 28.25(4.82) |
| 高血圧 | 33 | 7(21) |
| 糖尿病 | 34 | 10(29) |
| 現在の喫煙状況 | 34 | 2(6) |
| 集中治療室での入院 | 31 | 12(39) |
| 機械的換気 | 31 | 5(16) |
| ニュース臨床スコア | 26 | 4.04(3.40) |
| CT肺重症度スコア | 30 | |
| 正常/最小 | 14(47) | |
| 中級/重度 | 16(53) | |
| CRP | 28 | 61.2(74.67) |
| ACE薬 | 33 | 7(21) |
| ヒドロキシクロロキン | 35 | 26(74) |
| 抗生物質 | 35 | 30(86) |
| 鼻うっ血除去剤スプレー | 28 | 3(11) |
| 嗅覚減退症/無嗅覚症W3 + | 35 | 10(29) |
| 味覚障害/味覚消失W3 + | 35 | 9(26) |
| 記憶/認知障害W3 + | 35 | 17(49) |
| 痛みW3 + | 35 | 23(66) |
| 呼吸困難W3 + | 35 | 28(80) |
| 不眠症W3 + | 35 | 16(46) |
| PCLSスコア | 21 | 35.81(14.87) |
| 初期症状とPETの間の遅延(日数) | 35 | 95.57(30.65) |
1.Nは利用可能な情報を持つ患者数
W3+では、35人の患者(データ欠損なし)のうち、呼吸困難は28人(80%)疼痛は23人(66%、8/23人に頭痛またはそれ以上の末梢の関節/筋肉痛に加えて胸部痛を伴う)記憶/認知機能の訴えは17人(49%)不眠は16人(46%)低呼吸/無呼吸は10人(29%)geusia/ageusiaは9人(26%)に報告されていた。PCLSの合計スコアは33%の患者で障害があった(7/21,スコアが44以上の患者)。PET スキャンを含む本評価から最初の感染症症状が発現するまでの期間の中央値は 97 日間(26~155 日間、欠損データなし)であった。
W3+での機能的愁訴の増加は、年齢が若く(r = – 0.443,p = 0.008;両側ピアソンの検定)最初の感染症状からの持続期間が長い(r = 0.375,p = 0.026;両側ピアソンの検定)と相関していた。
W3+の低汗症/無汗症の患者とW3+の記憶/認知愁訴の患者は、それぞれ若かった(それぞれ、p = 0.018,p = 0.007;両側スチューデントのt検定)。初期感染からの遅延は、W3+の疼痛を有する患者とW3+の記憶/認知的愁訴を有する患者で認められた(それぞれp = 0.048およびp = 0.010;両側Studentのt検定)。
PTSDに対するPCLSスコアは、W3+の記憶/認知愁訴を有する患者およびW3+のgeusia/ageusiaを有する患者では、より辛辣なものであった(p = 0.002およびp = 0.012;両側Studentのt検定)。
健常者と比較したLong-COVID患者のPET代謝プロファイル
健常者44名と比較して、Long-COVID患者では、4つのクラスター(図1および2):2):嗅覚回を含む両側直・眼窩回(BA11;T-max=9.80;k=767)扁桃体と海馬を含む右側頭葉(BA20;BA21;BA22;BA28)右視床に広がる海馬(BA20;BA22;BA21;BA28)の4つのクラスターを含む有意な代謝低下が認められた。 80; k = 767);扁桃体および右視床まで伸びる海馬を含む右側頭葉(BA20,BA21,BA22,BA28; T-max = 5.16; k = 3353);両側の橋/髄質脳幹(T-max = 6.84; k = 1485);両側の小脳(T-max = 5.18; k = 1969)。表2,2に詳述されているように、これら4つの領域についてボクセルレベルでのFWE補正を用いても有意な結果が得られたが、クラスターサイズは小さかった。この統計的閾値では、有意な代謝亢進は見られなかった。
図1 Long-COVID患者の脳18F-FDG PETによる代謝低下
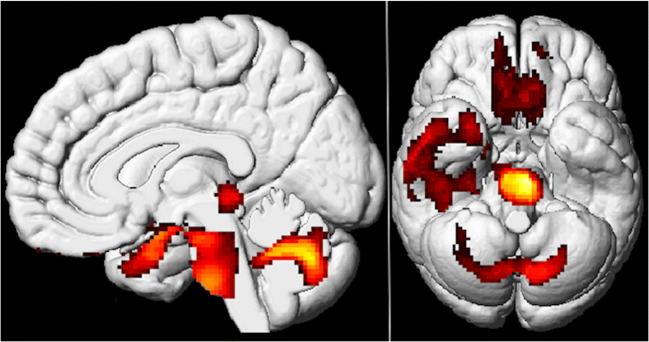
健常者と比較して、嗅覚回を含む両側の直回・眼窩回、扁桃体と海馬を含む右側頭葉(右視床に至る)両側の橋/髄質脳幹、両側の小脳(p-voxel < 0.001無補正、p-cluster < 0.05 FWE補正、SPM8 3Dレンダリング)で代謝低下が認められた。
図2 SPM8でLong-COVID患者と健常者を比較して得られたクラスターの代謝PET値の平均値をZスコアで表した
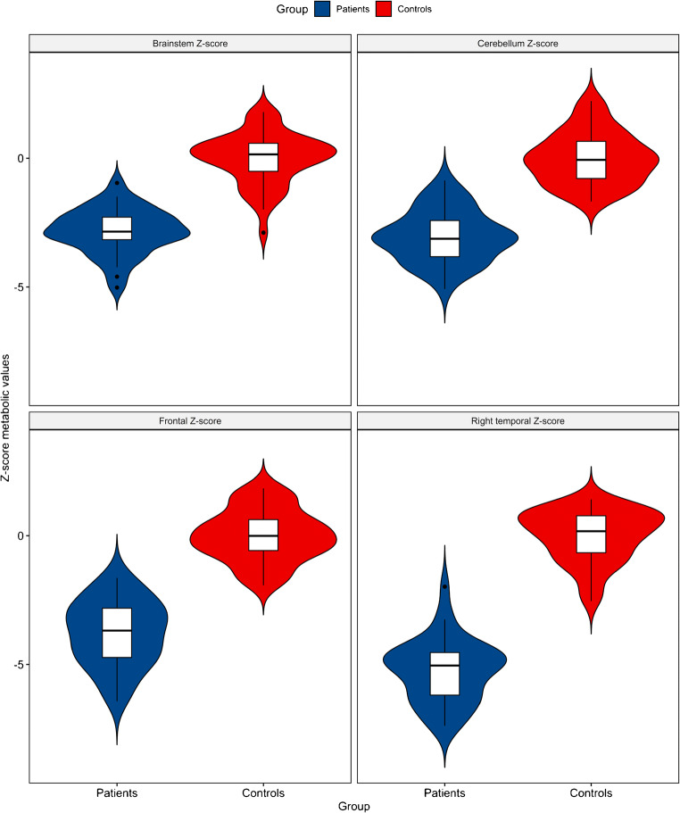
これらの代謝値は、患者と健常者で有意に異なっていた(p<0.001;片側スチューデントのt検定
表2 Long-COVID患者における健常者と比較した主な18F-FDG PET代謝低下(p-voxel < 0.001,無補正、p-cluster < 0.05,FWE補正済み
| 集まる | クラスターFWE | ボクセル | ボクセルUNC。 | タライラッハ座標 | ローカリゼーション | ||
|---|---|---|---|---|---|---|---|
| k | p値 | Tスコア | p値 | バツ | y | z | |
| 767 | 0.010 | 9.80 | <0.001 * | − 8 | 20 | − 30 | 左直回、BA11 |
| 9.26 | <0.001 * | 8 | 31 | − 32 | 右眼窩回、BA11 | ||
| 8.77 | <0.001 * | − 10 | 29 | − 32 | 左眼窩回、BA11 | ||
| 7.61 | <0.001 * | 6 | 24 | − 30 | 直回、BA11 | ||
| 1485 | <0.001 | 6.84 | <0.001 * | − 6 | − 23 | − 36 | 左延髄 |
| 4.44 | <0.001 | 6 | − 20 | − 19 | 右の橋 | ||
| 4.08 | <0.001 | − 4 | − 24 | − 21 | 左の橋 | ||
| 1969年 | <0.001 | 5.18 | <0.001 * | 10 | − 71 | − 25 | 右小脳、ピラミス |
| 4.70 | <0.001 | − 16 | − 72 | − 32 | 左小脳、口蓋垂 | ||
| 3.79 | <0.001 | 12 | − 48 | − 25 | 右小脳、歯状 | ||
| 3353 | <0.001 | 5.16 | <0.001 * | 55 | − 3 | − 12 | 右中側頭回、BA21 |
| 4.99 | <0.001 * | 61 | − 36 | 15 | 右上側頭回 | ||
| 4.75 | <0.001 | 36 | − 14 | − 13 | 右海馬 | ||
| 4.61 | <0.001 | 26 | 3 | − 27 | 右海馬鉤、BA28 | ||
| 4.54 | <0.001 | 26 | 1 | − 19 | 右扁桃体 | ||
| 4.41 | <0.001 | 57 | − 13 | − 18 | 右下側頭回、BA21 | ||
| 4.36 | <0.001 | 46 | − 22 | − 14 | 右紡錘状回、BA20 | ||
k値は、特定のクラスタ内のボクセルの数を表する。ボクセルのp値はすべて多重比較で補正されていないものとして表示されている。クラスターのすべてのp値は、FWE法を用いて多重比較のために補正されている。タライラハ座標はmmで表される。BA、ブロドマン面積
Long-COVID患者と健常者を分類するために、代謝PETクラスター値を用いてWilks lambdaモデルを行った。4つのPETクラスターのうち、最終的に右側頭代謝と前頭代謝がモデルに保持された。Wilks lambdasは右側頭部クラスターで0.147,前頭部クラスターで0.123であり、Fisher exact testにより、これらの変数のクラス中心は交絡していないことが証明された(p < 0.001)。このモデルは100%の個体を正しく分類することができた。
脳PET低代謝と臨床的特徴との関係
脳PET低代謝と臨床的特徴との探索的関係を図3および4.4に示す。W3+での機能的愁訴の増加は、脳幹および小脳クラスターの代謝低下と相関していた(r = -0.440および-0.581,p = 0.004およびp < 0.001,それぞれ片側ピアソン検定)。
図3 ET代謝クラスターとLong-COVID患者の特徴との関係
図4 PET代謝クラスターとLong-COVID患者の特徴との関係
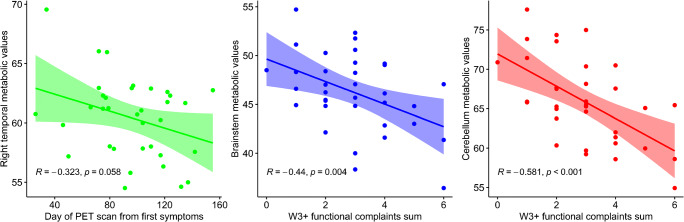
前頭クラスターの代謝値が低かった患者は、W3+の疼痛および高血圧と関連していた(片側Studentのt検定を用いて、それぞれp = 0.040およびp = 0.032)。前頭クラスターの代謝値が高かったのは、鼻用の脱炭酸スプレーを使用した3人の患者のみであった(p < 0.001,両側Studentのt検定を用いて)。
右側頭部クラスターの代謝値の低下は、W3+疼痛およびW3+不眠と関連していた(それぞれp = 0.037およびp = 0.045;片側Studentのt検定)。右側頭クラスターの代謝低下と初期感染症状からの持続時間の長さの間に傾向が認められた(r = – 0.323,p = 0.058;両側ピアソンの検定)。
脳幹クラスターの代謝値の低下は、W3+の疼痛およびW3+の不眠と関連していた(それぞれp = 0.024およびp = 0.042;片側スチューデントのt検定)。
小脳クラスターの代謝値の低下は、W3+の低躁/無躁、W3+の記憶/認知不満、W3+の痛み、およびW3+の不眠と関連していた(それぞれp = 0.007,p = 0.004,p = 0.014,およびp = 0.006;一方的なStudentのt検定)。
議論
この全脳ボクセルベースのPET試験では、SARS-CoV-2感染が生物学的に確認されたLong-COVID患者において、感染初期症状から 26~155日後に中枢性の可能性のある機能的愁訴を呈した脳の代謝低下を、SARS-CoV-2感染の前兆のない健常者と比較して、年齢と性別をマッチさせて示した。具体的には、これらの代謝低下領域は、嗅覚回を含む両側の直回・眼窩回、右側頭葉(扁桃体と右視床に達する海馬を含む)両側の橋/髄質脳幹、および両側の小脳に及んでいた。これらの代謝クラスターは、患者と健常者を区別するために高い識別性を示した。さらに、これらの代謝クラスターは、より多くの機能的愁訴と有意に関連しており、傾向として、回復後の機能的愁訴の持続時間が長くなっていた。より探索的で予備的な方法として、嗅覚回を含む前頭前野クラスターの代謝は、高血圧に対してACE薬による治療を受けた7人の患者では悪化し、鼻用の脱炭酸スプレーを使用した3人の患者では改善していた。
症状の総数との関連性を超えて、このような機能的愁訴の脳基質の根拠は、PET低代謝との関連性が発見されたことによって、より特別に強化されている。詳細には、嗅覚減退/無嗅覚症は小脳低代謝と関連していた。これまでの報告では、無呼吸や老衰と小脳の病変との関連が報告されている[12, 13]。我々の研究では、小脳低代謝も記憶・認知障害と関連しており、この領域が実行機能や作業記憶に関与していることが示唆されている[14, 15]。痛みは前頭前野、脳幹、小脳の代謝低下と関連しており、これらの領域は痛みの脳内マトリックスに関与していることが知られている[16]、特に線維筋痛症患者では[17]。最後に、不眠症は脳幹と小脳の代謝低下と関連しており、これもまた自律神経失調症の基質としてよく知られている[18]。このような関連性が強調されただけでなく、本研究のレトロスペクティブな定性的評価では、機能的愁訴とPET低代謝との関連性をより詳細に分析することができなかったのは確かである。
我々の知見は、嗅球を介したSARS-CoV-2の向神経性の仮説を補強するものであり、この障害は他の大脳辺縁系/傍辺縁系構造や視床、小脳、脳幹にも拡大している可能性がある。SARS-CoV-2の神経毒性は、急性期にすでに報告されている脳卒中や脳症/脳炎などの脳合併症によって最初に裏付けられている [20, 21]。長期的には、神経炎症性疾患に起因する精神疾患および神経学的疾患の遅延発生も予想されている[6]。この神経毒性は、他のコロナウイルス感染症について報告された以前の所見と全体的に一致しており、脳内および脳脊髄液中にウイルスが存在することが示されている[22]。これに関連して、最近のメタアナリシスでは、重症コロナウイルス感染症の初期段階では40%以上の患者で精神医学的および神経精神医学的症状がみられ、約30%の患者で発症後の段階で心的外傷後ストレス障害がみられ[23]、慢性疲労症候群や線維筋痛症がみられることが報告されている[24]。
病態生理学的観点からは、これらの機能的愁訴は、他の因子、特に心理的因子との絡み合いが考えられ、全身性の免疫炎症障害が関与している可能性がある[1]。これらの症状は、隔離、コルチコステロイドなどの治療の副作用の可能性[2]、またはメディアへの露出や予後に関する不確実性を伴う入院などの外傷的経験にも関連している[25]。さらに、女性 [3] や外傷経験者はこのような合併症のリスクがあることが示唆されている [26]。一方、我々の研究では、初期の臨床的、生物学的、放射線学的重症度(NEWSスコア、集中治療室への入院、機械的換気、CRPレベル、CTスコア)との関係は認められなかった。一方、記憶・認知障害があり、訴えの数が多い患者は若かった。年齢との関係は特に注目すべきであり、特に若年者では良性の疾患を発症すると考えられているが、これらの遅発性・持続性の機能的愁訴ではそうではないようである。
脳PET低代謝については、ACE薬による高血圧状態との有意な関連が認められ(前頭葉群)経鼻脱炭酸スプレーを使用している患者でも脳PET低代謝が良好であり(前頭葉群)症状の持続時間が長い傾向が認められた(側頭群)。これらの予備的な結果は、患者数が少ない(点鼻スプレー使用3名、ACE薬使用7名)ことを考えると、注意が必要である。高血圧状態との関係は、SARS-CoV-2の神経刺激性、特に嗅球からのゲートウェイの可能性について、ACE2受容体の関与を示唆している可能性がある。他のCoVについては、鼻から嗅球へのエトモイド骨の篩骨層を越えた伝播機構が実際に提案されており、ここではウイルスが標的とするACE2受容体が強く発現している[7]。これに加えて、シナプスを介したウイルス移行が以前に実証されており[7]、病変には直接感染傷害、低酸素症、および免疫傷害が関与している可能性がある。これに関連して、死後の研究では、SARS-CoV-2の神経強壮作用が確認されており、中等度から強度のミクログリア活性化が確認されている[27]。一方、嗅球を含む前頭クラスターの代謝が良好であったことは、たとえこの結果が少数の患者で得られたとしても、鼻から嗅球への直接的なプロセスであることを示唆していると考えられる。最後に,PET低代謝と初期感染症状後の持続時間の傾向は,臨床的重症度との関係を示唆しており,重症度の高い患者ほどPET低代謝が多く,重症度の高い患者ほど症状の持続時間が長くなることが示唆された。このことは、時間の経過とともにPET低代謝が悪化していくという同義的なダイナミズムを示唆している可能性もある。また、有意な脳の代謝低下が認められないことから、評価のこの段階では脳の炎症がないことを示唆している。PET異常と機能的愁訴の時間的順序との正しい関係を特定するためには、フォローアップPET検査が必要であり、特に早期のPET検査では、早期の代謝亢進炎症が二次的に脳の代謝低下機能障害を引き起こしているという仮説を検討する必要がある。また、この脳内代謝低下機能障害は、少なくとも部分的には局所嗅覚病変からの遠隔機能的影響がジアシシスや脱嗅覚を介して関与しているという仮説を立てることもできる[28-30]。
最終的に分類解析を行った結果、代謝低下の脳PETプロファイルは、Long-COVID患者と健常者を識別するための高い性能を持つ脳バイオマーカーとなり得ることが示された。SARS-CoV-2症候群の長期化は、社会経済的、医学的に大きな影響を及ぼす可能性があるが、有効なバイオマーカーの導入の可能性は、これらの患者の脳機能的関与を確認し、追跡調査し、炎症性嗅覚ゲートウェイを治療し、この低機能脳ネットワークを刺激するための投薬やリハビリテーションなどの新しい治療戦略の効率性を評価するために非常に有用であると考えられる。
限界
この研究はレトロスペクティブで単心的なものであり、欠損データがほとんどないことを含めて総合的な臨床評価を行い、同じPET部門で検査された健常者と患者を比較したものである。しかし、このデータ収集はほとんどが定性的なものであり、機能的愁訴に対する専用の定量的尺度はない。このように、患者の特徴と機能的愁訴に応じたPET異常の対決は、より探索的なものであり、非常に新しいテーマの最初の予備報告と考えなければならない。特に、若年者や遅延の長い患者でみられた関係や、少数の被験者で得られた関係を説明するために、リクルートのバイアスを排除することはできない(点鼻薬使用では3人、ACE薬使用では7人)。さらに、脳症/脳炎や脳卒中がない場合(これらの患者は研究から除外された)には、脳MRIは系統的に処方されず、ハイブリッドPETでの脳CTは正常であった。最後に、パンデミックのこの最初の段階では、これらの患者はいずれもそのような治療を受けていなかったため、全身性副腎皮質ステロイドの使用を含む薬物治療戦略の影響を評価することはできない。我々の結果を確認するためには、プロスペクティブで多中心的なデザインと大規模なサンプルを用いた追加研究が必要であり、特に、トレーニングサンプルと試験サンプルが異なる個人レベルでのPETバイオマーカーの妥当性を確認し、局所/全身性コルチコステロイドなどの治療法の正しい影響を評価する必要がある。これらのさらなる研究では、病変と機能障害のそれぞれの寄与を調査するために、脳MRIのマルチモーダルシーケンスを使用することも考えられる。これらのPET代謝異常の機能的性質と可逆性を確認するためには、最終的にこれらの患者の追跡調査が必要である。
結論
本研究では、生物学的にSARS-CoV-2感染が確認されたLong-COVID患者において、初期感染症状から3週間以上経過しても機能的愁訴が持続し、嗅覚回や大脳辺縁部・傍縁部が関与し、脳幹や小脳にまで広がっている脳PET代謝低下プロファイルを示した。この代謝低下プロファイルは、患者と健常者を分類するための個別の関連性を有しており、これらの患者を識別し、追跡するためのバイオマーカーとしての価値があることを示唆している。これらの機能的不定愁訴の影響を受けた脳基質の根拠は、代謝低下クラスターとの関連性によって強化された。最後に、嗅覚回を含む前頭前部クラスターの代謝低下は、高血圧患者ではACE薬と関連しているようであり、また、鼻からの脱炭酸スプレーを使用している患者では、この領域の代謝が良好であることから、嗅覚のゲートウェイとしてのACE受容体の役割の可能性が示唆された。

