Contents
Epigenetic Modifications in Alzheimer’s Neuropathology and Therapeutics
www.ncbi.nlm.nih.gov/pmc/articles/PMC6524410/
要旨
転写活性化は真核生物では高度に同期したプロセスであり、プロモーター領域での一連のシスおよびトランス作用要素を必要とする。転写制御・制御障害に関しては、クロマチンリモデリング、ヒストンのアセチル化・脱アセチル化、メチル化などのエピジェネティックな修飾が頻繁に研究されている。しかし、最近では、エピジェネティック修飾の意味合いが、様々な神経変性疾患のメカニズムにまで拡大していることが明らかになってきている。
学習障害や記憶障害は、アルツハイマー病をはじめとする多くの神経変性疾患と関連した認知機能障害である。これらの機能障害の原因となるエピジェネティックなメカニズムの理解を深めることで、ヒストン脱アセチラーゼなどの新たなエピゲノム治療標的の探索が進められている。
ここでは、真核細胞におけるDNAの複雑なパッケージングと、アルツハイマー病の神経病理や進行に関連したエピジェネティックなメカニズムの様々な変化、および治療的介入の可能性についてレビューする。
キーワード:エピジェネティクス、アルツハイマー病、ヒストンアセチル化、メチル化、クロマチンリモデリング、HDACs
序論
アルツハイマー病は、神経変性疾患の一つであり、神経シナプスの著しい障害と記憶力の低下を特徴とする疾患である。一般的には、最初は徐々に発症し、最も一般的な特徴的な症状は短期記憶喪失である(Burns and Iliffe, 2009)。アルツハイマー病は徐々に悪化していき、時間の経過とともに症状が強まっていく。これらの症状には、多くの場合、広範な記憶喪失、混乱、言語の困難、気分転換、行動の問題が含まれる(Burns and Iliffe, 2009)。ほとんどの場合、アルツハイマー病は認知症に進行し、最終的には死に至ることが多く、しばしば気管支肺炎や急性脳血管事故(Mölsä et al 1986)からである。
古典的なアルツハイマー病の症状は衰弱する神経萎縮と一緒に来る。脳内のニューロン数とシナプスの両方の枯渇は、アルツハイマー病の特徴的な商標です(Hamos et al 1989; SpangenbergとGreen 2017)。これらの重要な脳細胞と神経接続の欠乏は、しばしば脳の側頭葉と頭頂葉、前頭皮質と帯状回の一部、脳幹核の劣化をもたらす(Wenk, 2003; Huang et al 2007; Braak and Del Tredici, 2012)。MRI画像を用いた研究では、アルツハイマー病患者はこの神経細胞の喪失の結果として、特定の脳領域のサイズが実際に物理的に減少していることが示されている(Callen et al 2001)。
ニューロンやシナプスの劣化に加えて、アルツハイマー病患者は、アルツハイマー病なしの患者と比較して、脳内にアミロイドプラークや神経原線維のもつれがより多く蓄積されている(Tiraboschi et al 2004)。これらの物質の非定型的な蓄積は、通常、側頭葉などのアルツハイマー病に関連する脳の特定の領域で見られる(Bouras et al 1994)。アミロイド斑は、アミロイド前駆体タンパク質(APP)の断片であるアミロイドβペプチドで構成されている。APPは、神経細胞膜の膜貫通タンパク質であり、ニューロンの成長、修復、および全体的な機能に極めて重要である(Turner et al 2003;Priller et al 2006)アルツハイマー病では、α-セクレターゼ切断とは異なり、γ-セクレターゼおよびβ-セクレターゼのタンパク質分解切断は、実質的なニューロンパソロジーにつながるアミロイド生成処理をもたらすことができる(Kang et al 1987;Hooper 2005;Zhang et al 2011)。例えば、C83またはC89でのγ切断は、アルツハイマー病脳における神経病理学的プラークの主な構成要素であるアミロイドβ(アミロイドβ)ペプチド、アミロイドβ40およびアミロイドβ42を、得ることができる(Zhang et al 2010)。これらのアミロイドβペプチドは、その後、神経細胞の外側に発生し、それを囲むTiraboschi et al 2004)とZhang et al 2011)を形成するパック状の堆積物を形成する。これらのプラーク塊の蓄積はアルツハイマー病の明確な特徴であるが、βアミロイドペプチドのこの蓄積がどのようにアルツハイマー病の病理学につながるかの正確なメカニズムはまだ不明である(Van Broeck et al 2007)。
さらに、微小管関連タンパク質であるタウもまた、アルツハイマー病患者の脳内に異常に蓄積する。タウタンパク質は通常、リン酸化状態で細胞の細胞骨格の微小管を安定化させる機能を持っているが、アルツハイマー病ではタウが高リン酸化状態になる。この高リン酸化されたタウは、他の糸と結合して神経原線維のもつれを形成する。これらのもつれは神経細胞内で発生し、正常な輸送に大きな影響を与える(Hernandez and Avila, 2007)。脳内の上記のアミロイド斑と同様に、これらのもつれの両方の上昇した存在は、アルツハイマー病の重要な指標となっている。
アルツハイマー病のトレードマークの病理学と症状はよく知られているが、病気につながる根本的な経路はない。現在、アルツハイマー病を治療するための治療法は知られていない(Holtzman et al 2011; Lindsley 2012; Mitra et al 2019)。しかしながら、最近の知見は、エピジェネティックな改変が遺伝子発現の調節過程、特に記憶の調節過程において基本的なものであることを示している(Kosik et al 2012)。さらに、アルツハイマー病は、翻訳後のヒストン修飾の影響を受けていると考えられるエピジェネティックな遮断、すなわち遺伝子発現の広範な低下を示すことが示されている(Sananbenesi and Fischer, 2009; Gräff et al 2012)。これらを総合すると、エピジェネティクスは、これまで考えられていた以上にアルツハイマー病において大きな役割を果たしている可能性があるように思われる。したがって、より良く理解し、アルツハイマー病におけるエピジェネティック修飾の障害を研究することによって、病気を治療するための潜在的な新しい治療法を設計することができる。
エピジェネティクスは、実際のDNA配列に変化を与えることなく、クロマチンの改変から生じる表現型の変化の研究として定義されている(Dupont et al 2009)。エピジェネティクスがどのように機能するかを理解するためには、DNAがどのようにパッケージングされているかを理解することが重要である。真核生物のゲノムは膨大な量の遺伝情報で構成されており、各細胞の核に保存されなければならない(Kornberg, 1974; Peterson and Laniel, 2004)。これらの長いDNA分子のサイズは非常に大きいため、比較的小さいサイズの核に収まるように高次構造に複雑にパッケージングされなければならない。これを達成するために、DNAはヒストン蛋白質に巻き付けられており、ヒストン蛋白質は静電的・水素的相互作用を介して互いに関連し、ヌクレオソームと呼ばれる構造単位を形成している(Cairns, 2009)。ヌクレオソームは、8つのコアとなるヒストン蛋白質H2A、H2B、H3,H4と、それぞれが一対として存在し、それらを巻き付けているDNAから構成されている(Kornberg and Lorch, 1999; Pérez-Martìn, 1999; Rando and Winston, 2012)。ヒストンコアからは、正に荷電した残基に多く含まれるアミノ酸鎖からなるヒストンテールが伸びている(Pérez-Martìn, 1999; Martin and Zhang, 2005)。また、リンカーヒストンと呼ばれるH1ヒストン蛋白質が存在し、リンカーDNAと結合している。リンカーDNAとは、ヌクレオソームが高次の糸状クロマチンに構造化された後、ヌクレオソーム間に存在するDNAの領域のことである(Happel and Doenecke, 2009; Harshman er al)。 これらの領域は、遺伝子の発現や制御に極めて重要である(Clapier and Cairns, 2009)。
高次のクロマチン構造は、DNAを密に包装して核内に収めることを可能にするが、それ自体にも問題がある。DNAが凝縮された形になっているため、プロモーター領域は、DNAテンプレートを必要とする重要な細胞内プロセスに容易にアクセスできない(Smith and Peterson, 2005; Morrison and Shen, 2009)。プロモーターが到達可能なようにするためには、ヌクレオソームの構造を変化させるか、または破壊しなければならない。この目的のためにヌクレオソームを特異的に標的とする酵素の2つの主要なカテゴリーには、ヒストンタンパク質を共有結合的に修飾するもの、例えば、アセチル化、脱アセチル化、およびメチル化を行うものと、ATPを加水分解してヌクレオソームを再配置し、したがって、クロマチンリモデリングを行うものが含まれる(Margueron et al 2005; Smith and Peterson 2005)(図1)。また、ヒストン修飾には他にもリン酸化、ユビキチン化、スモイル化、ADPリボシル化などがある。
図1 遺伝子の活性化と不活性化に寄与するヒストン結合とエピジェネティック変数の模式図
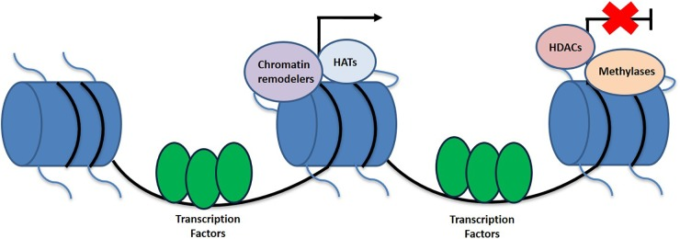
転写活性化に寄与するエピジェネティックな修飾には、HATやクロマチンリモデラーがあり、HDACやメチル化は遺伝子発現のサイレンスに関連している。
アセチル化と脱アセチル化
エピジェネティック修飾の最初の2種類は、ヒストンのアセチル化と脱アセチル化である。ヒストンアセチラーゼ(HAT)は、コアヒストンの尾のリジン残基上でアセチル化を行うことにより、ヒストンタンパク質を共有結合的に修飾する酵素のカテゴリーに属する(Marmorstein, 2001; Roth er al)。 アセチル化は、しばしば転写活性化に関連するヒストン修飾である。HATには主に2つのタイプがある。タイプAのHATは核内に局在し、クロマチンに関連するヒストンに作用する(Kornberg and Lorch, 1999; Roth et al 2001)。一方、タイプBのHATは細胞質に存在し、まだクロマチンに関連していない合成されたばかりのヒストンに作用することがわかっている(Brownell and Allis, 1996; Roth et al 2001; Parthun, 2007)。
ヒストン脱アセチル化酵素(HDACs)は、ヒストンタンパク質を共有結合的に修飾する酵素の別のグループである。HATがリジン残基をアセチル化することでヒストンの尾部を中和するのに対し、HDACはリジン残基を脱アセチル化することでその効果に対抗する。HDACは、ヒストンの尾を直接荷電状態に戻すので、クロマチンの凝縮や遺伝子の抑制と関連している(Pazin and Kadonaga, 1997)。哺乳類では、ヒストン脱アセチル化酵素にはクラスI、II、III、IVの4つのクラスがあり、その分類は機能やDNA配列など複数の要素に基づいている。これらの脱アセチラーゼは、HDACの種類によって、細胞の核内と細胞質の両方に存在することが知られている(De Ruijter et al 2003)。
DNAメチル化とヒストンメチル化
ヒストンアセチル化、ヒストン脱アセチル化、ヒストンメチル化、クロマチンリモデリングは、生物のエピジェネティクスに影響を与える重要な役割を果たしているが、エピジェネティックコードに関与するもう一つの重要なメカニズムがある。DNAのメチル化は、DNA構造にメチル基を付加するプロセスである。メチル化は、シトシン塩基とアデニン塩基の両方で起こる可能性がある。シトシンメチル化は哺乳類ではかなり一般的であるが、アデニン塩基上のメチル基が最近哺乳類細胞でも検出されていることに留意すべきである(Wu er al)。 シトシンメチル化は、DNA鎖上のグアニン塩基の直前に来るシトシン塩基へのメチル基の付加を含む。これらは、CpGジヌクレオチドと呼ばれる(Bird, 1986)。興味深いことに、最近の研究では、長期記憶におけるDNAメチル化の重要性が提唱されており、これはアルツハイマー病との潜在的な関係を示す重要な示唆である(Miller and Sweatt, 2007; Day and Sweatt, 2010)。
DNAメチル化に加えて、ヒストンメチル化も重要である。ヒストンメチル化酵素(HMT)は、ヒストンH3とH4のヒストン尾部のリジン残基またはアルギニン残基をメチル化する酵素である。HMTは、遺伝子の活性化と抑制の両方に関連している。HMTには大きく分けて2つのファミリーがあり、どのような残基をメチル化するかによって分類されている。第一のグループは、リジンをメチル化するHMTであるヒストンリジンメチルトランスフェラーゼで構成されている。第二のグループは、アルギニンをメチル化するタンパク質アルギニンメチルトランスフェラーゼである(Wood and Shilatifard, 2004)。
クロマチンリモデラー
上記の3つのエピジェネティックなメカニズムがヒストンを共有結合的に修飾する酵素群を指すのに対し、クロマチンリモデリング複合体は独自のカテゴリーに属する酵素である。これらの酵素複合体はATPを利用してヌクレオソームを再配置し、文字通りDNAとヒストン蛋白質の結合を修飾することでクロマチン構造のダイナミクスを変化させる(Tsukiyama et al 1999)。このプロセスは、ヌクレオソームのスライド、ヌクレオソームの再配置、および排出を含む様々なメカニズムによって達成される(Fazzio and Tsukiyama, 2003; Mohrmann and Verrijzer, 2005; Cairns, 2007, 2009; Clapier and Cairns, 2009)。真核細胞には、クロマチンリモデラーのファミリーが多数存在する。これらには、SWI/SNF、ISW1,NuRD/Mi-2 CHD、INO80,およびSWR1のファミリーが含まれる。これらのクロマチンリモデリングラーのグループはすべて、そのATPaseドメインに類似しているが、特定のリモデリング機能には違いがある(Lusser and Kadonaga, 2003; Kim er al)。
エピジェネティクスの重要性と、遺伝子発現の調節、特に記憶の調節への関与が示唆されているため、アルツハイマー病におけるエピジェネティクスの役割との関連付けがなされてきたのも不思議ではない。このレビューでは、アルツハイマー病で観察されるエピジェネティックな制御異常について、疾患の進行に伴って現れる神経病理を標的としたエピジェネティック治療の可能性に重点を置いて議論する。
アルツハイマー病治療におけるHAT/HDACの意味合い
学習と記憶には、様々な因子や経路のネットワークが複雑に絡み合っている。長期記憶とシナプス可塑性は、遺伝子発現の初期誘導段階を超えた活性化に依存しており、エピジェネティックな相互作用の可能性を示唆している(Pittenger and Kandel, 2003)。ヒストンのアセチル化(およびそれに対応する脱アセチル化;HATsとHDACs)は、現在、長期ポテンシャル(LTP)と記憶形成に重要な役割を果たしていると同定されている多くのエピジェネティックなメカニズムの一つであり、恐怖条件付けと空間記憶演習を通して観察されている(Rogan er al)。
海馬のLTPは、1時間以上維持されるシナプス増強の継続的な増加を含むN-メチル-d-アスパラギン酸グルタミン酸受容体依存性の反応であり、哺乳類モデルにおけるシナプス可塑性と学習の主要なモデルとなっている(Bliss and Lomo, 1973; Bliss and Collingridge, 1993)。LTPにおけるエピジェネティック因子に関するこれまでの研究では、メチル化の解析のみが行われており、HATやHDACが果たす重要な影響、特にHDAC阻害剤の可能性は無視されていた(Kazantsev and Thompson, 2008)。かつては、がん治療におけるその可能性について考えられてたが(Vigushin and Coombes, 2002)HDAC阻害剤は、現在では、幅広い効果を持つアルツハイマー病患者の潜在的な治療標的と考えられている(Xu et al 2011)(図2)。
図2
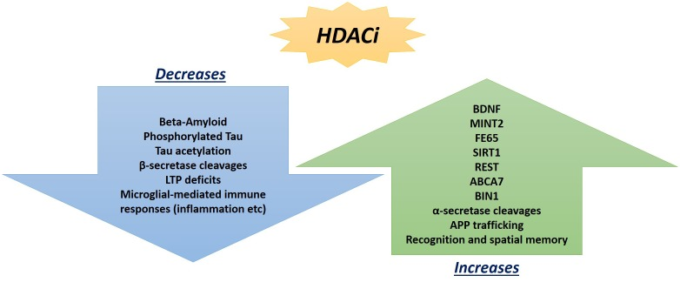
HDAC阻害剤治療の有望な有益な結果は、これまでにADマウスモデルや神経病理学を改善することができる死後の海馬の解析で観察されている。
アルツハイマー病は、アミロイドβタンパク質前駆体(APP)プレセニリン-1,プレセニリン-2(PS1,PS2)遺伝子の変異と関連しており(Yan et al 1995; Barglow and Cravatt 2007)βアミロイドの脳内蓄積が進行し、シナプスのLTP伝達が低下するという神経病理学的特徴につながる(Shankar et al 2008)。APP/PS1マウスを用いた恐怖条件付け訓練では、HDAC阻害剤であるトリコスタチンA(TSA)を急性に投与することで、低下した文脈上の凍結能力が野生型のレベルに回復することが実証されている。APP/PS1キメラ変異マウス/ヒトトランスジェニックマウスは、生後6ヶ月までにβアミロイドプラークが蓄積するアルツハイマー病表現型を示す(Jankowsky et al 2003)。欠損した表現型マウスでは、海馬のアセチル化H4レベルはWTマウスの約半分であった。その後、HDAC阻害剤を投与することで、WT個体と同等の正常な高濃度のH4アセチル化レベルを回復させることができた。全体的に、TSA治療は、テタニック刺激と文脈的空間学習を通して観察されるH4アセチル化レベル、文脈的凍結時間、および海馬のLTPの欠損を回復させた)(Francis et al 2009)。さらなる研究では、同様に有意な結果が得られたHDAC薬の使用範囲が拡大されている。HDACi薬、バルプロ酸ナトリウムだけでなく、スベロイルアニリドヒドロキサム酸(SAHA)と酪酸ナトリウム(NaB)は、それらの車両で処理された(コントロール)変異APP/PS1リッターメイトと比較して、標準的な電気足踏み凍結恐怖条件付けで有意に高い凍結レベルをもたらすことが示されている。処置は、もはやWTのtermatesと有意差がなかっただけでなく、数週間後にも維持され、そのような探索的な性質や即時の凍結反応など、アルツハイマー病の病理学に関連していない行動の他の側面を変更しなかった結果にアルツハイマー病の表現型を復元した(Kilgore et al 2010)。このような効果の持続性は、市場性のあるどのような治療用化合物においても重要であり、これらの薬剤が患者に与える大きな影響を最大化するための研究がその後行われていた。半減期が長く、血液脳関門への浸透性が高い2種類のHDAC阻害薬が開発されている。メルカプトアセトアミドベースのクラスII HDACiおよびヒドロキサミドベースのクラスIおよびII HDACiの両方は、成分の遺伝子発現を減少させ、分解酵素遺伝子発現を増加させることにより、試験管内試験でβアミロイドを減少させ、最終的にはタウを減少させながらADマウスの学習および記憶障害を回復させた(Sung et al 2013)。
標準的な学習障害を超えて、アルツハイマー病はまた、認知機能の低下をさらに扇動する発作やてんかんエピソードで現れることができる。これらの発作はΔFosB転写因子の発現を増加させ、これは順番にc-Fos、記憶とシナプス可塑性におけるその役割のために知られている原型遺伝子を抑制するために海馬でHDAC1を募集する(Saura et al 2004)。4-フェニル酪酸(クラスI HDAC 4-PBA)またはMS-275(HDAC1-3の阻害剤)を介したAPP変異体ADマウスにおけるΔFosのHDAC阻害は、現在、c-Fosの抑制を逆転させ、したがって、物体位置記憶課題および海馬依存性空間記憶課題で観察されるように、ADマウスにおける認知パフォーマンスを増加させることが示されている(Corbett et al 2017)。
エピジェネティック治療的介入から利益を得る可能性のあるアルツハイマー病病理学的に意義を有することが知られている別の転写因子は、ミエロイド細胞およびミクログリア遺伝子発現の発達において重要であるPU.1である(Rustenhoven et al 2018)。ゲノムワイド関連研究は、PU.1の減少がアルツハイマー病の発症を遅らせる因子であることを示している(Huang et al 2017)。PU.1ノックダウンのマイクロアレイ解析、RT-qPCRおよび免疫細胞化学は、自然免疫および適応免疫の両方に関与することが知られている改変されたアルツハイマー病関連ミクログリア遺伝子を実証している。FDA承認薬を用いた更なるハイスループットな薬物スクリーニングにより、ヒトミクログリアにおけるPU.1発現を効率的に減衰させるHDAC阻害剤であるVorinostatが同定された。これらの解析の複合結果は、PU.1発現をノックダウンするVorinostatまたは他のHDAC阻害剤が、アルツハイマー病で観察される過剰な炎症などのミクログリア媒介免疫応答を減少させる可能性のある潜在的な治療法として有用である可能性を示唆した(Rustenhoven et al 2018;Smyth et al 2018)。
これらの線に沿って、それは再び アルツハイマー病 は広い範囲の病理学を提示し、したがって、1 つの単一のターゲットが全体的に示された赤字を改善するのに十分ではないかもしれないことを強調することが重要である。その代わりに、マルチターゲット治療法を探索することが大きな可能性を秘めているかもしれない。ある研究では、複数のアルツハイマー病関連遺伝子の発現に影響を与えるために単一の薬剤であるHDACi M344を利用することにより、この手法ですでに有望な結果が示されている。M344は、βアミロイド、リン酸化タウ、β-セクレターゼ、およびAPOE4を減少させる一方で、ADAM10を増加させ、BDNF、MINT2,FE65,SIRT1,REST、ABCA7,BIN1,およびAPPトラフィッキングを増加させることが示されている(Volmar et al 2017)。β-セクレターゼが(γ-セクレターゼと同様に)アミロイド前駆体タンパク質(APP)(図3)を切断することは、老人斑、神経可塑性欠損、およびタウ過リン酸化などのアルツハイマー病の神経病理学につながる方法であるので、これは重要である(Nistor et al 2007)。代わりにα-セクレターゼ(ADAM10)によって切断が行われる場合、アミロイド原性処理は回避され、神経病理は存在しない(Colchiagi et al 2002)。最終的に、M344で処置されたマウスは、認識および空間記憶テストにおいて有意な認知的利益を示した(Volmar et al 2017)これは、アルツハイマー病および他の神経変性障害の多遺伝子的側面を解決するためにマルチターゲティング薬を利用する可能性を実証する。
マルチターゲティングがアルツハイマー病治療においてどのように価値があるかのもう一つの例は、HDAC阻害とPDE5阻害を結びつけるCM-414と呼ばれる新規の「ファーストインクラス」低分子の開発であり、その両方が個別に幸先の良い結果を示している(Cuadrado-Tejedor et al 2017)。PDE5阻害は(血管拡張薬であるバイアグラで見られるように)記憶の鍵を握るCREBのリン酸化を増加させる分子であるため、アルツハイマー病表現型の欠損を改善する。シナプス機能の長期的な改善、CREBのリン酸化、および記憶障害、cGMP/PKG/pCREBシグナル伝達障害の逆転、および神経炎症の逆転、アミロイドベータレベルの長期的な減少をもたらすことは、すべてPDE5阻害によって観察されている(Puzzo et al 2009; Zhang et al 2013)。PDE5は、最終的には脳組織を含む様々な場所でcGMPの分解に関与している。
一酸化窒素/cGMP/CREB経路は学習/記憶過程に重要であるため、cGMPの分解はアルツハイマー病の神経変性性に関与しており、この分解過程を阻害する薬剤が有望な治療薬である(Fiorito er al)。 この有効性とHDAC阻害薬の有効性を組み合わせることで、患者さんへの効果を増幅させることができる。デュアルインヒビターCM-414を用いた慢性的な治療は、APP/PS1マウスにおける欠損したLTPを救済することができ、同時にβアミロイドおよびリン酸化タウレベルを減少させることができる。さらに、CM-414は、グリコーゲン合成酵素キナーゼ-3β(GSK3β)の不活性型を増加させることが示されている(Cuadrado-Tejedor et al 2017)。GSK3βは、タウのリン酸化に関連して微小管の安定性および認知に関与するキナーゼであり(Bhat and Budd, 2002)したがって、アルツハイマー病の神経病理に関連している(Pláteník et al 2014)。さらに、CM-414は、シナプス遺伝子の発現を誘導するように恐怖条件付け試験とモリス水迷路テスト空間記憶試験を通して観察された認知障害を逆転させるだけでなく、海馬ニューロン上の樹状突起棘密度の減少をもたらした。本剤の試験管内試験およびex vivoでの活性は、アルツハイマー病神経病理学の複雑で多因子性の性質に基づいてマルチターゲット療法を使用することがいかに有益であるかを実証しており、かなり有望なものとなっている(Cuadrado-Tejedor et al 2017)。これについての唯一の懸念は、しかしながら、ターゲットの増加は、それが癌治療研究の間に高用量で利用されているときにそれが重度の下痢および食欲不振につながるときに観察されているように、追加の副作用のリスクの増加を意味することである(Ree et al 2010)。
図3
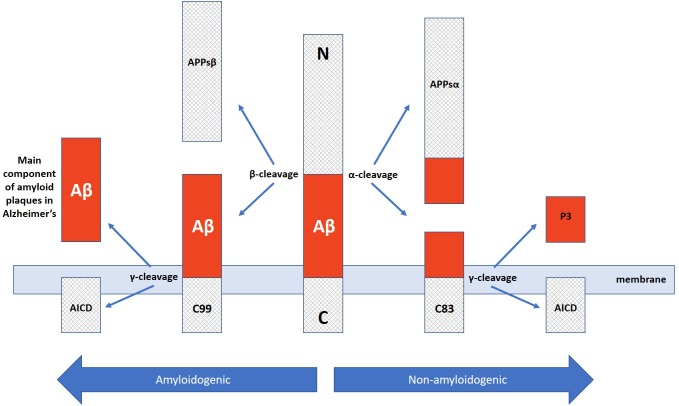
アミロイド原性経路と非アミロイド原性経路のαおよびβセクレターゼを介したAPP切断の経路で、アミロイド原性経路はアルツハイマー病に決定的に関与する神経病理学的なアミロイドβプラークペプチドを産生する。
また、マウスモデルを超えた試験では、HDAC阻害薬についても有望な結果が得られている。トリプルトランスジェニックADマウスにRGFP-966を繰り返し投与すると、βアミロイド蛋白質レベルが低下し、タウのリン酸化が反転し、空間学習と記憶力が改善されることが示されている(オープンフィールド、バランスビーム、トレッドミル、巣作り行動解析)。さらに、RGFP-966はBDNFの発現を増加させ、タウのリン酸化とタウのアセチル化を減少させると同時に、神経病理学的に誘発されるAPPのβセクレターゼ切断を減少させることが示された。その後、RGFP-966試験は、アルツハイマー病患者からの多能性幹細胞由来の初代ニューロンの誘導に適用した場合の影響を調べるために拡大された。健常対照2名と比較して2名の患者という最小限のサンプルサイズであったが、結果は、ニューロンの病的残基におけるβアミロイド蓄積の減少とタウ修飾の減少を伴うアルツハイマー病病態の救済という有望なものであった(Janczura et al 2018)。このことは、下位生物モデルの結果を超えて、患者に対するHDAC薬物療法の潜在的な価値をさらに実証している。
エピジェネティックなアセチル化パターンの同様の意義は、死後のヒト脳組織においても観察されており、アルツハイマー病治療におけるHAT/HDAC関連薬剤の有望性をさらに高めている。HDAC阻害は、エピジェネティック治療薬のより大きな表現を占めているが(低いアセチルレベルがアルツハイマー病神経病理学に関連する傾向があることを意味する)いくつかの研究では、エピジェネティック修飾の反対のパターンが同定されている。例えば、Narayan et al 2015)は、免疫標識とマイクロアレイ分析を利用して、正常な脳組織と比較して、死後アルツハイマー病の下側頭回と中側頭回の脳組織で増加したH3とH4アセチルレベルを示すために、妥協したタンパク質分解機構と一緒に。観察された違いは、病理に関連する領域にのみ存在し、対照の小脳組織では同定されなかったため、タウ、βアミロイド、ユビキチン病理と有意に相関していた(Narayan et al 2015)。しかし、死後実験は、マウスモデルまたは細胞ベースの解析よりもサンプルサイズが小さい傾向があることに注意すべきである。ハイパーアセチル化ではなくアセチル化の欠乏を強調するマウスモデルとの矛盾にもかかわらず、これらの結果は、アルツハイマー病病態におけるエピジェネティックなメカニズムの調節障害が明らかに存在することを示している。
アルツハイマー病治療におけるDNAメチル化の可能性
DNAメチル化は、最も広範囲に研究されているエピジェネティックな修飾と広く考えられている(Anderson et al 2012)。以前は、癌(Laird and Jaenisch, 1996; Baylin and Herman, 2000)に焦点が当てられてたが、メチル化はアルツハイマー病研究の最前線に位置するようになり、この難病の神経病理を緩和するための新たな治療アプローチへの洞察を提供する可能性がある。
現在、様々な研究では、多くの疾患関連遺伝子のメチル化パターンを調べ、どの遺伝子が低メチル化または低メチル化の形で病理学的に異なるパターンを持っているかを決定している。また、同じ遺伝子が複数の体の部位、例えば海馬細胞と血球のような部位でも頻繁に研究されている。HOX遺伝子は、彼らが神経のパターニングに責任を負う転写因子をコードするように、彼らが神経の発達に果たす重要な役割のために特に関心がある(PhilippidouとDasen 2013)。最近、Smith et al 2018)は、HOX遺伝子の差動メチル化がアルツハイマー病患者においてどれだけ広範囲に及ぶことができるかを示す最初の研究となった。彼らの研究は、3つの独立したコホートにまたがる前頭前皮質および上側頭回サンプルにおけるエピゲノムワイドな関連付けを使用して、HOXAクラスターの広範な領域(48 kb)にわたるアルツハイマー病関連ハイパーメチル化を示した(Smith er al)。 病態との関連でメチル化動態を分析する際には、単にワンサイズフィットの方法論を適用することはできず、むしろ、問題のある素因遺伝子のハイパーメチル化活性化と同時に、有益な保護遺伝子のハイパーメチル化サイレンシングが発生しており、異なるパターンを持つ異なる遺伝子を考慮しなければならない。重要な発生遺伝子のハイパーメチル化がこの領域で観察される一方で、APPのハイパーメチル化も同様に、アミロイドプラークのより高いレベルと神経病理をもたらす(Gasparoni et al 2018)。DNAメチル化異常もまた、以前にダウン症候群の人のこの領域で観察されており、これは、多くのダウン症候群患者が21番染色体上のトリソミーのAPPの重複のためにアルツハイマー病を発症するので、関心のあることである(Bacalini et al 2015)。標準的な老化プロファイルと比較した死後脳サンプルを用いて、ニューロンおよびグリアの両方におけるBraakステージ関連のメチル化変動は、MCF2L、ANK1,MAP2,LRRC8B、STK32C、およびS100Bなど、アルツハイマー病の進行に関連する他の多数の遺伝子においてさらに同定されている(Gasparoni et al 2018)。
神経病理学の様々な側面が、差動メチル化パターンとの関連性を有することが知られるようになった。実質的なアルツハイマー病病理で知られる内耳皮質層IIIの免疫反応性解析は、エピジェネティック機能不全を示し、特に、Mastroeniら(Mastroeni er al)。 (2010)の研究では、PHF1/PS396,DNMT1(メジャーメチル化酵素)、MeCP1/MBD2メチル化複合体の6成分(MTA2,HDAC1,HDAC2,p66α、RbAp48,MBD2/3)を含む全10種のエピジェネティックマーカーおよび因子の神経細胞免疫反応性が逆相関していた。これらの結果は、PHF1およびPS396が神経原線維性のもつれ形成のマーカーとして広く認識されているように、DNAメチル化マーカーと後期のもつれ形成のマーカーとの逆の関係を示している(Mastroeni et al 2010)。神経細胞におけるメチル化の喪失がもつれの形成と関連していることに加えて、メチル化の喪失は、細胞周期遺伝子の発現の増加にも関連しており(Jackson-Grusby et al 2001;Mattson 2003年)したがって、アルツハイマー病神経細胞におけるメチル化の減少は、アルツハイマー病で観察される異常な細胞周期への再突入とアポトーシスに関連している可能性がある。ある研究では、アルツハイマー病プロファイル中の11,822個の超メチル化CpGを同定したことさえあり(6,073個の超メチル化CpGと同様に)超メチル化部位の大部分は、シナプス調節や認知機能障害に関与するwntシグナリングと同様に、細胞周期に関連するプロセス(有糸分裂や相転移の調節など)に関連する遺伝子であるのに対し、超メチル化部位は転写因子結合、補因子結合、プロモーター結合に関与する遺伝子として同定された(Gao et al 2018)。
前述したように、アルツハイマー病関連遺伝子を研究する際には、場所も注目される。若年性アルツハイマー病に関連する遺伝子が異なるメチル化を示すかどうかを分析する場合、アルツハイマー病の血液および脳サンプルのパイロシーケンスは、血球中のRIN3のみが7つのCpGに対して有意なハイメチル化を示すことを示している(Boden et al 2017)。RIN3は、カリウム依存性ナトリウム/カルシウム交換体をコードし、アミロイドの輸送に負の影響を与えることにより、シナプス機能およびエンドサイトーシスの役割を介して細胞シグナル伝達および神経発達に関連している(Giri et al 2016)。RIN3の低メチル化を同定した同じ研究では、遅発遺伝子PTK2β、ABCA7,SIRT1,またはMEF2Cについては、グループ全体での有意差は観察されなかった(ただし、MEF2Cの1 CpGは、1人のアルツハイマー病個体でメチル化が減少していた)(Boden et al 2017)。このことは、早期対後期発症アルツハイマー病の病態が、普遍的なエピジェネティック治療法の解決策を可能にしない可能性を示唆している。一方、TNF-αは、アルツハイマー病患者の皮質サンプルにおいてのみ有意なハイメチル化を示すが、血液サンプルにおいては認められず、アルツハイマー病病態において明らかにされているエピジェネティックなメカニズムのいくつかは血液細胞ではなく脳細胞にのみ関連していることを示している(Kaut et al 2014)一方で、他のいくつかは血液細胞においてのみ観察されている(Boden et al 2017)。腫瘍壊死因子のプロモーター領域におけるこの低メチル化は、転写因子の結合不足による活性の抑制と関連しており(Pieper et al 2008)これはその後、アミロイドプラークの蓄積を誘発するため、認知機能およびシナプス機能の著しい障害をもたらす(Buchhave et al 2010)。
ほとんどの人がアルツハイマー病と関連付ける認知障害や記憶障害を超えて、概日リズムの乱れもまた、変更された睡眠/覚醒サイクル、体温調節の問題、および増加した夜の混乱を経験しているアルツハイマー病患者の大多数と非常に一般的である。(Satlin et al 1995;呉とSwaab 2007)。概日リズム時計の中心的な構成要素として知られ、視床下部上体核ニューロンの発火速度を調節する転写因子として作用するBMAL1のメチル化、転写、および発現を調べると(Rudic et al 2004年)BMAL1の発現を著しく変化させる異常なリズムメチル化パターンが線維芽細胞および死後アルツハイマー病脳サンプルで観察されている(Cronin et al 2017)。エピジェネティック治療の有望性は、したがって、概日周期および体温調節にまで及ぶ。
アルツハイマー病神経病理学のためのメチル化関連エピジェネティック療法の有望な可能性に加えて、これらの治療の進歩はまた、他の神経変性疾患患者の苦しみを和らげるためにアルツハイマー病を超えて援助することができる。アルツハイマー病サンプルを双極性障害(BD)ハンチントン病、パーキンソン病、血管性認知症、およびレビー小体型認知症を含む他の障害と比較すると、有意な類似性が差動メチル化研究で観察される(Rao et al 2012;Smith et al 2019)。アルツハイマー病と双極性障害関連遺伝子のCpGメチル化、およびこれらの神経変性疾患患者20人(各10人)のアルツハイマー病脳と双極性障害脳の死後前頭前皮質におけるグローバルDNAメチル化とヒストン修飾を検査したところ、多くのエピジェネティックな類似性が観察された。両疾患では、COX-2プロモーターでの低メチル化、BDNFプロモーターでの低メチル化と同様に、グローバルなDNAのハイパーメチル化とヒストンH3リン酸化が存在している。シナプスマーカーのCpGメチル化は両疾患に存在するが、シナプトフィシンプロモーターのメチル化の増加はアルツハイマー病のみであり、ドレビンのハイパーメチル化はBDのみである。メチル化の変異に加えて、BDとアルツハイマー病では神経炎症性マーカー(IL-1β、TNF-α、アストロサイト、ミクログリア活性化マーカー)のmRNAとタンパク質の増加が認められる(Rao er al)。 このようなエピジェネティックな類似性および多疾患治療薬の可能性は、両障害が、神経炎症性マーカーGFAP、CD11b、IL-1βの増加、AAカスケードcPLA2IVA、sPLA2IIAおよびCOX2の増加、および神経栄養性BDNFおよびシナプス前後シナプスフィシンおよびドレビンの喪失を特徴とすることから、研究すべき有望なベンチャーである(Rao et al 2011)。BDを超えて、ビスルファイトパイロシークエンスは、ANK1のハイパーメチル化がアルツハイマー病だけでなく、ハンチントン病およびパーキンソン病でも観察されることを実証し、血管性認知症またはレビー小体型認知症を有するサンプルもまた、ANK1のハイパーメチル化を実証したが、それらが共存するアルツハイマー病病理学を有する場合にのみ示された(Smith et al 2019)。このことは、メチル化に関連するエピジェネティック治療法が、単にアルツハイマー病病態を改善するだけにとどまらず、その範囲を拡大しうることをさらに示している。
アルツハイマー病サンプルで観察されているエピジェネティックなメチル化プロファイルの違いをさらに探求するために、いくつかの研究では、遺伝的リスクをよりよく特徴づけるために双子を利用していることさえある。同様の遺伝的リスクプロファイルを共有する参加者の血液中にアルツハイマー病に関連するエピジェネティックプロファイルの違いが検出されるかどうかを調べるために、モノ接合体およびジ接合体の双子ペアのReduced Representation Bisulfite Sequencingを行ったところ、双子ペアは、血液細胞だけではなく海馬細胞における異なるメチル化部位を含む、アルツハイマー病ARB2などのアルツハイマー病病理学的関連遺伝子のエピゲノムの違いを含んでいることが示された(Konki er al)。 アルツハイマー病ARB2変異体モデルは、記憶および学習障害、ならびにシナプス障害を示すことが知られている(Mladenova et al 2018)。死後のアルツハイマー病患者の脳におけるDNAメチル化およびヒドロキシメチル化のレベルを研究するための定量的免疫組織化学はまた、健康な双子と比較してアルツハイマー病双子で観察された同様の結果とアルツハイマー病患者における5-メチルシトシンおよび5-ヒドロキシメチルシトシンの有意な減少を示している。さらに、メチル化とハイペルメチル化のレベルは、海馬アミロイドプラークレベルと神経原線維のもつれと負の相関を持っていた、つまり、それらの同じアルツハイマー病患者におけるメチル化の減少は、それが因果的なイベントであるか、結果的なイベントであるかは不明であるが、アミロイドタンパク質やもつれの増加と相関していることを意味する。しかし、注意すべきは、サンプルサイズが、死後のアルツハイマー病サンプル10個、死後の対照サンプル10個、双子の1セットのみと少ないことである(Chouliaras et al 2013)。遺伝的リスクプロファイルを超えて、アルツハイマー病を最も効果的に標的化するためには、環境ライフスタイルのリスクプロファイルをよりよく理解することも重要である(Eid et al 2018)。DNAメチル化に基づく老化(生物学的エピジェネティックプロファイル年齢対実年齢)に関するこれまでの最大規模の研究では、5000人以上の個人を利用して遺伝的および環境的アルツハイマー病リスク因子を評価し、遺伝的因子ではなく生活習慣リスク因子に関して有意な関連を特定することができた。体格指数、コレステロール値、社会経済状態、高血圧、喫煙行動はすべて、アルツハイマー病および年齢加速エピジェネティックプロファイルと有意に関連していた(McCartney et al 2018)。
差動メチル化は様々なアルツハイマー病関連遺伝子で解明されてきたが、いくつかの研究では、代わりに、他のアルツハイマー病関連プロモーターでのアルツハイマー病進行におけるDNAメチル化の関与という考えに異議を唱えている。例えば、Nagata et al 2018)は、死後アルツハイマー病脳サンプルのNEPプロモーターで観察される差動メチル化がないという証拠を提供した(Nagata et al 2018)。NEPは、βアミロイドタンパク質の分解に関与するメタロプロテアーゼであり、アミロイドプラークが蓄積するアルツハイマー病病態において欠乏することが知られている(Turner et al 2004)。アルツハイマー病進行におけるNEPの正確なダウンレギュレーション機構はまだ説明されていない。全体として、メチル化がアルツハイマー病の進行と病理学において役割を果たしているという証拠は、あらゆる論争を超えており、したがって、アルツハイマー病のターゲティングにおけるエピジェネティック治療法を探求するための非常に強力なケースを提示している。
アルツハイマー病におけるクロマチンリモデラーとその他のヒストン修飾
クロマチンリモデラー
クロマチンリモデラーはクロマチンの調節に重要な役割を果たしているが、これらの酵素複合体が他のエピジェネティックなメカニズムと比較して、アルツハイマー病においてどのような役割を果たしているのかについては、現在のところ情報が不足している。しかし、クロマチンリモデラーとアルツハイマー病との関連性を示すデータは存在する。例えば、現在の研究では、CHDファミリーに属するクロマチンリモデラーであるCHD5がアルツハイマー病に重要な役割を果たしていることが明らかになっている。ほとんどのリモデリングATPaseはヒトの全身に発現しているのに対し、CHD5の発現は脳に限られている(Potts et al 2011)。さらに、CHD5の枯渇は、クロマチンリモデラーの別のファミリーであるSWI/SNFに影響を与える。CHD5が枯渇すると、CHD5は特に脳内に存在するSWI/SNFのサブユニットの発現レベルを変化させることで影響を与える。また、CHD5はアルツハイマー病に関与する遺伝子との関連性も指摘されており、CHD5はアルツハイマー病に関与する遺伝子を直接制御することが示されている(Potts et al 2011)。このように、CHD5の役割とアルツハイマー病との強い関連性が文書化されている。
追加の研究では、他のクロマチンリモデラーとアルツハイマー病との潜在的な関係も示されている。マイクロアレイ解析により、「SWI/SNF関連、マトリックス関連、クロマチンサブファミリーaのアクチン依存性調節因子もアルツハイマーと関連している可能性がある」ことが示されている(Guttula et al 2012)。さらに、INO80,プロテアソーム、およびRNAPII機械系もまた、INO80によるRNAPII分解を介して、潜在的にアルツハイマー病と関連していることが示されている(Poli et al 2017)。これらの関連性をさらに確認するためには、さらなる研究が必要であろう。
その他のヒストン修飾。リン酸化
他のヒストン修飾も同様に アルツハイマー病 で役割を果たすことが見られている。リン酸化は、ヌクレオソームのヒストンの尾にリン酸基が追加されたときに発生することができるヒストン修飾の一種である。支持神経細胞の一種であるアストロサイトのヌクレオソームにあるH2AXタンパク質が、DNAの二本鎖切断に反応してリン酸化されることが研究で明らかになっている。これが起こると、H2AXタンパク質のγH2AXへの変換が起こる。この変換は、特に脳の海馬と大脳皮質に位置するアストロサイトで多く見られる。興味深いことに、これらの領域は、アルツハイマー病で影響を受けることが知られているのと同じ領域である(Myung et al 2008)。上記の研究は、アルツハイマー病患者の剖検から得られた脳組織を用いて行われた。彼らは、アストロサイトDNAに見られるリン酸化が染色体の損傷を意味し、その領域の周囲のニューロンを支持する役割を妨げることを示している。
また、別のコアヒストン蛋白質のリン酸化も観察されている。コアヒストンタンパク質H4は、これらの同じタイプの細胞についてAPPがヌルであったラットと比較して、その神経芽腫細胞のAPPのレベルを有するラットにおいて、セリン-47上で有意に高いリン酸化レベルを有することが示されている。アルツハイマー病患者の脳の組織サンプルを用いた実験では、リン酸化されたH4の高レベルが観察され、これらの結果が確認された。H4リン酸化の阻害は、現在、著者らによって提案されているように、アルツハイマー病の病理学的進行に対する保護の潜在的な手段であると考えられているので、これらの知見は興味深いものである(Chaput et al 2016)。
さらに、アルツハイマー病におけるリン酸化の重要性を示唆する別の研究が、アンダーソンらによって発表された。アルツハイマー病に特徴的なアミロイド病理を模倣したアミロイド沈着を増加させたトランスジェニックマウスモデルを用いて、彼らはリン酸化によって大きく制御されるヒストンであるH3上のセリン57とスレオニン58のリン酸化を研究した。その結果、これらのトランスジェニックマウスでは、野生型に比べてセリン57のリン酸化が40%、スレオニン58のリン酸化が45%減少することが示された。さらに、セリン-57およびスレオニン-58の二重リン酸化部位の30%の減少が見られた。このリン酸化の減少は、より抑制されたクロマチン構造の結果と考えられており、これはアルツハイマー病で示されたエピジェネティックな閉塞と一致している(Anderson et al 2015)。このことは、リン酸化阻害をアルツハイマー病の潜在的な標的療法として使用する可能性を再び提供している。そのような治療法が可能であるかどうかを決定するためには、さらなる研究が必要であるが、これらの研究は、リン酸化の調節障害が、エピジェネティックなメカニズムがアルツハイマー病において果たす重要な役割のまだ別の例であることを強調している。
結論と将来への示唆
本レビューでは、アルツハイマー病で観察されるエピジェネティックな調節障害の概要を紹介することに集中していた。アルツハイマー病におけるエピジェネティック修飾障害の役割との関係は比較的最近のものであるが、この分野の研究量は増え続けており、その重要性が確認されている。このレビューで示されているように、エピジェネティックなメカニズム、特にDNAメチル化とヒストンのアセチル化と脱アセチル化のものは、通常のものと比較して、アルツハイマー病では明らかな調節障害を示すように、構築されている全体的な議論は、強いものである。
アルツハイマー病発症のリスクが最も高い個人をターゲットとし、可能な限り早期に積極的に治療を試みることができるようにすることが重要である。考慮すべき変数が非常に多く、このタスクは圧倒的に見えることができる。この衰弱性疾患の原因は一つだけではなく、状況、環境、ゲノム間の一連の相互作用である。ゲノム内であっても、年齢に関連する遺伝子(Desikan et al 2017)とエピジェネティクス(Lemche 2018)の両方が神経病理学的ペプチドおよびプラークの潜在的な蓄積に影響を及ぼす可能性があるため、考慮すべき複数の変数が存在する。
エピジェネティックプロファイルは、個人の生涯を通じて変化し得るが、特に年齢を超えて、ストレス、喫煙、アルコール使用、および食事などの因子が、すべてエピジェネティック発現および神経病理に影響を与え得るので(Lövblad et al 1997; Delgado-Morales et al 2017)エピジェネティックプロファイルは、個人の生涯を通じて変化し得る。
このことは、処方薬治療を超えて、教育された食事療法や運動ルーチンなどの健康的な生活選択が、アルツハイマー病の治療や進行予防においても重要であることを示唆しているかもしれない。
現在の研究に基づいて、ライフスタイルの変化に加えて、我々は特に病気をターゲットにするために使用することができるエピジェネティック治療の可能性を強調している。現在のところ、病気を治療したり、その進行を遅らせることができるアルツハイマー病の治療法は知られていないので、これは非常に重要である(Holtzman et al 2011; Lindsley 2012; Mitra et al 2019)。
アルツハイマー病における特定の遺伝子の関与に関して、エピジェネティック研究の周りにはまだいくつかの散発的な論争があるが、エピジェネティックな関連性をサポートする圧倒的な証拠は、さらなる注意を払う必要がある。私たちは、より多くの研究によって関係性がより明確になるだけでなく、より特異的な標的治療法の開発がアルツハイマー病の治療を支援するために生じると信じている。
