Contents
アルツハイマー病患者のアミロイドβオリゴマー形成と凝集
アミロイド薬の研究が失敗した理由は、間違った形態の分子をを追跡するように設計されていたのかもしれない。
アミロイドは頻繁にその形態や折り畳み方を変える「シェイプシフター」だ、しかし薬物は非常に特異的に形態にしか作用しない。
そのため、仮にアミロイド薬のようなムーンショット型の治療が承認されたとしても、病気の最も初期の段階にいる人々しか助けない可能性が非常に高いであろう。なぜなら、アルツハイマー病は、症状を現す前からすでに脳に変化が生じているからだ。
記憶障害を起こす頃には脳細胞は死滅しており、それらが(アミロイド薬によって)回復するのは疑わしい。[R][R]
ワシントン大学アルツハイマー病研究者
ランドール・ベイトマン
関連記事
![]() アミロイドβオリゴマーの毒性と蓄積を防ぐ22の治療アプローチ
アミロイドβオリゴマーの毒性と蓄積を防ぐ22の治療アプローチ
概要
アミロイドβオリゴマー仮説の歴史
アルツハイマー病につながる脳損傷は、可溶性アミロイドβオリゴマーによって引き起こされるというアミロイドβオリゴマー仮説は1998年に提案された。
アミロイドβオリゴマーに関する記事は4000以上も公開されており、400以上の査読論文が含まれている。
2013年に「アミロイドβカスケード仮説」から「アミロイドβオリゴマー仮説」に取って変わったとHaydenとTeplowによって提案された。[R][R]
様々なアミロイドβとアミロイドβオリゴマー
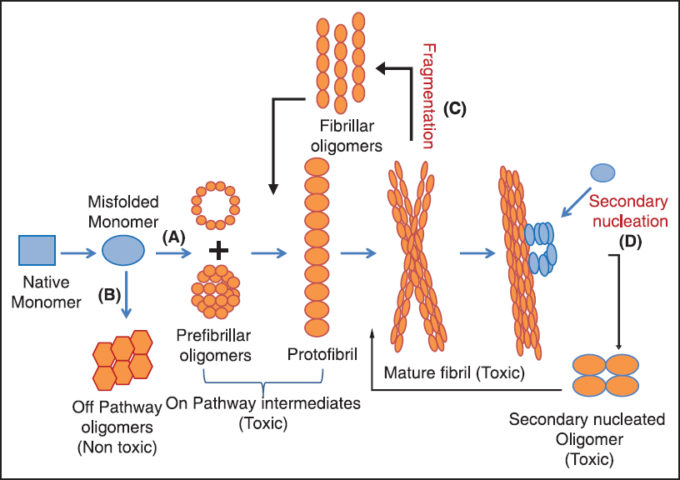
アミロイドβには大きく、単一のモノマー、中間体のオリゴマー、凝集したプラークに分類される。
アミロイドβオリゴマーは、アミロイドβの中でも最も毒性が強く病原性のある形態として広く認識されている。[R]
オリゴマー構造には、低オリゴマー(2~4マー)、高オリゴマー(12~48マー)、メガマー、とあり、形状は球状、前原繊維、環状に分類されている。
未解明のアミロイドβオリゴマー仮説
アミロイドβオリゴマーは多くの種類が特定されており、どの種がアルツハイマー病と関連するかは明らかになっていない。[R]
多くの種類のアミロイドβオリゴマーがアルツハイマー病と関連する毒性経路に関与する可能性と、少数のアミロイドβオリゴマーの種だけが関連する2つの可能性が考えられている。[R]
ただしアミロイドβオリゴマーの毒性種に関しては反する研究もあり、一般的な合意はあるが、完全な同意は成立していない。
Aβオリゴマー仮説の証拠
アミロイドβ抗体によるADマウスの改善
アミロイドβオリゴマーが認知症の発症に関わるという直接的な証拠は、ADマウスへのアミロイドβオリゴマー抗体使用によるアルツハイマー病症状と記憶能力の救済に基づく。[R]
アルツハイマー病患者の高いアミロイドβオリゴマー
またアルツハイマー病脳内では、アミロイドβオリゴマーの平均レベルは、モノマーをはるかに上回る[R][R]
多くの種類のアミロイドβオリゴマー
アミロイドβオリゴマー HMWとLMW
タイプ1・高分子量アミロイドβオリゴマー (HMW)/ピーク1<毒性種?>
毒性アミロイドβオリゴマーは分子量が50kDaより大きい高分子量であるように見える。[R] (アミロイドβモノマーは4.5kDa、プロトフィブリルとの境界線は100kDaあたり)
高分子量のアミロイドβオリゴマーのみが培養海馬ニューロンと結合できる。
フィブリルの形成は緩やか[R]
凝集繊維形成の経路外で形成される「off-pathway」
HMW毒性仮説
HMWアミロイドβオリゴマーは、ニューロン、ミクログリアへの毒性を誘発するLMWアミロイドβオリゴマーとアミロイドβプラークの間の中間種である可能性がある。
ヒトの脳内ではHMWとLMWは複雑な平衡状態を維持しており、アルツハイマー病患者ではHMWが優勢である可能性がある。[R]
アミロイドプラーク緩衝仮説
可溶性HMWアミロイドβは低分子量のLMW種に解離することにより、毒性オリゴマーのリザーバー(備蓄)として機能している可能性がある。[R]
アルツハイマー病脳から抽出された可溶性HMWを含むアミロイドβ凝集体の大部分は無害であり、可溶性、拡散性であったごく一部のアミロイドβが毒性を引き起こす。[R]
タイプ2・低分子量アミロイドβオリゴマー (LMW)/ピーク2<非毒性?>
非毒性アミロイドβオリゴマーは反対に50kDa未満の低分子量[R]
フィブリルを急速に形成する。[R]
凝集繊維を形成する経路上にある中間体「on-pathway」
LMWAβオリゴマーは、フィブリルを急速に形成するが、HMWでは緩やかな変化を示す。[R]
ピログルタミル化アミロイドβ
ピログルタミル化アミロイドβが総アミロイドβ濃度の5~33%含むときにアミロイドβのミスフォールディングを引き起こし非常に毒性の高い凝集体となる。[R]
さらに、アミロイドβの凝集速度も加速化する。[R]
ある研究グループは、アルツハイマー病患者の脳ではピログルタミル化アミロイドβオリゴマーが最も豊富なアミロイドβオリゴマー種である可能を発見した。[R]
ピログルタミル化アミロイドβは特にアミロイドβ42と混合すると、毒性の小さなオリゴマーとなり、アミロイドβ42単独よりも毒性が高くなる。混合アミロイドβオリゴマーは、タウ依存性毒性を示し、アミロイドβ42をプリオン様増殖するMWAアミロイドβオリゴマーにリモデリングするテンプレートとして機能する。[R]
アミロイドβ アセンブリ経路 オン&オフ-パスウェイ
アミロイドβオリゴマー種には、原繊維形状になるまでの経路上にある「on-pathway」と、その経路にはない「off-pathway」があるという仮説が多くのデータから支持されている。最も毒性が高いのは「off-pathway」オリゴマー種[R]
凝集経路の分岐点は二量体の段階で発生する。[R]
アミロイドβオリゴマーのタイプ1、2(HMW / LMW)分類と相関が見られており、HMWは「off-pathway」にあり、LMWは「on-pathway」にあることが示されている。
ジチロシン架橋・銅
銅はオリゴマーの立体配座でアミロイドβを安定化させる。[R]
高い銅と酸化ストレスの条件下で、アミロイドβのジチロシン架橋によるオリゴマー形成が促進される。これはアルツハイマー病の病因に重要な役割を果たす可能性がある。[R]
ジチロシンの架橋が少なくとも4量体までのアミロイドβの自己組織化を促進することが予測されている。[R]
銅の比率が異なるとアミロイドβ凝集に異なる影響をおよぼす。
細胞外または細胞内?
細胞外Aβオリゴマー
プリオン様伝播
アミロイドタンパク質の小さな細胞外オリゴマーはプリオン様拡散の傾向が高く、一方、大きな細胞内オリゴマーはプリオン様拡散の傾向が低いと予測されている。[R] したがって、プリオン様拡散仮説に基づくと(細胞内に蓄積し)細胞外に分泌されたアミロイドβオリゴマーが毒性をもつことが示唆される。[R]
免疫組織化学染色
また多くの免疫組織化学研究、ヒトサンプルの高分解能EM研究は、シナプス終末で細胞内にアミロイドβオリゴマーが存在することを示す。[R]
細胞内Aβオリゴマー
アストロサイトへの蓄積
アミロイドβオリゴマーは細胞内プールからも放出される。さらにアミロイドβオリゴマーの形態は不明だがアストロサイトにも蓄積するように見える。[R]
ミクログリアへの取り込み
ミクログリアにも取り込まれることが明らかになっており、細胞内外に存在し動的に交換されている可能性が高い。[R]
コリン作動性ニューロン内
ヒト組織では、コリン作動性ニューロン細胞内でアミロイドβオリゴマーが同定されており、コリン作動性欠乏における役割が示唆されている。[R]
ApoE
これまでのデータからは、低分子量のアミロイドβオリゴマーが高分子量のオリゴマーに先行しており、複数の研究がアミロイドβの凝集、クリアランスがApoEの影響を受けていることが示唆される[R]
ApoEとアミロイドβ間の相互作用をブロックすると、アミロイドβのニューロン内蓄積が減少し、シナプス変性が抑制される。[R]
軸索輸送障害
ニューロン細胞内のアミロイドβは、初期に軸索輸送の軸索欠損を生じさせることが示されている。[R]
アミロイドβオリゴマー vs タウ
上流に位置するアミロイドβ?
アミロイドβオリゴマーはアルツハイマー病病因においてタウの上流にあり、その逆ではないという仮説が示されている。[R]
しかし、コンセンサスはなく、一部の研究ではアミロイドβオリゴマーとタウの間のクロストークが実証されており、一部の研究ではアミロイドβオリゴマーとタウは別々に作用することが実証されている。[R]
アミロイドβオリゴマーは原線維の非存在下で、培養ニューロンのタウ過剰リン酸化を誘導できることが実証された。[R]
アミロイドβオリゴマーはタウの樹状突起を誤った場所に再分布し、微小管とスパインの破壊を引き起こす[R]
アミロイドβオリゴマーは、タウ依存性の微小管切断を誘発することも示されている。[R]
アミロイドβオリゴマーはシナプス毒性を示す。タウ依存性のスパイン喪失とタウの過剰リン酸化につながる。[R]
アミロイドβオリゴマーは、タウの最も有毒な形態であると考えられているタウオリゴマーを形成し播種することができる[R]。
アルツハイマー病脳では、アミロイドβオリゴマーがリン酸化タウ(p-Tau)に先行し、リン酸化タウののシナプス拡散を促進する[R]
タウオパシーマウスモデルのタウ病理の広がりは、APP Tgマウスとの交配によって加速されることが知られている。[R]
ニューロンと結合したアミロイドβオリゴマーがエキソソーム内でニューロンからリン酸化タウを放出する可能性があることが示唆されている。これはアミロイドβオリゴマーが誘発するタウ病理拡散の潜在的メカニズムを示唆する。[R]タウのこの放出は、インスリンの存在によって増加した。[R]
アミロイドβオリゴマーの毒性メカニズム
オリゴマーがフィブリルよりも毒性をもつ理由
1.オリゴマー表面の疎水性部分はβ-シートが露出されているが、フィブリルでは相互に組み合わさってフィブリル内部に隠れる。
2.オリゴマーはサイズがより小さいため、より長いフィブリルと比較して組織内を容易に拡散することができる。
3.オリゴマーの開かれている活性末端の数がフィブリルよりも多く存在するため、オリゴマーと細胞標的との相互作用がより促進される。
4.オリゴマーは非常に不安定な無秩序構造であり、フィブリルは安定した組織化分子である。

www.tandfonline.com/doi/abs/10.1586/ern.10.29?journalCode=iern20
アミロイドβオリゴマーがどのように病理学的変化を引き起こすのか、なぜ一部の細胞のみに影響を与えるのか、いくつかの仮説はあるが十分な答えが得られていない。
受容体仮説
PrPc仮説
細胞プリオンタンパク質(PrP c)は潜在的にアミロイドβオリゴマーと高い親和性をもつ受容体である。[R][R]

www.ncbi.nlm.nih.gov/pmc/articles/PMC6004937/
アミロイドβオリゴマーの毒素受容体リスト
- 代謝型グルタミン酸受容体5(mGluR5)
- NMDAR
- シグマ-2受容体/プロゲステロン受容体膜成分1(PGRMC1)
- Wnt受容体 Frizzled
- ニューロリギン
- エフリンB型受容体2(EphB2)
- エフリンA型受容体A(EphA4)
- p75ニューロトロフィン受容体(p75NTR)
- α7-ニコチン性アセチルコリン受容体(α7nAChR)
- アドレナリン受容体
- 糖化最終産物受容体(RAGE)
- カルシウムチャネル
- 白血球免疫グロブリン様受容体サブファミリーBメンバー2(LILRB2)/対Ig受容体B(PirB )
- N-ホルミルペプチド受容体2(FPR2)
- 免疫グロブリンガンマのFc領域受容体II-B(のFc γ RIIB)
- 一過性受容体電位メラスタチン2(TRPM2)
- インスリン受容体(IR)
- AMPA受容体
www.ncbi.nlm.nih.gov/pmc/articles/PMC6004937/
なぜこれほど多くの受容体があるのかはわかっていないが、様々な形態のアミロイドβオリゴマーがあるため、様々な膜タンパク質と相互作用する可能性があって不思議ではない。
候補受容体 Na + K + ATPase alpha3サブユニット(NKAα3)
[R]

