関連記事
概要
はじめに
アルミニウムがアルツハイマー病を引き起こすかもしれないという仮説は有名だが、鉄分がアルツハイマー病を引き起こすかもしれないという仮説は、ほとんど知られていないように思う。女性は特に「鉄は意識してたくさん摂らないといけないミネラル」ぐらいに思っている方も多いのではなかろうか。
鉄は必須ミネラルとして酸素の輸送や、細胞の増殖、細胞周期など深く代謝と関わっている。鉄は神経細胞のミエリン鞘の合成にも必須の材料でもあるため、極端に不足すると脳の回復が難しくなってしまう。酸素を使った好気性回路が機能不全に陥り、酸化ストレスも生み出す。
鉄の適正量の難しさ
鉄代謝の専門家同士でも分かれる鉄必要量
鉄は扱いの難しいミネラルであることには間違いない。もちろん一定量必要であることは確かなのだが、どれくらいが最適なのかとなると非常に判断が難しく、研究者の間でも議論が別れている。
多くてもダメ、少なくてもダメは当然としても、多少の欠乏にさえ、その人の生活環境、疾患などによってはメリットもある。
細菌と宿主の鉄取引
鉄分は人間、動物、植物だけではなく細菌にとっても重要かつ希少な資源であり、細菌の宿主であるわれわれも細菌たちに鉄分をとらせまいと、ありとあらゆるメカニズムを進化させてきた。感染時には、体内温度を上げて活性酸素を増やし細菌を撃退しようとするだけではなく、白血球内因性媒介物質(LEM)を分泌し血中の鉄分を大幅に減らそうとする。
感染がおこると腸からの鉄分吸収量が減少することもわかっている。インフルエンザと闘っている最中には、ハムや卵のような鉄分の多い食品は、ムカつきやすかったりもする。

低鉄による感染防御
実際にアフリカの多くの民族は体内の鉄を低い状態に保つことで、寄生虫や細菌感染から身を守っている。ある研究者が、ソマリの遊牧民の鉄分レベルが低かったので、鉄分を与えたところ、8%だったアメーバ感染率が一ヶ月後には38%に上昇した事例がある。。
さらに、マサイ族へ鉄剤を与えた事例では、アメーバ感染率が10%から88%にまで上がってしまった!
母乳の鉄キレート効果
その他にも、母乳に含まれているラクトフェリンには鉄キレート効果があるが、これも鉄を奪うことで細菌増殖を抑制し、免疫が未熟な新生児を守るためだと考えられている。牛乳にはラクトフェリンが2%しか含まれていないため、牛乳で育てられた赤ちゃんは病気に感染しやすくなることが知られている。鉄摂取の是非は、賛否両論が別れるゆえんでもある。
過剰な鉄は排出されない
行きはよいよい排出はむずかしい
鉄の補給や排出にも難しさがある。鉄は他の栄養素と異なり能動的な排出経路を持たずに、ずっと鉄を体内でリサイクル利用する。そのため、身体が、「鉄が多すぎる!」と思っても体外へは自動排出されない。(汗や皮膚代謝でほんのわずかには排出される)
鉄のバランスは小腸から鉄吸収をさせないようする方法と、血中に入ってしまった過剰な鉄はフェリチン/ヘモジデリンという格納庫に収める、といった消極的な方法でしか制御できない。
深刻化しやすい過剰鉄
そのため、鉄過剰の問題は深刻となりやすく、血清鉄やフェリチン値が病院では標準範囲内であっても鉄過剰のリスクは存在する。「鉄剤などの摂取はもっと慎重に行われるべき」という鉄代謝を専門に研究している学者の意見は多数あるのだが、このことを知らない医者も多い。
多くの疾患と関わる過剰鉄
鉄の過剰問題はアルツハイマー病などの神経変性疾患を抱えた人たちだけでなく、ガンリスクの増加、2型糖尿病、非アルコール性脂肪肝(NAFLD)、免疫機能の低下など、健康な若年者や高齢者であってもリスクとして関係してくる。
神経変性疾患との関連
鉄の蓄積とアルツハイマー病を含む神経疾患の関係は、20年以上前から研究者によって関連が示唆され続けてきた。しかし、これまで研究結果の不一致ということもあり、(鉄の過剰症患者がみな神経疾患を引き起こすわけではない)それほど強く取り上げられなかった。
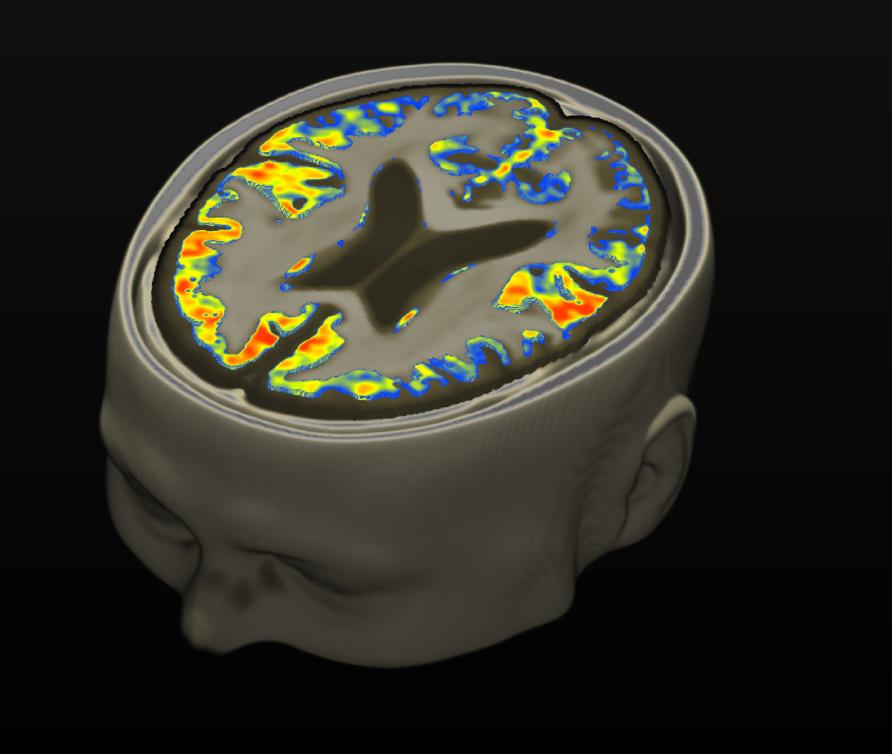
しかしMRI技術の高度化により(MRIで脳組織が過去に鉄障害を受けたかどうかを診断できるようになった)少なくとも脳の鉄沈着と神経変性疾患、通常の老化も含め考えられていたよりも強い相関関係があることがわかってきた。
脳内鉄分布の不均衡
鉄代謝機構の異常
少なくとも、アルツハイマー病の場合、単純に鉄の過剰が原因となっているわけではなく、おそらくは脳の鉄ホメオスタシス作用を担う機構のいくつかが損傷している可能性がある。
そして、そのことにより脳の部位によって鉄蓄積と枯渇といった鉄の不均衡が生じていることが、アルツハイマー病と関係する鉄過剰症の問題の根幹だろうと推測されている。
対照群と比べたアルツハイマー病患者の脳鉄濃度の増加部位
鉄過剰 vs 鉄欠乏の誤解
つまりアルツハイマー病患者においては、鉄不足または鉄過剰という表現はミスリーディングを引き起こすかもしれない。鉄恒常性機能の修復または、鉄の恒常性調節を担う因子を補強していくことを含めるようなシステミックな治療が必要かもしれない。
しかし、現状の段階ではそこまでの治療研究は行われておらず、実際問題としては鉄をなるべく摂取しない、鉄キレート剤などを利用して、体内の血清鉄やフェリチン濃度を減少させていくことで、還元剤などで生体不安定鉄の総量を減らしていくなどといったことが治療方法として提案されている。
これは体内鉄を減らすことが、過剰鉄の解消だけではなく鉄の分布や生体不安定鉄に影響を与えることとも関連しており、アルツハイマー病の創薬研究においても鉄キレート剤を使った研究がなされている。
最後に
鉄代謝とアルツハイマー病をまとめるほどの力量はないので(汗)、いくつか、関連論文を紹介しながら、調べたことも含め別記事でメモ書きとして書いていきたい。